ИСПОЛЬЗОВАНИЕ ПЦР-ГЕНОТИПИРОВАНИЯ НА ВЫБОРКЕ ИНДЕЕК ИЗ СОЗДАВАЕМОГО СРЕДНЕГО КРОССА
ИСПОЛЬЗОВАНИЕ ПЦР-ГЕНОТИПИРОВАНИЯ НА ВЫБОРКЕ ИНДЕЕК ИЗ СОЗДАВАЕМОГО СРЕДНЕГО КРОССА
Аннотация
Создание нового среднего кросса индеек отечественной селекции должно сопровождаться надёжной схемой профилактических и противоэпизоотических мероприятий, которые основываются на применении современных молекулярно-генетических методов. Проводимые исследования были выполнены с использованием ПЦР-генотипирования бактериальных изолятов, выделенных у индеек при создании нового среднего кросса. Отбор проб производился у взрослой павшей птицы на производственной базе СГЦ «СКЗОСП» в 2023 году для выявления микроорганизмов бактериальной природы с последующим изучением спектров при RAPD-PCR-генотипировании с праймерами ERIC и М13. Анализ полученных генетических профилей показал существенное генетическое разнообразие бактериальных изолятов. Данные, полученные по двум RAPD праймерам, хорошо согласовывались друг с другом.
1. Введение
Циркулирование возбудителей бактериальных инфекций во внешней среде приводит к периодическим вспышкам заболеваний , , . Такое заболевание как колибактериоз, несёт особую угрозу, так как в промышленных условиях индейки находятся при определённой плотности посадки. Биологические особенности современных промышленных кроссов предрасполагают к острому течению многих инфекционных заболеваний, снижению рентабельности производства.
В настоящее время постоянно обнаруживаются резистентные бактерии к новейшим препаратам. Проблема антибиотикорезистентности микроорганизмов наиболее актуальна в отрасли птицеводства, в нашем случае для индейководства. Снижение актуальности этой проблемы достигается как контролируемым применением антибиотиков, так и использованием генотипирования в профилактических целях , . Разработка системы контроля бактериальных болезней индеек в промышленных условиях с использованием быстрой диагностической процедуры на основе RAPD-PCR и других методов генотипирования является одним из путей решения , , . Тестирование микроорганизмов на чувствительность к антибиотикам как традиционным методом индикаторных дисков, так и с использованием ПЦР-генотипирования позволяет определить антибиотикорезистентность по генетической природе микроорганизмов для последующей корректировки схемы ветеринарно-санитарных мероприятий , , в том числе и в индейководстве.
Цель исследований: целью научно-исследовательской работы являлось определение антибиотикорезистентности патогенной и условно-патогенной микрофлоры, выделяемой у индеек создаваемого среднего кросса СГЦ «СКЗОСП» для составления схем ветпрофилактики и биозащиты, подбор условий для выявления методом RAPD-PCR генетических вариантов патогенных штаммов E. coli – актуального патогена птиц промышленных пород.
2. Методы и принципы исследования
Исследования были проведены на производственной базе СГЦ «СКЗОСП» – филиала ФНЦ «ВНИТИП». В соответствии с государственным заданием в СГЦ проводится работа по созданию нового среднего кросса индеек. После завершения всех регистрационных процедур кросс получит свое официальное название. Совместно с исполнителями темы от ВНИВИП – филиала ФНЦ «ВНИТИП» было проведено клиническое обследование всего поголовья индеек, проанализированы меры биобезопасности, исследована действующая схема профилактических и противоэпизоотических мероприятий, проведено вскрытие павшей индейки, отобран патологический материал для дальнейшего бактериологического и ПЦР-анализа. Бактерии выделяли также из 20 клинически здоровых индеек для молекулярно-генетического исследования. Данные работы проводились в лаборатории молекулярной генетики ВНИИГРЖ (лаборатория имеет статус «Лаборатория молекулярно-генетической экспертизы», который был выдан в соответствии с приказом № 605 МСХ РФ 29 декабря 2018 г. со сроком действия на 5 лет). Биопробы из внутренних органов индеек помещены в транспортную среду Кэри-Блэйра. После транспортировки все пробы пересеяны на питательную среду для культивирования аэробных и факультативно-анаэробных микроорганизмов: мясопептонный бульон для дальнейшего термостатированния при 37оС. Через 24 часа сделаны пересевы на дифференциально-диагностические среды – XLD-агар, агар Эндо, энтерококк агар, желточно-солевой агар, мясопептонный агар. Выделенные на дифференциально-диагностических средах культуры в дальнейшем исследованы на определение чувствительности к антибактериальным препаратам диско-диффузионным методом на среде Мюллера-Хинтона. В результате бактериологического исследования проб внутренних органов и проб смывов с клоаки были выделены 22 культуры E.coli, которые служили объектом для ПЦР-генотипирования. Из них 20 изолятов представляли собой культуры, выращенные из мазков клоаки индеек. Помимо этих изолятов в анализ были включены также бактериальные культуры, полученные от павшей индейки под номерами 21 и 22.
Объектом исследования по генотипированию методом RAPD-PCR являлись изоляты бактерий Escherichia coli, выделенные из органов павшей индейки, а также из здоровых особей. Механизм детекции различий методом ПЦР заключается в разных местах связывания праймеров у разных видов и штаммов, что приводит к амплификации фрагментов ДНК разной длины.
Условия ПЦР для праймеров ERIC и М13: 95оС – 3 минуты, потом 45 циклов: 95оС – 15 секунд, 37оС – 15 секунд, 72оС – 60 секунд, в конце 72оС – 3 минуты. После завершения ПЦР образцы переносятся в лунки 1,5% агарозного геля и проводится электрофорез в течении 3-х часов при напряжении 100 вольт (примерно 5В/см). В гель предварительно вносится бромид этидия для визуализации свечения полос ДНК. В качестве маркера длин фрагментов ДНК использован GeneRuler (Thermo Fischer™) и ДНК фага λ, обработанная рестриктазой HindIII. Визуализация результатов проводилась с помощью окраски ДНК бромидом этидия на стадии перенесения в лунки геля и гель-документации под УФ-светом в трансиллюминаторе ECX-F20.M Vilber Lourmat.
3. Основные результаты
В 2023 году проведено выделение на дифференциально-диагностических средах культур, которые в дальнейшем подвергались культурально-биохимическим исследованиям и определению чувствительности к антибактериальным препаратам диско-диффузионным методом на среде Мюллера-Хинтона (Табл. 1).
Таблица 1 - Определение чувствительности выделенных культур микроорганизмов, к антимикробным препаратам диско-диффузионным методом
Культура микроорганизмов | Место выделения | Чувствительна | Погранична | Устойчива |
Escherichia coli | Селезенка, почка | Флорфеникол, энрофлоксацин, ципрофлоксацин, меропенем, левофлоксацин | Доксициклин, фосфомицин, пефлоксацин, амоксициллин-клавулановая кислота | Амоксициллин, Ко-тримоксазол, тетрациклин, налидиксовая кислота, азитромицин |
Enterococcus faecalis | Почка, легкое | Ванкомицин, амоксициллин | - | Доксициклин, левофлоксацин, ципрофлоксацин, тетрациклин, |
Staphylococcus xylosus | Легкое | левофлоксацин | - | Тетрациклин, азитромицин, ванкомицин, доксициклин, ципрофлоксацин, амоксициллин |
Proteus mirabilis | Печень, сердце, почка, селезенка, легкое, красный костный мозг | Флорфеникол, энрофлоксацин, амоксициллин, Ко-тримоксазол, меропенем, фосфомицин, амоксициллин+ клавулановая кислота, левофлоксацин | Ципрофлоксацин | Доксициклин, тетрациклин, налидиксовая кислота, пефлоксацин, азитромицин |
В результате бактериологического исследования проб внутренних органов и проб смывов с клоаки были выделены 22 культуры E.coli, которые служили объектом ПЦР-генотипирования. Из них 20 изолятов представляли собой культуры, выращенные из мазков клоаки индеек. Помимо этих изолятов в анализ были включены также бактериальные культуры, полученные от павшей индейки под номерами 21 и 22.
В результате проведения ПЦР-генотипирования c использованием праймеров ERIC получены генетические профили изучаемых бактерий (Рис. 1) с формированием трех групп. К первой группе относятся изоляты под номерами 9, 10 и 11, второй – 7 и 16, третьей – 2, 4, 5 и 17. У отдельных изолятов праймеры ERIC не привели к четкой амплификации ДНК: 1, 4, 8, 13. Изоляты 21 и 22 были выделены из почки и селезенки павшей особи, видно, что между генетическими профилями есть различия. Данное наблюдение свидетельствует о возможности циркулирования разных штаммов в одной особи (в разных органах). В связи с тем, что праймеры ERIC выявляют малое число фрагментов ДНК в геномах E.coli, не удивительно, что у некоторых штаммов амплификат отсутствовал. Для достижения большей дискриминационной способности необходимо проведение генотипирования с большим числом праймеров и комбинирования этих результатов.
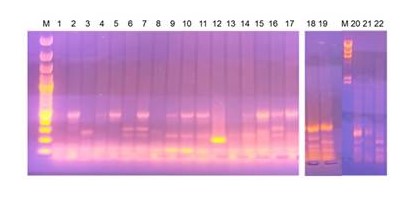
Рисунок 1 - Результаты генотипирования 22 изолятов E.coli методом ПЦР с парой праймеров ERIC:
1-17 – смыв из клоаки индеек (выделение изолятов 07.04.23); 18-20 – смыв из клоаки индеек (выделение изолятов 21.04.23); 21 – изолят из почки павшей индейки (выделение изолята 07.04.23); 22 – изолят из селезенки павшей индейки (выделение изолята 07.04.23)
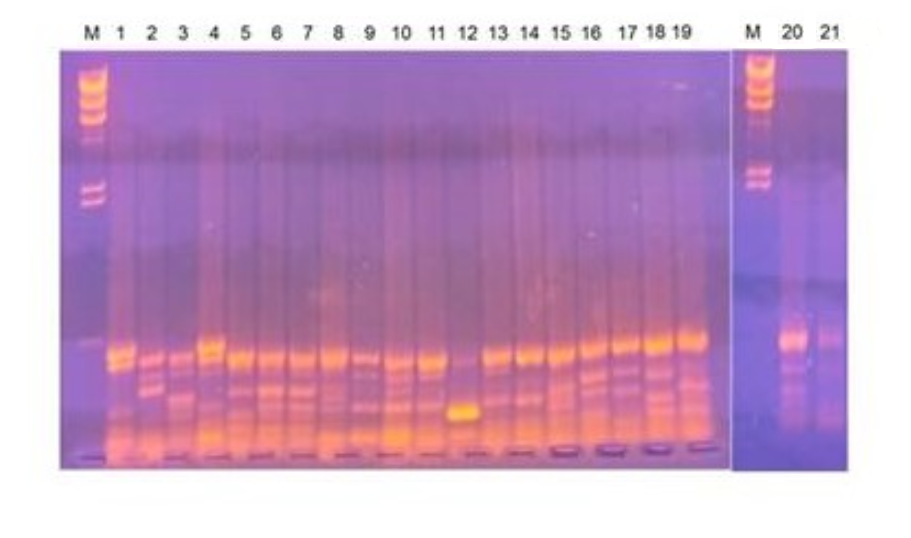
Рисунок 2 - Результат генотипирования 21 изолятов E. coli с универсальным праймером М13:
1-19 – смывы из клоак здоровых индеек; дорожка 20 – изолят из почки павшей индейки; дорожка 21 – изолят из селезёнки заболевшей индейки
4. Заключение
В 2023 году в СГЦ «СКЗОСП» – филиале ФНЦ «ВНИТИП» были продолжены исследования бактериальных изолятов от индеек создаваемого среднего кросса. Научная новизна работы заключается в валидации RAPD-PCR-метода генотипирования с применением праймеров ERIC и М13 на изолятах, полученных от индеек. Показано существенное генетическое разнообразие изолятов данной бактерии и хорошая воспроизводимость результатов при генотипировании с разными праймерами (ERIC и M13). Данный метод по генотипированию изолятов E. coli является одним из самых быстрых и не дорогих подходов к идентификации бактериальных штаммов. Результатом исследования используются при составлении схем ветеринарно-профилактических и противоэпизоотических мероприятий для поголовья индеек.
