О ВОЗМОЖНОСТИ ИСПОЛЬЗОВАНИЯ БАЗИДИОМИЦЕТА INONOTUS OBLIQUUS ДЛЯ БИОТЕХНОЛОГИЧЕСКОГО ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОГО ВЕЩЕСТВА ГИСПИДИНА
О ВОЗМОЖНОСТИ ИСПОЛЬЗОВАНИЯ БАЗИДИОМИЦЕТА INONOTUS OBLIQUUS ДЛЯ БИОТЕХНОЛОГИЧЕСКОГО ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОГО ВЕЩЕСТВА ГИСПИДИНА
Аннотация
Проведена оценка наличия и динамики содержания гиспидина (ГП) в питательной среде при культивировании высшего гриба Inonotus obliquus в погруженных условиях. Наличие ГП в образцах питательной среды определяли оригинальным методом с помощью ферментной люминесцентной системы из светящегося мицелия базидиомицета Armillaria borealis. Содержание ГП рассчитывали из значений максимальной интенсивности световой эмиссии, регистрируемой в ходе проведения люминесцентной реакции с образцами среды. Показано, что при использованных условиях погруженного культивирования (состав и объем питательной среды, объем вносимого инокулята, постоянное радиальное перемешивание культивируемого объема, температура и время выращивания) наблюдается рост мицелия I. obliquus в виде шарообразных пеллет с большим количеством поверхностных выростов – гиф. Установлено, что в процессе роста базидиомицет продуцирует и секретирует ГП в питательную среду. Наличие ГП в питательной среде обнаруживается на 7-е сутки выращивания, содержание ГП в питательной среде возрастает и достигает максимальных значений на 11-13-е сутки культивирования и его концентрация в это время может составлять 0,5-0,7 мг на 1 мл среды. Перенос выросших пеллет мицелия в свежий объем питательной среды и продолжение культивирования вновь сопровождается накоплением ГП в среде. Совокупность полученных данных позволяет говорить о возможности использования базидиомицета I. obliquus для биотехнологического получения ГП – ценного биоактивного вещества для биомедицинских приложений.
1. Введение
Базидиомицет Inonotus obliquus (трутовик скошенный, березовый гриб, медицинский гриб чага) содержит большой набор биоактивных веществ и со времен Авиценны используется в народной медицине . Данный гриб внесен в Государственную фармакопею РФ , официально разрешен к применению в медицинской практике и в настоящее время рассматривается в качестве неспецифического средства для лечения ряда заболеваний желудочно-кишечного тракта (в частности, гастритов, язвенной болезни желудка и двенадцатиперстной кишки, полипозов) и предраковой терапии .
Известно, что I. obliquus продуцирует ряд биологически активных полифенольных пигментов класса стирилпиронов, в том числе гиспидин (ГП), являющийся ценным соединением для биомедицинского применения , . В работах многих авторов сообщается, что синтезируемый высшими грибами поликетид ГП обладает положительными фармакологическими эффектами (в частности, антиоксидантным, противовоспалительным и противоопухолевым) , , , . Исходя из этого, базидиомицет I. obliquus можно рассматривать в качестве перспективного источника для получения ГП.
Однако выделение ГП из природной биомассы гриба I. obliquus (бесплодная часть грибницы – склероций) сопряжено с рядом объективных недостатков и трудностей. Известно, что рост гриба в природных условиях и накопление в его биомассе целевых продуктов происходит очень медленно и может составлять до 10-ти и более лет , . В свою очередь, это сопряжено с проблемой воспроизводимости природного сырья. Содержание целевого продукта (продуктов) в биомассе гриба, выросшего в неконтролируемых природных условиях, может существенно различаться. Наблюдающаяся в последние годы крупномасштабная заготовка чаги и ее экспорт в зарубежные страны (прежде всего, в Китай, Корею и Японию) может значительно снизить (или полностью уничтожить) популяцию этого ценного гриба в России.
Для устранения изложенных выше проблем рациональным решением является переход на биотехнологию искусственного культивирования базидиомицета I. obliquus. К наиболее важным преимуществам такого подхода относятся: выращивание биомассы грибного мицелия в контролируемых условиях, возможность их оптимизации для увеличения выхода биомассы и содержания в ней целевого продукта (продуктов), снижение временных затрат на получение биомассы, решение проблемы воспроизводимости исходного сырья. При этом, в отличие от выделения целевых продуктов из природной биомассы I. obliquus, при работе с культурой гриба появляется возможность упрощения процедуры их извлечения из биомассы и питательной среды. Поскольку известно, что ГП является вторичным метаболитом высших грибов и растений , при культивировании базидиомицета I. obliquus в погруженных условиях он может секретироваться в питательную среду. Целью представленной работы являлась экспериментальная оценка наличия и динамики содержания ГП в питательной среде при культивировании базидиомицета I. obliquus в погруженных условиях.
2. Материалы и методы исследований
В исследованиях использовали мицелий базидиомицета I. obliquus (штамм IBSO 2430) из Коллекции микроорганизмов CCIBSO 836 Института биофизики ФИЦ КНЦ СО РАН (Красноярск). Образцы мицелия получали при культивировании гриба в погруженных условиях. Выращивание биомассы проводили в конических колбах объемом 300 мл, содержащих 100 мл жидкой PDB среды (картофельный экстракт – 4 г/л, глюкоза – 20 г/л) (HiMedia Laboratory, Индия). Выбор питательной среды определялся тем, что по нашим предварительным данным в ней наблюдался достаточно быстрый рост биомассы мицелия. Инокулятом являлся мицелий I. obliquus, предварительно выращенный на агаризованной PDB среде в чашках Петри (TTP, Швейцария) при температуре 24°С (термостат ТСО 1/80 СПУ, Россия). Пленочный мицелий в стерильных условиях (ламинар Labconco, США) срезали с поверхности твердой питательной среды, протирали через металлическое сито (размер пор 1/1 мм). Измельченную биомассу вносили в жидкую PDB среду, объем инокулята составлял 2-5% от объема среды. Культивирование проводили при температуре 25°С и постоянном перемешивании со скоростью 140-170 об/мин (шейкер-инкубатор ES-20, BIOSAN, Латвия).
В процессе культивирования через определенные промежутки времени в стерильных условиях (ламинар Labconco) отбирали пробы питательной среды по 500 мкл. Пробы центрифугировали при 16000g (Centrifuge 5415R, Eppendorf, Германия) в течение 5 мин при 4°С для удаления мелких фрагментов мицелия. Супернатанты отбирали и определяли в них наличие ГП с помощью ферментной люминесцентной системы, выделенной из светящегося мицелия базидиомицета Armillaria borealis . В настоящее время считается доказанным, что ГП является прекурсором люциферина светящихся высших грибов и при функционировании грибной люминесцентной системы сначала преобразуется НАДФН-зависимой гидроксилазой в люциферин (3-гидроксигиспидин), который затем окисляется люциферазой с излучением кванта видимого света . Люминесцентный метод тестирования ГП является высокочувствительным и позволяет быстро (в течение нескольких минут) выявлять ГП в биологических пробах с пределом обнаружения 5,4⋅10–5 мкМ (1,3⋅10–11 г) . При этом для сравнения следует сказать, что наиболее часто применяемый в лабораторных условиях метод тестирования ГП в грибных экстрактах основан на регистрации времени его удерживания на колонках при проведении ВЭЖХ – достаточно сложной и многостадийной процедуры, требующей специализированного хроматографического оборудования и значительных затрат времени . Люминесцентным методом наличие ГП определяли также в биомассе грибного мицелия. Для этого выросшие пеллеты мицелия извлекали из питательной среды, промывали деионизированной (ДИ) водой (Milli-Q system, Millipore, США) для удаления остатков среды и метаболитов и измельчали протиранием через сито (см. выше). К измельченной биомассе добавляли ДИ воду в соотношении 1:2 (вода:биомасса, объем/объем), образец помещали в микроволновую печь MW 712BR (Samsung, Малайзия) и нагревали при 800 Вт до закипания. После этого образец охлаждали на льду и центрифугировали при 16000g (Centrifuge 5415R) в течение 10 мин при 4°С. Супернатант отбирали и использовали для люминесцентного определения ГП. Тестирование проводили следующим образом. Прозрачные пластиковые пробирки (Eppendorf, Германия), содержащие 50 мкл препарата ферментной люминесцентной системы, помещали в люменометр (Glomax® 20/20, Promega BioSystems Sunnyvale, Inc., США) и регистрировали исходный уровень свечения. Затем к препарату добавляли 5 мкл раствора 10 мМ НАДФН (Serva, Германия), приготовленного in situ в ДИ воде, и регистрировали развитие люминесцентного сигнала. Наличие светового сигнала после добавки НАДФН свидетельствует о наличии в препаратах люминесцентной системы A. borealis эндогенного ГП, который утилизируется в реакции излучения, и является показателем функциональной активности ферментов системы . После снижения интенсивности светового сигнала до стационарного уровня к системе добавляли 5 мкл образца питательной среды (или экстракта из мицелия) и вновь регистрировали развитие светового сигнала, отражающего наличие ГП в тестируемом образце. Интенсивность свечения регистрировали в режиме 1 измерение в 1 сек и выражали в относительных единицах. Концентрацию ГП в тестируемых образцах определяли по уровню максимальной интенсивности световой эмиссии, используя калибровочный график, полученный ранее с использованием растворов с известной концентрацией ГП высокой степени чистоты (Sigma-Aldrich, США) .
3. Результаты и их обсуждение
Как показали исследования, при использованных условиях глубинного культивирования базидиомицета I. obliquus в жидкой питательной PDB среде наблюдается рост грибного мицелия в виде шарообразных пеллет с большим количеством поверхностных выростов – гиф (рис. 1).

Рисунок 1 - Внешний вид пеллет мицелия I. obliquus на 15-е сутки культивирования гриба в погруженных условиях
Примечание: регистрация изображения с помощью фотокамеры PowerShot S50 (Canon, Япония); масштабная линейка – 5 мм
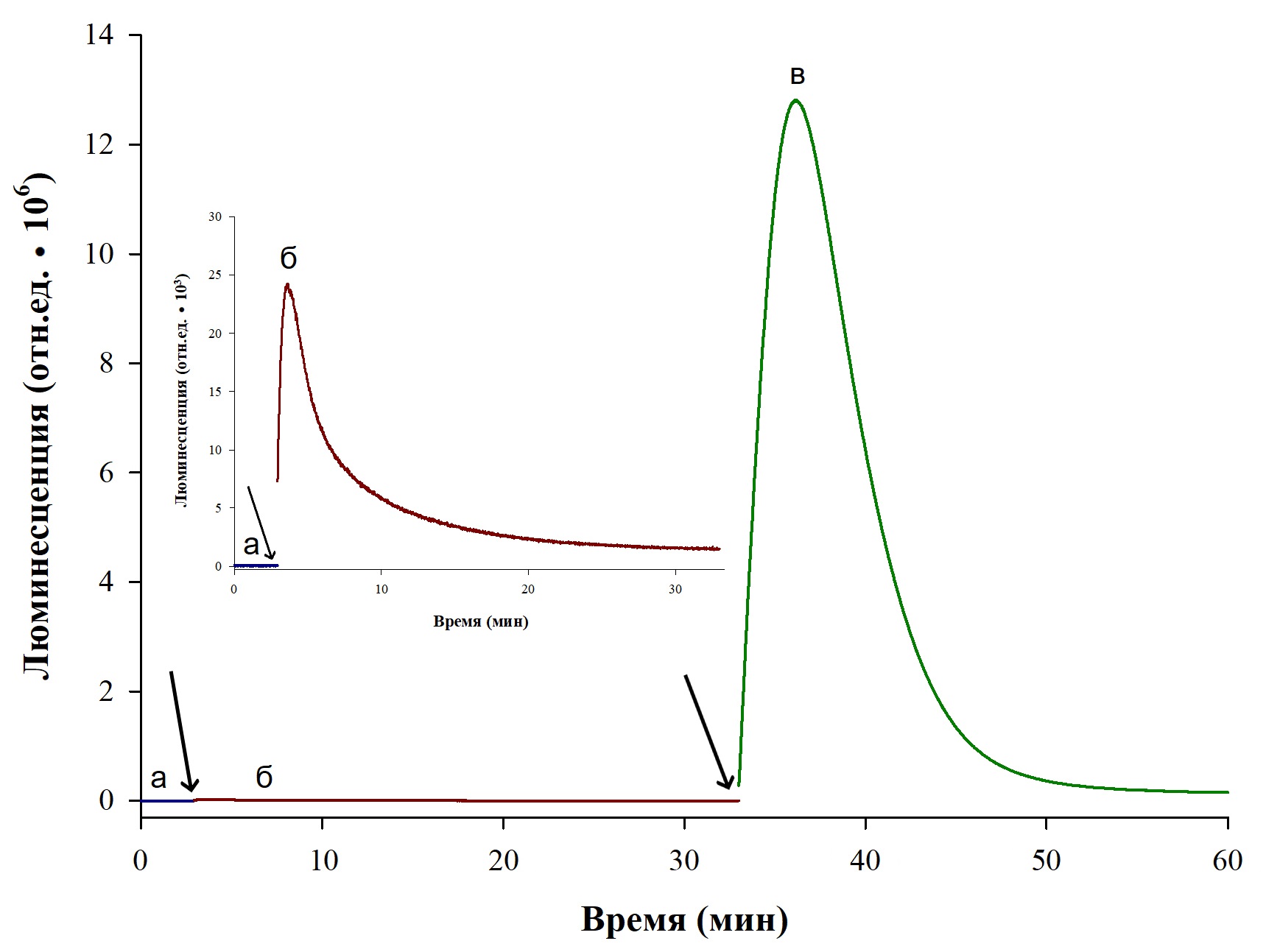
Рисунок 2 - Стимуляции свечения люминесцентной системы A. borealis добавками НАДФН и питательной среды при глубинном культивировании гриба I. obliquus
Примечание: а – исходный уровень свечения, б – уровень свечения после добавки 5 мкл раствора 10 мМ НАДФН, в – интенсивность и динамика светового сигнала после добавления 5 мкл образца питательной среды. Стрелками показаны моменты внесения ингредиентов. На вставке приведены увеличенные фрагменты а и б

Рисунок 3 - Уровень люминесценции, отражающий наличие и динамику накопления ГП в питательной среде при глубинном культивировании мицелия I. obliquus
Примечание: данные нормированы на максимальную интенсивность световой эмиссии в ряду измерений. На вставке увеличенный фрагмент уровней люминесценции образцов питательной среды на 7-9-е сутки культивирования гриба

Рисунок 4 - Внешний вид питательной PDB среды и пеллет мицелия I. obliquus на 15 сутки культивирования гриба в погруженных условиях
Примечание: регистрация изображения с помощью фотокамеры PowerShot S50 (Canon, Япония)
4. Заключение
Таким образом, совокупность полученных в работе данных позволяет высказать несколько общих выводов. Экспериментально показано, что культивирование высшего гриба I. obliquus в погруженных условиях сопровождается ростом шарообразных пеллет мицелия, которые продуцируют и секретируют в питательную среду ГП. При тестировании люминесцентным методом установлено, что максимальный уровень целевого продукта в среде наблюдается через две недели выращивания гриба и его концентрация в среде в это время может составлять 0,5-0,7 мг в 1 мл. Установлено, что при переносе выросших пеллет мицелия в свежий объем питательной среды и продолжении культивирования в ней вновь регистрируется накопление ГП. Высказано предположение, что выявляемое при люминесцентном тестировании снижение уровня ГП в питательной среде на длительных (более 2-х недель) сроках культивирования не связано с нарушениями продукции ГП в грибе и его секреции в среду. В целом, результаты проведенных исследований свидетельствуют в пользу применимости базидиомицета I. obliquus в биотехнологическом получении биоактивного вещества ГП для биомедицинских приложений.
