ИЗВЛЕЧЕНИЕ МЕДИ ИЗ ОТХОДОВ ТИТАНОВОГО ПРОИЗВОДСТВА
Козлов С.Г.1, Тихонов В.А.2, Куликов М.А.3
1 кандидат технических наук, 2 старший преподаватель, 3 ORCID: 0000-0001-8944-9522, кандидат химических наук, Березниковский филиал Пермского национального исследовательского политехнического университета
ИЗВЛЕЧЕНИЕ МЕДИ ИЗ ОТХОДОВ ТИТАНОВОГО ПРОИЗВОДСТВА
Аннотация
Рассмотрен вопрос электрохимического извлечения меди из отходов, образовавшихся в результате очистки тетрахлорида титана. Представлена зависимость скорости растворения медного кека в соляной кислоте от размеров частиц. Исследован процесс электролиза полученного раствора двухвалентного хлорида меди. Проведена статистическая обработка результатов эксперимента.
Ключевые слова: производство титана, медьсодержащие отходы, электролиз
Kozlov S.G.1, Tikhonov V.A.2, Kulikov M.A.3
1 PhD in Engineering, 2 Senior Lecturer, 3 ORCID: 0000-0001-8944-9522, PhD in Chemistry, State National Research Politechnical University of Perm, Berezniki Branch
COPPER RECOVERY FROM WASTE TITANIUM PRODUCTION
Abstract
The question of the electrowinning of copper from waste generated during the treatment of titanium tetrachloride. The dependence of the copper dissolution rate in hydrochloric acid cake on the particle size. Studied the process of electrolysis of the resulting solution of divalent copper chloride. Statistical analysis of experimental results.
Keywords: production of titanium, copper-containing waste, electrolysis
Титан в современном мире играет важную роль, выступая в качестве ценного конструкционного материала, легирующей добавки, широко используется и в других областях техники [1–5]. Технология производства титана очень сложна и энергозатратна, что в значительной степени сказывается на стоимости металла. Ведь именно стоимость является тем фактором, который сдерживает применение титана в народном хозяйстве. Также не следует пренебрегать и экологическими проблемами. В процессе получения титана образуются различные виды отходов, которые требуют утилизации. При этом возможно выделение ценных компонентов и возврат их в производственный цикл, либо выпуск как самостоятельных продуктов. Одним из таких отходов является медный кек, образующийся на стадии очистки тетрахлорида титана [6].
Технология очистки тетрахлорида титана от соединений ванадия при помощи медного порошка получила наибольшее распространение благодаря своей универсальности. Основной ее недостаток – высокая стоимость, обусловленная использованием дорогого и дефицитного материала. Поэтому поиск путей выделения меди из образующихся отходов является весьма актуальным направлением совершенствования титанового производства.
Основные задачи данной работы сводятся к исследованию процессов растворения медного кека в соляной кислоте и электролиза полученного раствора двухвалентного хлорида меди. Для выбора условий электролиза проведен анализ литературных источников.
В работе [7] рассматривается способ выделения меди из сернокислотных растворов. Электролиз предложено проводить при катодной плотности тока 86-258 А/м2 и температуре 50-65°С. Для улучшения качества катодного осадка содержание меди в растворе не должно превышать 40 г/дм3. Другие авторы [8] предлагают проводить электролиз в аммиачной среде на виброэлектродах, поддерживая плотность тока 0,2-0,5 А/см2.
Авторами [9] проведены исследования электрохимической переработки солевого плава после очистки тетрахлорида титана. Плав растворяют в соляной кислоте, в результате чего хлорид меди (I) переходит в раствор в виде комплексных ионов [CuCl2]–. При этом указывается на частичное окисление одновалентного хлорида меди в двухвалентный. К сожалению, авторы не приводят данные по скорости растворения, что не позволяет достоверно судить о том, ионы меди какой валентности присутствуют в растворе.
Таким образом, представляет несомненный интерес исследование процесса растворения медного кека после очистки тетрахлорида титана с последующим электрохимическим выделением металлической меди.
В качестве объекта исследования использован медный кек – отход очистки тетрахлорида титана, следующего состава: Cu – 40,0 %, Ti – 4,7 %, Al – 1,5 %, V – 1,25 %, Fe – 0,16 %, Cl – 40,5 %, остальное – примеси.
Растворение медьсодержащих отходов осуществляли в 17,5 % соляной кислоте марки «х.ч.» при температуре 25°С, использовано механическое перемешивание со скоростью вращения мешалки 200 мин–1. Время растворения 3 часа, соотношение жидкой и твердой фаз 2:3. Для отделения нерастворившегося остатка применялась вакуум-фильтровальная установка. Анализ полученных растворов на содержание меди проводили йодометрическим и комплексонометрическим титрованием.
Далее растворы подвергались электролизу в стеклянном электролизере с графитовыми электродами при плотности тока 4300 А/м2. Время электролиза 1 час, температура в ванне от 40 до 60°С. Объем электролизной ванны 250 см3, объем раствора для проведения электролиза составил 150 см3 при содержании меди 82 г/дм3. Среднее напряжение на электродах от 4,62 до 8,14 В. Сила тока поддерживалась постоянной 2,66 А.
В качестве дополнительного оборудования использованы аналитические весы фирмы AND, сушильный шкаф марки SNOL.
Математическая обработка результатов проведена с помощью программного продукта Microsoft® Excel®.
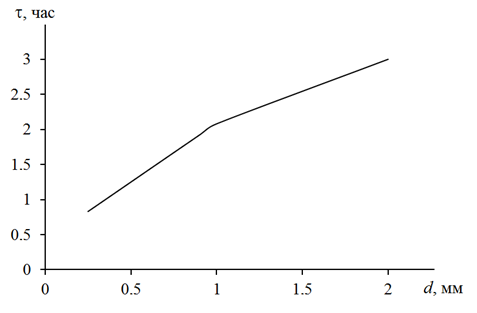
На первом этапе исследования оценено влияние гранулометрического состава медного кека на время растворения. Результаты представлены на рисунке 1, который показывает, что продолжительность растворения напрямую зависит от размеров частиц твердой фазы при прочих равных условиях.
Рис. 1 – Зависимость времени растворения (t) от размера частиц (d) твердой фазы медного кека
На практике растворение проводили в течение трех часов. Это объясняется, во-первых, смешанным гранулометрическим составом отхода, а во-вторых, этого времени достаточно для полного окисления CuCl в CuCl2 кислородом воздуха, что подтверждено данными химического анализа. Среднее расхождение между результатами йодометрического и комплексонометрического титрования составило 5,8 %.
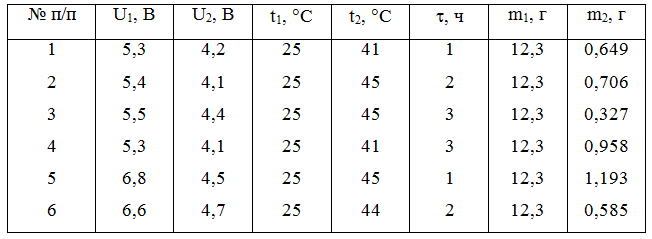
На втором этапе полученный после растворения и отделения нерастворившегося остатка раствор двухвалентного хлорида меди подвергли электролизу. В этой серии опытов варьировались такие параметры, как начальное (U1) и конечное (U2) напряжение на электродах, конечная температура раствора (t2) и длительность электролиза, результаты представлены в таблице 1 и на рисунке 2.
Данные таблицы 1 показывают, что наибольшее количество меди (m2 = 1,193 г) осаждается при начальном напряжении 6,8 В и продолжительности электролиза 1 час, выход по току при этом составляет 9,7 %.
Таблица 1 – Результаты эксперимента
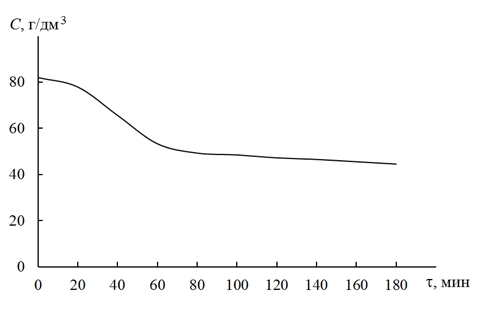
Рис. 2 – Зависимость остаточной концентрации меди в растворе от продолжительности электролиза
По нашему мнению, при этих параметрах создаются оптимальные условия для разрядки ионов двухвалентной меди из раствора, полученного растворением медного кека в соляной кислоте. Низкие значения выхода по току могут быть объяснены изменением ионного состава раствора, которое происходит в процессе электролиза.
Из рисунка 2 следует, что остаточная концентрация меди в электролизуемом растворе снижается в течение первого часа электролиза и далее изменяется незначительно. Также увеличение длительности электрохимического процесса нецелесообразно и по экономическим показателям, поскольку возрастает потребление электроэнергии. Поэтому в дальнейших исследованиях время электролиза ограничили одним часом.
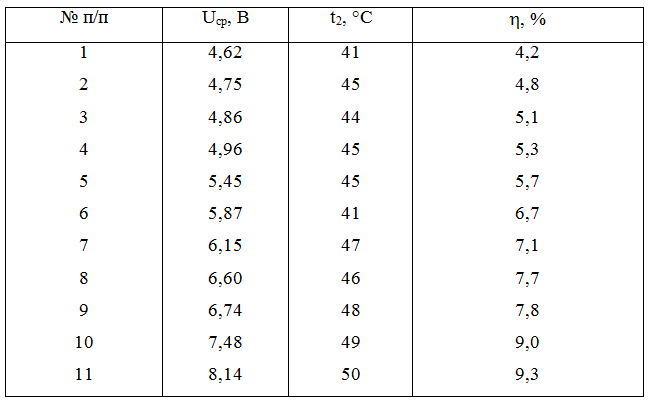
Третий этап работы включает в себя математическую обработку полученных результатов. Создание математических моделей процессов и явлений позволяет оценить значимость исследуемых параметров и определить оптимальные условия ведения процесса [10]. Для составления статистической модели использованы усредненные результаты экспериментов, представленные в таблице 2, и проведены корреляционный и регрессионный анализы.
Таблица 2 – Исходные данные для составления статистической модели
По результатам корреляционного анализа сделан вывод о явно выраженной положительной связи между выходом по току и конечной температурой электролита (коэффициент корреляции 0,98), а также между выходом по току и напряжением (коэффициент корреляции 0,76).
По результатам обработки экспериментальных данных (таблица 2) выполнен регрессионный анализ процесса электролиза хлорида меди. Задача регрессионного анализа в данном случае заключалась в получении математической модели процесса, проверке ее адекватности и значимости коэффициентов регрессии. Построены две модели – линейная и нелинейная.
Предварительный регрессионный анализ показал, что самым незначимым фактором в линейной модели является температура электролита. Исключение этого фактора и повторный регрессионный анализ подтвердили адекватность линейной модели. Значимость F-критерия при доверительной вероятности 0,95 составляет 5,9×10–9 и не превышает заданного порогового значения 0,05. Для линейной модели уравнение регрессии имеет вид (1):
η = –2,053 + 1,451Uср. (1)
Аналогичный анализ был проведен и для нелинейной модели, показавший, что в качестве самого незначимого фактора в данной модели выступает квадрат напряжения. Исключив незначимый фактор и проведя повторный анализ, получили, что условие адекватности выполняется: значимость F-критерия (9,4×10–8) меньше граничного условия (0,05). Для нелинейной модели уравнение регрессии имеет вид (2):
η = –5,017 + 2,1151Uср – 0,00064(t2)2. (2)
Таким образом, обе модели являются адекватными.
Таким образом, проведенные исследования показали потенциальную возможность выделения меди из отходов титанового производства и перспективность его использования. Дальнейшие исследования в этом направлении позволят, в конечном итоге, повысить эффективность производства. Кроме этого, подобрав оптимальные условия растворения медного кека и переработки полученного раствора, можно выделить и другие ценные компоненты, содержащиеся в отходах.
Литература
- Парфенов О.Г., Пашков Г.Л. Проблемы современной металлургии титана. Новосибирск: СО РАН, 2008.
- Сметкин А.А. Тенденции развития процессов получения титановых материалов методом порошковой металлургии // Вестник ПНИПУ. Машиностроение, материаловедение. 2013. Т. 15, № 3. С. 26.
- K. Kothari, R. Radhakrishnan, N.M. Werelеy Advances in gamma titanium aluminides and their manufacturing tеchniques // Progress in Aerospace Sciences. 2012. V. 55. P. 1.
- Park M., Ha H., Kim W., Park J., Suh C., Woo S. Activation and gas sorption properties of nano-size titanium powder getters // Solid State Phenomena. 2007. V. 124-126 (2). P. 1281.
- Fernandes B.B., De Moura Neto C., Ramos A.S., De Melo F.C.L., Henriques V.A.R. Study of Ti-7.5Si-22.5B alloys produced by powder metallurgy // Materials Research. 2014. V. 17 (3). P. 557.
- Байбеков М.К., Попов В.Д., Чепрасов И.М. Производство четыреххлористого титана. М.: Металлургия, 1987.
- Ануфриева Г.И., Грацерштейн Л.И., Левин А.М., Ануфриева С.И., Шуленина З.М., Лосев Ю.Н. Электрохимическое выделение меди из сернокислых водных растворов. Пат.2033481 РФ. 1995.
- Рыбалко Е. А., Липкин М.С., Науменко А.А., Дорофеев Ю.Г., Липкин В.М. Способ получения медных порошков из медьсодержащих аммиакатных отходов. Пат. 2469111 РФ. 2012.
- Иваднев В.С., Бабин А.В., Лебедев В.А. Электрохимическая переработка солевого плава, полученного при очистке тетрахлорида титана // Материалы III Международной научно-практической конференции «Металлургия легких и тугоплавких металлов». Екатеринбург, 2014. С. 166.
- Зиятдинов Н.Н. Компьютерное моделирование и оптимизация в химической технологии // Теорет. основы хим. технологии. 2014. Т. 48. № 5. С. 483.
References
- Parfenov O.G., Pashkov G.L. Problemy sovremennoj metallurgii titana. Novosibirsk: SO RAN, 2008.
- Smetkin A.A. Tendencii razvitija processov poluchenija titanovyh materialov metodom poroshkovoj metallurgii // Vestnik PNIPU. Mashinostroenie, materialovedenie. 2013. T. 15, № 3. S. 26.
- K. Kothari, R. Radhakrishnan, N.M. Wereley Advances in gamma titanium aluminides and their manufacturing techniques // Progress in Aerospace Sciences. 2012. V. 55. P. 1.
- Park M., Ha H., Kim W., Park J., Suh C., Woo S. Activation and gas sorption properties of nano-size titanium powder getters // Solid State Phenomena. 2007. V. 124-126 (2). P. 1281.
- Fernandes B.B., De Moura Neto C., Ramos A.S., De Melo F.C.L., Henriques V.A.R. Study of Ti-7.5Si-22.5B alloys produced by powder metallurgy // Materials Research. 2014. V. 17 (3). P. 557.
- Bajbekov M.K., Popov V.D., Cheprasov I.M. Proizvodstvo chetyrehhloristogo titana. M.: Metallurgija, 1987.
- Anufrieva G.I., Gracershtejn L.I., Levin A.M., Anufrieva S.I., Shulenina Z.M., Losev Ju.N. Jelektrohimicheskoe vydelenie medi iz sernokislyh vodnyh rastvorov. Pat.2033481 RF. 1995.
- Rybalko E. A., Lipkin M.S., Naumenko A.A., Dorofeev Ju.G., Lipkin V.M. Sposob poluchenija mednyh poroshkov iz med'soderzhashhih ammiakatnyh othodov. Pat. 2469111 RF. 2012.
- Ivadnev V.S., Babin A.V., Lebedev V.A. Jelektrohimicheskaja pererabotka solevogo plava, poluchennogo pri ochistke tetrahlorida titana // Materialy III Mezhdunarodnoj nauchno-prakticheskoj konferencii «Metallurgija legkih i tugoplavkih metallov». Ekaterinburg, 2014. S. 166.
- Zijatdinov N.N. Komp'juternoe modelirovanie i optimizacija v himicheskoj tehnologii // Teoret. osnovy him. tehnologii. 2014. T. 48. № 5. S. 483.