ЯДЕРНЫЙ ЭФФЕКТ ОВЕРХАУЗЕРА В МОЛЕКУЛЕ АПИГЕНИНА
Зелеев М.Х.1, Cпирихин Л.В.2, Байрамгулов Р.А.3, Мусина Г.И.4, Шайхутдинова И.А.5, Насибуллин Р.С.6
1ORCID: 0000-0002-8049-4881, кандидат физ.-мат. наук, доцент,
2ORCID: 0000-0001-9636-624X, кандидат хим. наук,
3ORCID: 0000-0002-0644-6113, аспирант,
4ORCID: 0000-0003-0128-4669, аспирант, 5ORCID: 0000-0001-9522-5947, аспирант,
6ORCID: 0000-0001-6653-0301, доктор физ.-мат. наук, профессор,
Башкирский Государственный Медицинский Университет
ЯДЕРНЫЙ ЭФФЕКТ ОВЕРХАУЗЕРА В МОЛЕКУЛЕ АПИГЕНИНА
Аннотация
В рамках программы исследования молекулярного механизма биологической активности молекул проведено изучение действия апигенина на структурообразующую молекулу клеточной мембраны - фосфатидилхолин. Методами квантовой химии и спектроскопии ЯМР 1Н и 13С определено электронное строение апигенина. Используя ядерный эффект Оверхаузера, измерены структурные параметры молекулы апигенина в водном растворе. Полученные экспериментальные значения структурных параметров апигенина сопоставлены с результатами квантово - химических расчетов, проведенных с использованием программы HyperChem Release 8.0.8 методом DFT c базисом Medium [6-31G] . Показана высокая точность метода DFT, открывающая возможность определения электронного строения и структурных параметров молекул данной группы методом DFT без применения дорогих экспериментальных методов.
Ключевые слова: комплекс, лецитин, апигенин, ЯМР спектроскопия.
Zeleev M.Kh.1, Spirikhin L.V.2, Bayramgulov R.A.3, Musina G.I.4, Shaykhutdinova I.A. 5, Nasibullin R.S.6
1ORCID: 0000-0002-8049-4881, PhD in Physics and Mathematics, Associate professor,
2ORCID: 0000-0001-9636-624X, PhD in Chemistry, 3ORCID: 0000-0002-0644-6113, postgraduate student,
4ORCID: 0000-0003-0128-4669, postgraduate student, 5ORCID: 0000-0001-9522-5947, postgraduate student,
6ORCID: 0000-0001-6653-0301, PhD in Physics and Mathematics, Professor,
BSMU
NUCLEAR OVERHAUSER EFFECT IN APIGENIN MOLECULE
Abstract
Under the program for studying of a molecular mechanism of a biological activity of molecules, the effect of apigenin on the structure-forming molecule of the cell membrane, phosphatidylcholine, was studied. The electronic structure of apigenin is determined by the methods of quantum chemistry and spectroscopy of NMR 1H and 13C. Using the nuclear Overhauser effect, the structural parameters of the apigenin molecule in an aqueous solution are measured. The obtained experimental values of the apigenin structural parameters are compared with the results of quantum chemical calculations performed with the use of HyperChem Release 8.0.8 program using the DFT method with the Medium basis [6-31G]. The high accuracy of the DFT method is revealed, it opens the possibility of determining the electronic structure and structural parameters of molecules of this group by the DFT method without using expensive experimental methods.
Keywords: complex, lecithin, apigenin, NMR spectroscopy.
Достижения квантовой физики показали, что биологические функции молекул, составляющих биологическую систему, природой закодированы в их электронном строении. Изменения в электронном строении молекул приводят иногда через большое количество промежуточных преобразований к изменению феноменологических характеристик организма, таких как давление в кровеносной системе, температура и некоторые другие характеристики [1, С. 245-273], [2, C. 331]. Отсутствие принципиальной границы между биологическими и небиологическими системами для фундаментальных физических принципов стало ясно после создания квантовой физики. Однако для экспериментальных проверок в естественных условиях результатов теоретических исследований не было методов и техники. Открытие явления ядерного магнитного резонанса впервые открыла возможность изучения электронного строения биологических молекул в естественных условиях обитания и их изменения под действием биологических активных молекул и других физических факторов [3, C. 933], [4, C. 594-598]. Появилась возможность поэтапного определения изменения структуры и как следствие функций, приводящих к изменению феноменологических показателей организма таких как температура, давление и ряда других характеристик.
Биологическая активность молекул в биологических системах проявляется, как правило, в водных растворах. Ядерный эффект Оверхаузера (ЯЭО), основанный на прямом взаимодействии магнитных моментов ядер элементов, составляющих молекулу является единственным методом, дающим возможность определить структурные параметры молекул в растворах. ЯЭО исключает влияние на спектр молекул скалярного спин-спинового взаимодействия и некоторых других факторов. Прямое магнитное взаимодействие ядер зависит от расстояния между ядрами и дает возможность определения значения этого расстояния [5, C. 76-80], [6, C. 230].
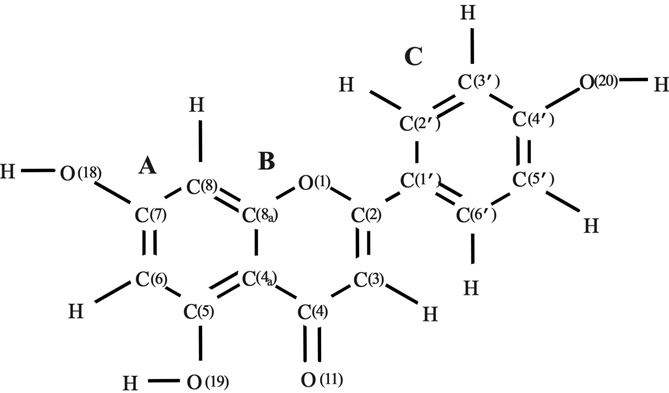
Настоящее сообщение посвящено исследованию методами ядерного эффекта Оверхаузера и квантовой химии некоторых структурных параметров молекулы апигенина [рис 1].
Рис. 1 – Молекула апигенина
Интерес к апигенину, принадлежащему к группе полифенольных, соединений растительного происхождения, обусловленных широким спектром его биологической активности,в частности, его антиканцерогенным действием. [7, C. 820-824], [8, C. 3], [9, C. 71-74]
Изучение молекулярного механизма активности апигенина усложняется малой растворимостью этого соединения в воде, а биологическая активность в биосистемах, как правило, проявляется в водных растворах [10, C. 91-93].
Материалы и методы
Квантово – химические расчеты проведены с использованием программы HyperChem Release 8.0.8 методом DFT c базисом Medium [6-31G]. Растворители были с индексом ЧДА. Для экспериментов был использован апигенин производства фирмы “Oldrich”, чистота которого проверялась по спектрам ЯМР. Растворы апигенина от парамагнитных примесей кислорода очищались откачкой при азотной температуре. Спектры ЯМР 1H и 13C регистрированы на импульсном спектрометре Avance III с рабочей частотой 500.13 МГц (1H) и 125.47 МГц (13С) с использованием 5 мм датчика с Z- градиентом РАВВО при постоянной температуре образца 298К. Химические сдвиги в спектрах ЯМР 13С, 1Н, приведены в м.д. относительно сигнала внутреннего стандарта тетраметилсилана (ТМС). Задержка между импульсными последовательностями устанавливалась для достижения полной релаксации. С целью увеличения цифрового разрешения применялось дополнение нулями и умножение Фурье-образа спектра на экспоненциальную функцию (1b=0.1 Гц для 1H и 1 Гц для 13С).
Спектры ЯМР 13С с подавлением по протонам (WALTZ-16) были зарегистрированы при следующих условиях: спектральное окно – 29.8 кГц, количество точек-64К, длительность возбуждающего импульса (30°) – 3.2 мкс, релаксационная задержка – 2 с, количество прохождений – 256. Редактирование спектров ЯМР проводилось на основании экспериментов DEPT – 90 и DEPT – 135 [1, C. 245-273]. Длительность импульса регенерирующего поперечную намагниченность выбиралась 6 мкс (DEPT-90) и 9мск (DEPT – 135), рефокусирующая задержка 1/2J=3.5 мс, 64К точки накоплены в течение 64 прохождений, спектральное окно – 29.8 кГц, экспоненциальное уширение линий – 1 Гц. Двумерные спектры зарегистрированы в стандартных режимах многоимпульсных последовательностей программного обеспечения прибора. Спектр gsCOSY зарегистрирован со следующими параметрами: размер матрицы 4К на 512 эксп. при спектральном окне 5.0 кГц, при обработке использовалась синусоидальная – колоколообразная взвешивающая функция для F1 и F2 проекций (ssb = 2). gsHSQC спектр (hsqcetgp, размер матрицы 2K на 256 эксп., 5.0 кГц для F2 – проекции и 27.7 кГц – для F1) зарегистрирован с задержкой d4 оптимизированной под наблюдение JCH=145 Гц.
Складывающая в настоящее время досимптомная медицина получила возможность исследования организма до появления симптомов, характеризующих состояние системы, при появлении изменений в электронном строении молекул и создать методы коррекции таких изменений.
Двумерные спектры 1Н и 13С дали возможность надежной идентификации почти сливающихся спектральных линий раствора апигенина (рис.2) со структурообразующей молекулой клеточной мембраны – фосфатидилхолином. Слабые кросс пики обусловленные взаимодействием ядер водорода метильных групп холиновой головки фосфатидилхолина, свидетельствует о формировании комплекса апигенин-лецитин.
Одновременно кросс-пики, обусловленные взаимодействием атомов водорода метильных групп холиновой головкой лецитина, показывают возникновение комплексов апигенина с сопряженными кольцами апигенина.
Экспериментальные результаты (рис.3) на спектре четко показывают хорошо измеряемое изменение спектральных линий от ядер водорода из разных сопряженных колец апигенина обусловленные ЯЭО (рис.3). Под спектральными линиями расположены цифры, показывающие изменение интенсивности этих линий.
Таблица 1 – Значения расстояний между атомами апигенина в А0
| Расстояние | Н5 – Н6' | Н5 – Н5' | Н8 – Н3' | Н8 – Н2' |
| Экспериментальное значение | 2,43603 | 5,32598 | 6,75227 | 4,02698 |
| DFT large [316**] | 2,43598 | 5,32599 | 6,75229 | 4,02597 |
Эти данные практически совпадают с результатами квантово-химических расчетов, проведенных методом DFT. Отсутствие допускающего точное измерение ЯЭО, при разумных временах накопления сигнала, влияния, насыщения линии метильных групп холиновой группы на спектры апигенина можно объяснить зависимостью, описывающей эту связь в шестой степени расстояния, разделяющего взаимодействующие магнитные моменты [11, C. 142-145]:
![]() (1),
(1),
где η - ЯЭО, r - расстояние между ядрами.
Структурные параметры, помещенные в таблицу, являются результатами определенными из экспериментов по ЯЭО в соответствии с выражением (1), предложенным в работе [11, C. 142-145]. Расчеты проводились предположении, что длина связи С-Н при sp3 гибридизации углерода равна 1,1 А0. Там же приведены соответствующие структурные данные, полученные методом DFT large. Сопоставление структурных параметров показывает, что вращательные движения кольца С заторможено. Как видно из данных таблицы, экспериментальные и полученные значения из квантово-химических расчетов совпадают до пятого знака после запятой. Хорошее совпадение вычисленных и экспериментальных структурных параметров молекулы апигенина дает возможность использовать расчетные методы для исследования других молекул этой многочисленной группы без трудоемких экспериментов.
Список литературы / References
- R. Protective and adverse biological actions of phenolic antioxidants. / R. Kahl., H. Sies. // Oxidative Stress: Oxidants and antioxidants. – London. – 1991. – P. 245-273.
- Van Acker S. A. Structural aspects of antioxidants activity of flavonoids / van Acker SA1, van den Berg DJ, Tromp MN, Griffioen DH, van Bennekom WP, van der Vijgh WJ, Bast A. // Free Radic Biol Med. – 1996. – Vol. 20(3). – P. 331. PMID: 8720903
- Rice-Evans C.A. Structure – antioxidant activity relationships of flavonoids and phenolic acids. / C.A.Rice-Evans, N.J. Miller and G.Paganga. // Free Radic Biol Med. – 1996. – Vol. 20(3). – P. 933. PMID: 8743980
- Насибуллин Р.С. Образование комплексов молекулы пиразола с фосфолипидами. / Р.С. Насибуллин, Л.В. Спирихин, В.А. Пономарева. // Биофизика. – 1991. – Том 36. – №.4. – С. 594-598.
- Насибуллин Р. С. Структура комплексов фосфатидилхолин– пиридин и фосфатидилхолин–пиразол: результаты конформационного анализа. / Р. С. Насибуллин, M.A. Серебреник. // Biopolymers and cell. – Vol.18. – No.1. – P. 76-80. http://dx.doi.org/10.7124/bc.0005EB
- Allen M.P. Computer simulation of liquids. / M.P. Allen, D.J. Tidesley. // Oxford: Clarendon Press. – 1987. – P. 230.
- Nasibullin R.S. Pyridine – phosphatidylcholine complex. / R.S. Nasibullin, D.I. Kosarreva, L.V. Spirichin. // Biophysics. – 2002. –Vol.47. – No.5. – P. 820–824. https://elibrary.ru/item.asp?id=14967353
- Насибуллин Р.С. Комплексобразование 7,3I,4I-триоксифлавонола с клеточным фосфатидидхолином. / Р.С. Насибуллин, Е.Р. Фахретдинова, В.М. Нусратуллин, Р.И. Галеева. // Biopolymers and Cell. – 2010. – Vol.26. – №5. http://dx.doi.org/10.7124/bc.00016D
- Насибуллин Р.С. О молекулярном механизме биологической активности апигенина. / Р.С. Насибуллин, Л.В. Спирихин, Р.И. Галеева, Д.И. Фахретдинова. // Бутлеровские сообщения. – 2015. – Т.43. – №8. – С. 71–74. ROI: jbc-01/15-43-8-71
- Насибуллин Р.С. Комплекс фосфатидилхолина 7,3I,4I-триоксифлавоном (физетин). / Р.С. Насибуллин, М.С. Сетченков, Р.И. Галеева, И.Р. Хайбуллина. // Международный научно-исследовательский журнал. – 2016г. – №1(43). – С. 91–93. DOI: https://doi.org/10.18454/IRJ.2016.43.032
- Noggle J.H. The Nuclear Overhauser Effect – Chemical Application / J.H. Noggle, R.E. Schirmer. // Academic Press. – 1972.
Cписок литературы на английском языке / References in English
- R. Protective and adverse biological effects of phenolic antioxidants, in Oxidative Stress: Oxidants and antioxidants. / R. Kahl., H. Sies. - London. - 1991. - P. 245-273.
- Van Acker S. A. Structural aspects of antioxidant activity of flavonoids / van Acker SA1, van den Berg DJ, Tromp MN, Griffioen DH, van Bennekom WP, van der Vijgh WJ, Bast A. // Free Radic Biol Med. - 1996. - Vol. 20 (3). - P. 331. PMID: 8720903
- Rice-Evans C.A. Structure - antioxidant activity relationships of flavonoids and phenolic acids. / C.A. Rice-Evans, N.J. Miller and G.Paganga. // Free Radic Biol Med. - 1996. - Vol. 20 (3). - P. 933. PMID: 8743980
- Nasibullin R.S. Obrazovaniye kompleksov molekuly pirazola s fosfolipidami [Formation of Complexes of Pyrazole Molecule with Phospholipids] / R.S. Nasibullin, L.V. Spirikhin, V.A. Ponomareva. // Biophysics. - 1991. - Vol. 36. - No. 4. - P. 594-598. [In Russian]
- Nasibullin R.S. Struktura kompleksov fosfatidilkholin– piridin i fosfatidilkholin–pirazol: rezul'taty konformatsionnogo analiza [Structure of Phosphatidylcholine-pyridine and Phosphatidylcholine-pyrazole Complexes: Results of Conformational Analysis. / R.S. Nasibullin, M.A. Serebrenik. // Biopolymers and cell. 2002. - Vol.18. - No.1. P. 76-80. http://dx.doi.org/10.7124/bc.0005EB [In Russian]
- Allen M.P. Computer simulation of liquids. / M.P. Allen, D.J. Tidesley. // Oxford: Clarendon Press. - 1987. - P. 230.
- Nasibullin R.S. Pyridine - phosphatidylcholine complex. / R.S. Nasibullin, D.I. Kosarreva, L.V. Spirichin. // Biophysics. - 2002. -Vol.47. - No.5. P. 820-824. https://library.ru/item.asp?id=14967353
- Nasibullin R.S. Kompleksoobrazovaniye 7,3I,4I-trioksiflavonola s kletochnym fosfatidilkholinom. [Complex formation of 7,3I,4I-trioxyflavonol with Cellular Phosphatididoline] / R.S. Nasibullin, E.R. Fakhretdinova, V.M. Nusratullin, R.I. Galeev. // Biopolymers and Cell. - 2010. - Vol.26. - No.5. http://dx.doi.org/10.7124/bc.00016D [In Russian]
- Nasibullin R.S. O molekulyarnom mekhanizme biologicheskoy aktivnosti apigenina [On the molecular mechanism of the biological activity of apigenin] / R.S. Nasibullin, L.V. Spirikhin, R.I. Galeeva, D.I. Fahretdinov. // Butler messages. - 2015. - V.43. - No.8. - P. 71-74. ROI: jbc-01 / 15-43-8-71 [In Russian]
- Nasibullin R.S. Kompleks fosfatidilkholona 7,3I,4I-trioksiflavonom (fizerin) [Complex of Phosphatidylcholine 7,3I, 4I-trioxyflavonol (fizetin)] / R.S. Nasibullin, M.S. Setchenkov, R.I. Galeeva, I.R. Khaibullina. // International Scientific and Research Journal. - 2016g. - No.1 (43). - P. 91-93. DOI: https://doi.org/10.18454/IRJ.2016.43.032 [In Russian]
- Noggle J.H. The Nuclear Overhauser Effect – Chemical Application / J.H. Noggle, R.E. Schirmer. // Academic Press. – 1972.