КОМПЬЮТЕРНОЕ МОДЕЛИРОВАНИЕ МАЛЫХ МОЛЕКУЛ ОРГАНИЧЕСКИХ АЗИДОВ НА ПРИМЕРЕ HN3, CH3N3, NCN3, C2H5N3, NCCH2N3
Зеневич С. Г.
Студент, Кемеровский государственный университет
КОМПЬЮТЕРНОЕ МОДЕЛИРОВАНИЕ МАЛЫХ МОЛЕКУЛ ОРГАНИЧЕСКИХ АЗИДОВ НА ПРИМЕРЕ HN3, CH3N3, NCN3, C2H5N3, NCCH2N3
Аннотация
В работе приведены теоретические расчеты методом теории функционала плотности и анализ основных свойств малых молекул органических азидов HN3, CH3N3, NCN3, C2H5N3, NCCH2N3 (молекулярная структура, электронный, колебательный спектры, параметры химической связи, термодинамические функции, пространственное распределение электронной плотности). С помощью экспериментального подтверждения теоретических данных проверяется пригодность метода B3LYP/TZVP для предсказывания различных структур.
Ключевые слова: теория функционала плотности, органические азиды, эффективный заряд, структура и колебательный спектры.
Zenevich S.G.
Kemerovo State University, student
COMPUTER MODELLING OF SMALL MOLECULES OF ORGANIC AZIDES ON THE BASIS OF HN3, CH3N3, NCN3, C2H5N3, NCCH2N3
Abstract
The theoretical calculations, made by using density functional theory, and the analysis of fundamental properties of small molecules of organic azides HN3, CH3N3, NCN3, C2H5N3, NCCH2N3 (molecular structure, electron and vibrational spectra, elements of chemical bond, thermodynamic functions, space distribution of electron density) have been given in the article. The applicability of B3LYP/TZVP method for prognostication of various structures is proved by experimental confirmation of theoretical data.
Keywords: density functional theory, organic azides, effective charge, structure and vibrational spectra.
Органические азиды представляют собой богатые энергией молекулы, которые широко используются как взрывчатые вещества, компоненты ракетного топлива, в пиротехнике и биомедицине. Азидная группа (N3) является одной из самых энергетических функциональных групп; её введение в органическое соединение увеличивает содержание энергии приблизительно на 300 кДж/моль. При нагревании либо под действием ультрафиолета азиды разлагаются с отщеплением азота и образованием нитренов: R-N3 R-N: + N2 , которые являются высоко реакционно способными интермедиатами в различных реакциях внедрения. Экспериментальное исследование азидов затруднено в связи с их повышенной чувствительностью к внешним воздействиям. Поэтому прямые квантово-химические вычисления молекулярных физико-химических свойств являются весьма актуальными.
Большинство теоретических исследований было сосредоточено в основном на определении энергетических параметров органических азидов [1]. В настоящей работе методами теории функционала плотности с использованием гибридного функционала B3LYP в TZVP-базисе [2] программного пакета CRYSTAL09_2.0.1 [3] выполнены расчеты геометрии, электронного, колебательного спектров, параметров химической связи, термодинамических функций, пространственного распределения электронной плотности для малых молекул HN3 (азотисто-водородная кислота), CH3N3 (метил азид), NCN3 (би-азидоацетонитрил), C2H5N3 (этил азид), NCCH2N3 (азидоацетонитрил), необходимые для понимания их реакционной способности.
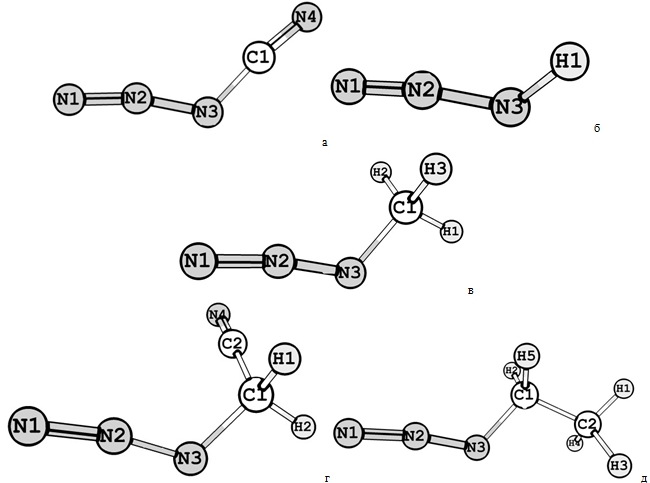
Рис. 1 - Пространственные структуры молекул а) HN3, б) NCN3, в) NCCH2N3, г) CH3N3, д) C2H5N3
Структуры молекул, рассчитанные при Т=298,15К и Р=1.01*105Па приведены на Рисунке 1. Оптимизированная геометрия данных соединений, сфокусированная на азидном фрагменте, приведена в Таблице 1. Некоторые из этих соединений исследовались как теоретически [4-7], так и экспериментально [8-10]. В данной работе достигнуто оптимальное согласование собственных расчетных данных с экспериментальными и расчётными данными других исследователей. Что указывает на то, что модель B3LYP/TZVP, использованная в данной работе, способна безошибочно предсказывать структуры различных видов.
Таблица 1 - Структурные параметры азидных групп
| Азид Параметр | HN3 | Эксп. HN3,[8] | CH3N3 | Эксп. CH3N3,[9] | NCN3 | C2H5N3 | NCCH2N3 |
| Содер. N, % | 97.66 | 73.66 | 82.1 | 59.13 | 68.29 | ||
| R(N1-N2), Å | 1.14 | 1.13 | 1.15 | 1.13 | 1.14 | 1.15 | 1.15 |
| R(N2-N3), Å | 1.25 | 1.24 | 1.24 | 1.24 | 1.27 | 1.25 | 1.26 |
| R(N3-С), Å | 1.02(H) | 1.02 | 1.47 | 1.46 | 1.34 | 1.49 | 1.48 |
| ÐN1-N2-N3, 0 | 171.4 | 171.3 | 173.0 | 170.2 | 173.8 | 172.3 | |
| ÐN2-N3-C, 0 | 110.1(H) | 108.8 | 115.6 | 117 | 117.6 | 114.9 | 114.7 |
Из приведенных в Таблице 1 данных видно, что длина связи между N(1)-N(2) и N(2)-N(3) существенно различается в определенной структуре, но соответствующие азидные длины связи практически одинаковы во всех пяти соединениях. Так в молекуле азотисто-водородной кислоты HN3, которая является наиболее азотосодержащим соединением 97.66%, длина связи между N1-N2 составляет 1.14Å, между N2-N3 составляет 1.25Å, между N3-H – 1.02Å. Угол азидной группы ÐN1-N2-N3 равен 171.40, что указывает на её нелинейность, угол между ÐN2-N3-Н составляет 110.10. Максимальная погрешность, касающаяся структурных данных, составляет 1.7%.
На Рисунке 2 представлены энергетические диаграммы рассчитанных структур с приведёнными значениями энергетических зазоров, на которых изображено несколько нижних свободных и несколько верхних заселенных молекулярных орбиталей. Так на диаграмме, соответствующей молекуле HN3, видно, что последняя заселенная орбиталь – это 11(о) (Occupied – занятый), а первая свободная орбиталь – это 12(u) (Unoccupied – свободный), энергетический зазор Eg составляет 6.4эВ. Наибольший вклад в энергию связи последнего заселенного уровня привносят Py и Pz орбитали атома N3. Для других соединений наибольший вклад в энергию связи последнего заселенного уровня привносят Py орбитали атома N3, и лишь для NCCH2N3 это Px и Py орбитали атома N3. В Таблице 2 приведены энергетические характеристики и характеристики химической связи: эффективный заряд, перекрывание электронных оболочек, энтальпия образования и энергия нулевых колебаний. Молекулярная энтальпия определяется как , где Eel – полная энергия электронной подсистемы, Е0 – энергия нулевых колебаний, εi – энергия i-го атома. Она максимальна в HN3 с наибольшим содержанием азота 97.7% и минимальна в C2H5N3, где азота всего 59.1%. Эта величина характеризует энергетическую емкость материала. Для установления механизмов разложения азида необходимо знать характер химической связи. Её характеризует распределение деформационной плотности, полученной вычитанием из молекулярной суперпозиции плотностей невзаимодействующих атомов.
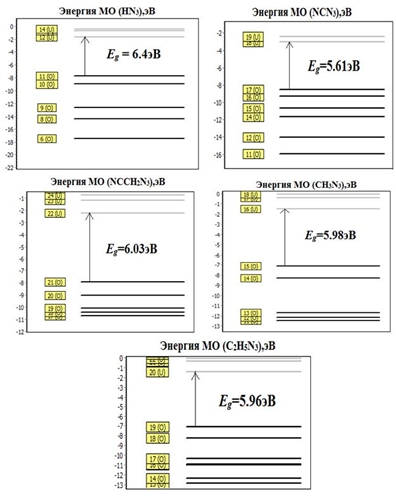
Рис. 2 - Энергетические диаграммы рассчитанных структур
Таблица 2 - Энергетические характеристики и характеристики химической связи рассчитанных структур
| Азид Параметр | HN3 | CH3N3 | NCN3 | C2H5N3 | NCCH2N3 |
| QN1, e | +0.247 | +0.259 | +0.405 | +0.258 | +0.319 |
| QN2, e | -0.268 | -0.339 | -0.329 | -0.326 | -0.334 |
| QN3, e | -0.164 | -0.232 | -0.318 | -0.261 | -0.241 |
| QC, e | +0.185(H) | +0.187 | +0.573 | +0.240 | +0.170 |
| P(N1-N2), e | 0.451 | 0.405 | 0.360 | 0.379 | 0.401 |
| P(N2-N3), e | 0.355 | 0.274 | 0.252 | 0.228 | 0.290 |
| P(N3-C), e | 0.380(H) | 0.320 | 0.473 | 0.300 | 0.299 |
| ΔHf, ккал/г | -2373 | -1796 | -2003 | -1447 | -1665 |
| E0, кДж/моль | 57.6 | 133.4 | 55.1 | 209.4 | 129.7 |
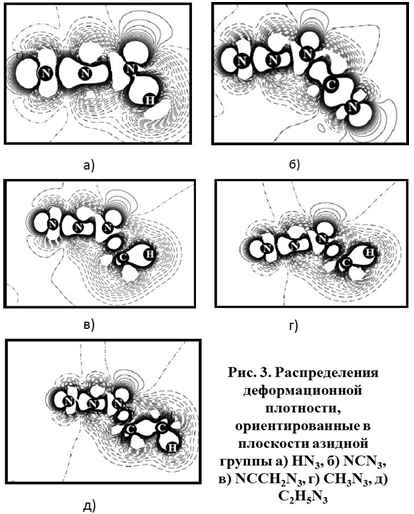
На Рисунке 3 представлены распределения деформационной плотности рассчитанных структур, главным образом сфокусированные на азидном фрагменте. Из Рисунка 3 видно, что все распределения практически идентичны, сплошными линиями обозначены её положительные значения, пунктирными – отрицательные, т.е. области, из которых электронный заряд при образовании молекулы вытекает. Эффективный заряд атомов QN2, QN3 отрицательный и в молекуле NСN3 составляет -0.329 и -0.318 в единицах заряда электрона e соответственно. Заселенность перекрывания на связи P(N3-C), составляющая 0.473 е, максимальна в этом соединении. Заметим, что заселенность Р(N2-N3) во всех азидах меньше остальных, и это объясняет механизм разложения с образованием N2.
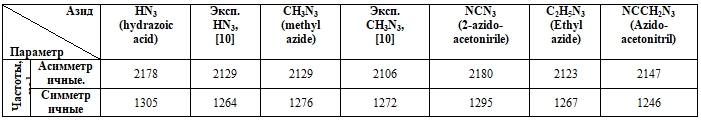
Таблица 3 - ИК-спектр азидных групп рассчитанных структур, см-1
В Таблице 3 приведены расчетные данные частот азидных групп. Настоящие данные находятся в оптимальном согласии с экспериментом [10] и с другими расчётными работами [6]. Так азидная группа в молекуле CH3N3 имеет ассиметричную моду 2129см-1 и симметричную моду 1276см-1. Максимальная погрешность, касающаяся ИК-спектра, составляет 3,2%. На Рисунке 4 приведен ИК-спектр всех пяти соединений. В ИК-спектрах всех азидов присутствуют характеристические полосы при 2180-2100 см-1 (асимметричные валентные колебания) и 1310-1240 см-1 (симметричные валентные колебания). Наибольший вклад в асимметричные колебания каждой молекулы привносят колебания среднего атома N2 азидной группы.
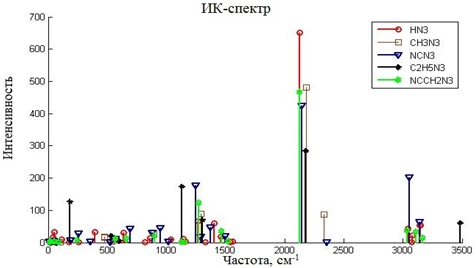
Рис. 4 - ИК-спектр рассчитанных структур
В настоящей работе методом функционала плотности рассчитаны основные характеристики малых молекул органических азидов HN3, CH3N3, NCN3, C2H5N3, NCCH2N3: структурные, энергетические, частотные и характеристики химической связи. Структура азидной группы нелинейна, с характерным углом порядка 1700. Частотный спектр всех соединений имеет характеристические пики интенсивности, создаваемые средним атомом азота N2 азидной группы. Приведенные данные находятся в хорошем согласии с экспериментом, максимальная погрешность метода составляет 3.2%. Проведенное исследование позволяет утверждать, что основополагающим фактором, определяющим реакционную способность малых молекул органических азидов, является сила химического связывания в азидной группе. С одной стороны, между крайним и центральным атомами азота N1-N2, с другой стороны, между углеродом (водородом) и ближайшим к нему атомом азота N3-C(Н).
Литература
- V.Dorofeeva, O. N. Ryzhova, M. A. Suntsova. Accurate Prediction of Enthalpies of Formation of Organic Azides by Combining G4 Theory Calculations with an Isodesmic Reaction Scheme // J. Phys. Chem. A. 2013, 117, 6835−6845.
- F. Peintinger, D.V. Oliveira, T.Bredow. Consistent Gaussian Basis Sets of Triple-Zeta Valence with Polarization Quality for Solid-State Calculations // J. Comput. Chem. 2013, 34(6), 451-459.
- Dovesi, V.R. Saunders, C. Roetti, R. Orlando,C. M. Zicovich-Wilson, F. Pascale, B. Civalleri, K. Doll, N.M. Harrison, I.J. Bush, Ph. D’Arco, M. Llunell CRYSTAL09 2.0.1. User’s Manual, 2013.
- Sklenak, S.; Gatial, A.; Biskupic, S. Ab initio study of small organic azides. J. Mol. Struct. (THEOCHEM) 1997, 397, 249-262.
- Badawi, H.M. Theoretical study of the structure and vibrational spectra of formyl and methyl azides. J. Mol. Struct. (THEOCHEM) 2002, 583, 89-97.
- Fu, A.; Du, D.; Zhou, Z. Density functional study on the vibrational frequencies of hydrazoic acid and methyl azide Chinese Chem. Letts. 1999, 10, 619-622.
- Chen, F. Wang. Electronic Structure of the Azide Group in 3′-Azido-3′- deoxythymidine (AZT) Compared to Small Azide Compounds // Molecules 2009, 14, 2656-2668.
- Sklenak, S.; Gatial, A.; Biskupic, S. Ab initio study of small organic azides. J. Mol. Struct. (THEOCHEM) 1997, 397, 249-262.
- Salathiel, W.M.; Curl, J.R.F. Microwave Spectrum of Methylazide. J. Chem. Phys. 1966, 44, 1288-1290.
- Nielsen, C.J.; Sjogfogren, C.E. The vibrational spectra, molecular structure and conformation of organic azides : Part IV. An ab initio study of hydrazoic acid, azidomethane, azidoethane, azidoethene and azidomethanal. J. Mol. Struct. (THEOCHEM) 1987, 150, 361-379.