СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ВЛИЯНИЯ МЕТОДА ПАРЕНТЕРАЛЬНОГО ПИТАНИЯ НА МЕТАБОЛИЗМ ПАЦИЕНТОВ С ОСТРЫМ ТЯЖЕЛЫМ ПАНКРЕАТИТОМ
СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ВЛИЯНИЯ МЕТОДА ПАРЕНТЕРАЛЬНОГО ПИТАНИЯ НА МЕТАБОЛИЗМ ПАЦИЕНТОВ С ОСТРЫМ ТЯЖЕЛЫМ ПАНКРЕАТИТОМ
Научная статья
Сорокина Е.Ю.1, *, Белых Л.С.2
1 ORCID: 0000-0002-7374-0507;
1 ГУ «Днепропетровская медицинская академия МЗ Украины», Днепр, Украина;
2 Днепропетровское клиническое объединение скорой медицинской помощи, Днепр, Украина
* Корреспондирующий автор (sorokinaeu[at]ukr.net)
АннотацияПроанализированы данные пациентов с тяжелым острым панкреатитом (ОП), которые были пролечены за период с 2014 по 2018 гг. Пациентам, у которых на вторые сутки проведения интенсивной терапии наблюдались явления кишечной недостаточности, что делало невозможным проведение раннего энтерального питания, нутритивная поддержка начиналась с проведения полного парентерального питания (ППП). В зависимости от вида смеси, которая использовалась в качестве нутритивной поддержки, больные были разделена на подгруппы: подгруппа 1 (n = 22) - больные, получившие трехкомпонентные смеси в специальных мешках для ППП. Подгруппа 2 (n = 20) - больные, которые для проведения ППП получили трехкомпонентные смеси с повышенным содержанием ѡ-3 жирных кислот. Подгруппа 3 (контрольная) - больные (n = 25), у которых проводилось ППП отдельными модулями из углеводов, аминокислот и липидов.
Проведение модульного ПП не обеспечивало билковосберегающий эффект на фоне гиперкатаболизма, обусловленном течением тяжкого ОП, сопровождалось увеличением количества осложнений течение ранней фазы заболевания (R = 0,797, р = 0,005) и увеличением длительности госпитализации (R = 0,643, р = 0,051).
Добавление ԝ-3 ЖК в состав смесей в трехкамерных мешках для проведения парентерального питания способствовало более быстрому восстановлению уровня общего белка, альбумина и глюкозы сыворотки крови на фоне течения тяжелого ОП (R = 0,783, р = 0,037).
Ключевые слова: острый панкреатит, нутритивная поддержка, парентеральное питание, ԝ-3 жирные кислоты.
COMPARATIVE ANALYSIS OF INFLUENCE OF PARENTERAL NUTRITION METHOD ON METABOLISM OF PATIENTS WITH ACUTE SEVERE PANCREATITIS
Research article
Sorokina E.Yu.1, *, Belykh L.S.2
1 ORCID: 0000-0002-7374-0507;
1 State Institution "Dnepropetrovsk Medical Academy of the Ministry of Health of Ukraine," Dnipro, Ukraine;
2 Dnipropetrovsk Clinical Association of Emergency Medical Service, Dnipro, Ukraine
* Corresponding author (sorokinaeu[at]ukr.net)
AbstractThe authors analyzed the data on patients with severe acute pancreatitis (AP) who were treated during the period from 2014 to 2018. Nutritional support was started with full parenteral nutrition (FPN) for patients who showed symptoms of intestinal insufficiency on the second day of intensive care, which made it impossible to conduct early enteral nutrition. Depending on the type of mixture that was used as nutritional support, patients were divided into subgroups: subgroup No.1 (n = 22) included patients who received three-component mixtures in special bags for FPN. Subgroup No.2 (n = 20) included patients who received triple-component mixtures with increased content of ѡ-3 fatty acids for FPN. Subgroup No.3 (control) included patients (n = 25) who got FPN with separate modules of carbohydrates, amino acids, and lipids.
Conducting modular PN did not provide a protein-saving effect against the background of hypercatabolism caused by severe AP, was accompanied by an increase in the number of complications during the early phase of the disease (R = 0.797, p = 0.005) and an increase in the length of hospitalization (R = 0.643, p = 0.051).
The addition of ԝ-3 FA to the composition of mixtures in three-chamber bags for parenteral nutrition contributed to a more rapid restoration of the level of total protein, albumin, and blood glucose in the presence of severe AP (R = 0.783, p = 0.037).
Keywords: acute pancreatitis, nutritional support, parenteral nutrition, ԝ-3 fatty acids.
ВведениеПо данным Рекомендаций по лечению тяжелого острого панкреатита (2019), у 20–30% пациентов развивается тяжелая форма острого панкреатита (ОП), при котором частота госпитальной смертности составляет около 15%, зачастую обусловлена дисфункцией одного или нескольких органов, требующей интенсивной терапии [7]. Развитие панкреонекроза связано с ухудшением функций органов, и он встречается примерно у 20–40% пациентов с тяжелым ОП.
Наиболее часто используемой системой классификации для ОП на сегодняшний день является пересмотренная классификация Атланты и определений на основе международного консенсуса 2012 года [5]. Согласно данной классификации выделяются: легкий ОП, который не имеет органной недостаточности, местных или системных осложнений и обычно проходит в течение первой недели. Умеренно тяжелый ОП, который характеризуется наличием преходящей органной недостаточности, локальных осложнений или обострения сопутствующей патологии. Тяжелый ОП – определяется наличием стойкой органной недостаточности (>48 часов).
Ранняя фаза ОП делиться на ІА (первая неделя заболевания) и ІВ (вторая неделя заболевания). С 14-х суток от начала заболевания в поджелудочной железе и в забрюшинной клетчатке начинают формироваться секвестры (фаза секвестрации).
Основные вопросы, которые рекомендовано ставить при проведении интенсивной терапии (ИТ), это [7]:
- Какие показания к госпитализации в ОАИТ?
- Когда показана жидкостная ресусцитация и какой раствор следует употреблять? Какова оптимальная скорость инфузии начальной реанимации? Который фармакологический подход предпочтителен к устойчивому шоку?
- Какой правильный подход к контролю боли?
- Какие показания к ИВЛ?
- Какой медицинский подход к синдрому брюшной гипертензии? Какова роль таких препаратов, как аналоги соматостатина?
- Энтеральное питание (ЭП): какие показания, какой тип питания следует употреблять и какой самый лучший способ введения ЭП?
Залогом асептического течения ОДП служит метаболическое обеспечение высокоэнергозависимых иммунных реакций [6].
Энтеральное питание (ЭП) рекомендуется для предотвращения кишечной недостаточности и инфекционных осложнений. Согласно рекомендациям, у больных следует избегать полного парентерального питания (ППП), но следует учитывать, что комбинация парентерального питания (ПП) позволяет достичь потребности в калориях и белках, если ЭП не полностью переносится [7].
Однако, ППП следует назначать максимально быстро, при наличии показаний к лечебному питанию и противопоказаний к назначению ЭП [1]. В методических рекомендациях ESPEN guideline: Clinical nutrition in surgery (2017) отмечается, что целесообразно использовать контейнеры «три-в-одном» при проведении ППП [2].
Согласно рекомендациям ESPEN guidelines on parenteral nutrition: surgery (2009) для профилактики гнойно-септических осложнений рекомендуется использовать растворы, содержащие жировую эмульсию 3 поколения, обогащенную омега-3 жирными кислотами (ѡ-3 ЖК) [3]. Обогащенные рыбьим жиром липидные эмульсии снижают продолжительность пребывания в стационаре пациентов с критическими состояниями [8].
Методы и принципы исследования
Проанализированы данные пациентов с тяжелым острым панкреатитом, которые были госпитализированы в отделение интенсивной терапии (ОИТ) Днепровского клинического объединения скорой медицинской помощи за период с 2014 по 2018 годы.
Пациентам, у которых на вторые сутки проведения интенсивной терапии сохранялись явления кишечной недостаточности, что делало невозможным проведение раннего энтерального питания, нутритивная поддержка начиналась с проведения полного парентерального питания. Рандомизации больных в подгруппы проводилась в зависимости от вида смеси, которая использовалась в качестве нутритивной поддержки:
Подгруппа 1 (n=19) – больные с тяжелым острым панкреатитом, получившие трехкомпонентные смеси в специальных мешках для ППП.
Подгруппа 2 (n=17) – больные, которые для проведения ППП получили трехкомпонентные смеси с повышенным содержанием ѡ-3 жирных кислот.
Подгруппа 3 – больные (n=21), у которых проводилось ППП отдельными модулями из углеводов, аминокислот и липидов.
Критерии включения – госпитализация в ОИТ на протяжении первых суток от начала заболевания. Точки контроля: при поступлении больного в ОИТ, через 24 часа после начала ИТ (2 сутки), 3, 5, 7, 14, 21 сутки.
Проводили мониторинг основных клинических показателей: частота дыхания (ЧД в 1 мин), сатурация (StO2%), температура тела (° С), частота сердечных сокращений (ЧСС, уд / мин), артериальное давление (АД, мм рт. ст.). Оценивали тип гемодинамики по данным реографии, признаки диспептического синдрома, пареза кишечника и уровень внутрибрюшного давления (ВБД, мм рт. ст.), диурез (мл/ч).
Определяли активность альфа-амилазы в сыворотке крови, уровень диастазы в моче. Клинико-лабораторные показатели включали общий анализ крови и глюкозу крови, биохимический анализ крови (уровень общего белка и альбумина, креатинина, мочевины, трансаминаз и билирубина), показатели системы гомеостаза (коагулограммы), липидограмму (уровень холестерина, триглицеридов сыворотки крови, индекс атерогенности), уровень электролитов (Na+, Cl-, K+, ммоль/л) и показатели кислотно-щелочного состояния.
Всем больным проводилась стандартная ИТ: зондирование для декомпрессии желудка, коррекция дегидратации сбалансированными кристаллоидами под динамическим гемодинамическим мониторингом, контроль боли обеспечивался проведением мультимодальной анальгезии (нестероидные противовоспалительные препараты в комбинации со спазмолитиками, продленная эпидуральная аналгезия), контроль дыхательной недостаточности (респираторная терапия), антимикробная терапия, подавление секреции желудка (ингибиторы протонной помпы) и поджелудочной железы (октреотид 0,1 мг подкожно 3 раза в течение 3 суток), профилактика тромбоэмболических осложнений, стимуляция перистальтики, выбор метода нутритивной поддержаки в зависимости от функции желудочно-кишечного тракта (ЖКТ), эндоскопическое установление зонда за дуоденоеюнальний изгиб при принятии решения проведения трофического ЭП. При необходимости проведения хирургического лечения операциями выбора были – диагностическая лапароскопия и дренирование брюшной полости.
Функция ЖКТ определялась на основании исходных показателей болевого, диспепсического синдрома (тошнота, рвота, диарея, вздутие живота и нарушение перистальтики), уровня внутрибрюшного давления (ВБД, мм рт. ст.) и остаточного объема желудка (мл).
Для описания первичного массива данных использовали результаты описательной статистики. Для количественных данных проверку гипотезы о нормальном законе распределения случайной величины проводили по критерию Шапиро-Уилка. В случаях нормального закона распределения данных статистические характеристики были представлены в виде: объема выборки (n - количество наблюдений), средней арифметической (M), стандартной ошибки средней (m), стандартного отклонения (standard deviation - SD), 95% доверительного интервала для средней (95% confidence interval – CІmin-CІmax), коэффициента вариации (С, %).
В случаях отклонения гипотезы о нормальном законе распределения данных приводили: значение медианы (Me), нижний квартиль 25% (lower quartile - LQ), верхний квартиль 75% (high quartile - HQ). Статистические характеристики подавались в тексте в виде: M±m или Ме (25%; 75%).
Статистическую обработку данных проводили с помощью пакета программ статистического анализа STATISTICA v.6.1 (Statsoft Inc., США).
Основные результаты
Этиологическим фактором развития ОП у больных группы исследования на фоне алиментарного (81,1%) были: избыточное потребление алкоголя (45,9%), билиарный ОП (10,8%), острый идиопатический панкреатит регистрировался у 2,7% случаев.
Сопутствующая патология определена в 99% пациентов с ОП. Превалировала сопутствующая патология со стороны сердечно-сосудистой системы (78,4%). У этих больных также регистрировали сопутствующую патологию со стороны дыхательной системы (10,8%), желудочно-кишечного тракта (17,0%), сопутствующий сахарный диабет (СД) II типа (16,2%) случаев. При этом определено, что у 75,7% больных регистрировалась полиморбитная патология.
У всех пострадавших были проанализированы гендерные и антропометрические показатели (Табл. 1). Определено, что 68% с ОП были мужчины, 32% – женщины. Пациенты подгрупп исследования достоверно не отличались по возрасту, весоростовым показателям и индексу массы тела (ИМТ).
Таблица 1 – Антропологические показатели пациентов подгрупп сравнения
| Статистический показатели | Подгруппа 1 | Подгруппа 2 | Подгруппа 3 | Межгрупповые отличия |
| Возраст, годы М±m Ме (25 %; 75 %) | 50,1±4,8 53,0 (32,7; 64,0) | 41,3±3,2 45,5 (32,7; 48,0) | 47,3±2,5 47,0 (38,5; 55,0) | р1, 2=0,146 р1, 3=0,611 р2, 3=0,158 |
| Маса, кг М±m, Ме (25 %; 75 %) | 93,9±4,3 96,5 (80,0; 106,3) | 86,3±5,3 86,0 (78,3; 94,8) | 86,3±3,4 84,0 (77,5; 95,0) | р1, 2=0,280 р1, 3=0,177 р2, 3=0,996 |
| Рост, М±m, см Ме (25 %; 75 %) | 171,8±2,6 172,3 (165,5; 178,0) | 172,9±3,9 177,0 (161,0; 183,7) | 174,8±2,4 178,0(167,0; 186,0) | р1, 2=0,825 р1, 3=0,408 р2, 3=0,689 |
| ИМТ, М±m Ме (25 %; 75 %) | 31,9±1,7 31,2 (28,3; 34,0) | 29,1±1,9 28,4 (25,3; 31,2) | 27,1±1,1 27,8 (25,2; 31,8) | р1, 2=0,264 р1, 3=0,082 р2, 3=0,736 |
Для исключения факторов, которые могут повлиять на результат анализа влияния нутритивной поддержки обнаружено, что при госпитализации пациенты имели острый тяжелый панкреатит, средние значения АРАСРЕ у пациентов 1, 2 и 3 подгрупп были 18,3±0,3 ед., 18,6±0,3 ед. и 18,0±0,5 ед., соответственно. Средние значения амилазы крови у пациентов 1, 2 и 3 подгрупп превышали верхнюю границу нормы в 3 раза (до 133,1±31,7 мккатал/л, 91,0±26,4 мккатал/л, 73,2±9,6 мккатал/л, соответственно), диастазы мочи – более чем в 5 раз (до 594,3±79,4 мккатал/л, 776,9±143,7 мккатал/л, 695,8±85,7 мккатал/л, соответственно).
Через 1 сутки проведения ИТ у больных 1 и 2 групп наблюдения достоверно снизились средние значения α-амилазы сыворотки крови на 55,9% и 65,7% соответственно (p1=0,009 і р2<0,001) и и диастазы мочи на 10,8% и 16,8% (p1=0,016 і р2=0,003), соответственно. Полная нормализация уровня α-амилазы сыворотки крови у пациентов 1 и 2 групп регистрировалась на 7 сутки ИТ, когда ее средние значения были 22,0±2,1 мккатал/л и 26,1±2,4 мккатал/л, соответственно. Полная нормализация уровня диастазы мочи была на 14 день проведения ИТ (80,1±10,9 мккатал/л и 88,2±14,0 мккатал/л, соответственно). Уровень показателей был в пределах нормы весь последующий период наблюдения.
При госпитализации у пациентов с ОП наблюдалась гемоконцентрация, когда средние значения гематокрита крови у больных подгрупп 1, 2 и 3 были в пределах 49,7±1,1%, 49,0±1,3% и 48,1±1,3%, соответственно. Проведение инфузинои терапии в течение 1 суток интенсивной терапии у этих больных в объеме 3059,2±222,4 мл, 3230,0±183,6 и 3043,3±196,5 мл (р1, 2=0,560, р1 3=0,958 и р2, 3=0,494) позволило снизить уровень Нt крови на 7,4%, 5,7 и 5,2%, соответственно. На 3 сутки средние значения Нt крови у больных 1 подгруппы достигали 43,8±0,9 (р = 0,001 до исходного уровня), 2 подгруппы - 44,7±0,9% (р=0,016 до исходного уровня), 3 подгруппы – 43,8±0,8 (р=0,001 до исходного уровня). При этом средние значения не отличались статистически достоверно (U=57,5, p=0,864). Данные изменения можно объяснить использованием эффективного объема инфузионной терапии в комплексе интенсивной терапии (ИТ). Это позволяло корректировать гемоконцентрацию на фоне гиповолемии, которая развивалась в первых суток заболевания у больных с ОП.
Таким образом, определено, что больные исследуемых подгрупп имели достоверной разницы показателей общих факторов, которые отражали тяжесть ОП при госпитализации.
При госпитализации уровень внутрибрюшного давления превышал норму на 23,8%. Динамику уровня ВБД у больных с тяжелым ОП в подгруппах представлено на рис. 1.
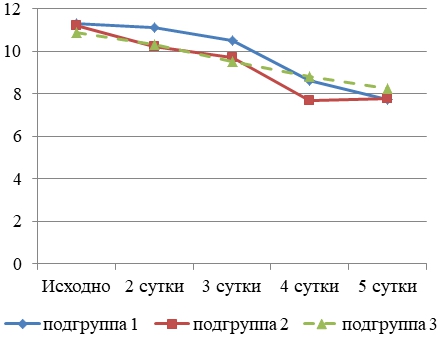
Рис. 1 – Динамика уровня внутрибрюшного давления у больных с тяжелым ОП
Остатистически достоверное снижение средних значений ВБД регистрировали толко на 4 сутки до 8,8±0,5 мм рт. ст. (р<0,001) с нормализацией показателя на 5 сутки ИТ. Таким образом, средние значения ВБД превышали значения нормы до 5 суток ИТ, в связи с чем полное ПП было методом выбора нутритивного обеспечения у больных 1, 2 и 3 подгрупп наблюдения.
При поступлении у пациентов с тяжелым ОП регистрировали развитие синдрома гиперкатаболизма, когда уровень кортизола крови у больных подгрупп 1, 2 и 3 превышал показатели нормы в 1,8 (1212,5±45,5 нмоль/л), 1,7 (1117,4±70,4 нмоль/л) и 1,9 (1230,8±74,5 нмоль/л) раз, соответственно. На фоне проведения ИТ средние значения кортизола крови снижались на 3 и 5 сутки заболевания, достигали значений нормы на 14 сутки (р<0,001 до исходного уровня), когда средние значения составили в 1 подгруппе – 552,2±50,5 нмоль/л, во 2 подгруппе – 558,2±46,4 нмоль/л и в 3 подгруппе – 614,3±38,4 нмоль/л. Различия между подгруппами были не достоверные (p=0,910).
При поступлении у пациентов 1 группы уровень общего белка (ОБ) крови был в пределах нормы и достоверно не отличался между подгруппами. На 1 сутки ИТ у больных 1, 2 и 3 подгрупп уровень ОБ крови уменьшился на 7,1% (р=0,008), 7,6% (р=0,062) и 7,6% (р=0,006), соответственно. Снижение уровня ОБ крови наблюдалось на 3 сутки заболевания – до 56,3±1,0 г/л у больных 1 подгруппы (р=0,009), до 56,8±0,9 г/л (р=0,317), у больных 2 подгруппы, у больных 3 подгруппы – до 57,8±0,7 г/л (р=0,008), различия между подгруппами были не достоверными.
При проведении канонической корреляции, выявлена взаимосвязь между гипопротеинемией, которая сохранялась в течение 3, 5, 7 и 14 суток течения ОП и развитием осложнений (Rс=0,797, р=0,005), проявлениями СПОН более 48 часов (R=0,722, р=0,033) и увеличением сроков госпитализации (R=0,643, р=0,051).
Тенденция к увеличению уровня ОБ регистрировалась на 7 сутки ИТ у больных 2 подгруппы до 60,0±1,5 г/л (р=0,028 к предыдущему этапу), среднее значение которого превышали показатели больных подгрупп 1 и 3 (р1, 2=0,075 и р2, 3=0,037, соответственно). На 14 сутки заболевания отмечался рост средних значений ОБ сыворотки крови для подгрупп 1 и 2 до 58,3±2,1 г/л и 63,4±1,8 г/л, соответственно. Различия между подгруппами были не достоверными за счет большого разброса значений (U=28,5, p=0,069). Медиана показателя на этом этапе была, соответственно, 61,0 г/л (56,0; 62,5) и 64,0 г/л (60,0; 68,0). Значение медианы ОБ крови больных 3 подгруппы были 59,0 г/л (54,7; 62,0). На 21 сутки средние значения Ме ОБ крови составляли у больных 1 подгруппы – 63,0 г/л (58,0; 64,0), 2 подгруппы - 67,0 г/л (64,0; 72,0) и 3 подгруппы – 59,0 г/л (54,7; 62,0). Таким образом, уровень ОБ сыворотки у пациентов 2 подгруппы превышал показатели больных 1 и 3 подгрупп на 6,0% и 11,9%, соответственно. Можно предположить, что добавление ԝ-3 ЖК в составе ППП трехкамерными мешками способствует более быстрому восстановлению уровня общего белка крови на фоне течения тяжелой ОП.
По данным ESPEN guideline on clinical nutrition in the intensive care unit (2019) определено, что уровень альбумина крови является маркером тяжести состояния и отражает воспалительный статус [4]. Поэтому провели анализ динамики уровня альбумина в зависимости от схемы ППП у пациентов с тяжелым панкреатитом.
При госпитализации уровень А крови у больных 1 и 3 подгрупп был на нижней границе нормы (30,2±1,2 г/л и 30,8±0,5 г/л, соответственно), средние значения альбумина крови у больных 2 подгруппы были ниже нормы (28,5±0,8 г/л). На 3 сутки ИТ тяжкого ОП уровень альбумина крови уменьшался (р1=0,044, р2=0,366 и р3=0,001 до предыдущего этапа). На 5 сутки у больных 2 подгруппы средние значения альбумина крови достоверно увеличились до 30,7±0,5 г/л (р2=0,025 к предыдущему этапу) и превышали значения его исходного уровня. На 14 сутки наблюдения средние значения альбумина пациентов 1 и 2 подгрупп были выше нижней границы нормы и составляли 31,6±2,3 г/л и 36,5±1,5 г/л, соответственно (р1, 2=0,179). У пациентов подгруппы 3 наоборот уровень альбумина крови продолжал снижаться до 25,3±1,6 г/л (р3<0,001 до исходного уровня) и был достоверно меньше по сравнению с пациентами, которым ППП проводилось с использованием трёхкамерных мешков (р1, 3=0,038 и р2, 3<0,001).
По данным канонической корреляции определена тенденция между гипоальбуминемией, которая регистрировалась на 5 и 14 сутки заболевания и развитием осложнений (R=0,584, р=0,090), проявлениями СПОН более 48 часов (R=0,536, р=0,067) и увеличением длительности госпитализации (R=0,536, р=0,057).
Таким образом, на фоне тяжелого острого панкреатита с первого дня заболевания имела место тенденция к гипоальбуминемии, которая нарастала до 3 суток на фоне провдения ИТ. У больных, которым проводили ППП смесями, сбалансированными по микронутриентам (белки, жиры и углеводы) в трёхкамерных мешках, уровень альбумина начинал увеличиваться на 5 сутки ИТ, и достигал нормы на 14 сутки. Проведение модульного ППП не обеспечивало белковосохраняющий эффект, сопровождалось увеличением количества осложнений ОП в течение ранней фазы заболевания (R=0,797, р=0,005) и увеличением сроков госпитализации у больных с ОП (R=0,643, р=0,051).
При поступлении у больных с тяжелым ОП регистрировали развитие стресиндуцированной гипергликемии, когда уровень глюкозы сыворотки крови у больных 1 подгруппы был – 11,3±0,8 ммоль/л, 2 подгруппе – 10,2±0,5 ммоль/л и в 3 подгруппе – 10,0±0,6 ммоль/л. Проведение ИТ в течение первых суток сопровождалось достоверным снижением уровня гликемии, соответственно, на 20,4% (p=0,032), 14,7% (p=0,062) и 10,6% (p=0,028 к предыдущему этапу). На 3 сутки уровень глюкозы крови продолжал снижаться у пациентов 2 и 3 подгрупп до 7,2±2,2 ммоль/л (p=0,043) и 7,4±0,4 ммоль/л (p=0,031), соответственно. У пациентов 1 подгруппы средние значения оставались в пределах 8,9±0,4 ммоль/л (р1, 2=0,001, р1, 3=0,011). На 5 сутки у больных 1, 2 и 3 подгрупп средние значения глюкозы крови снизились на 30%, 33% и 20% по отношению к исходному уровню. Более выраженная тенденция к нормализации уровня глюкозы крови наблюдалась у больных 2 подгруппы, когда ее средний уровень достигал 5,8±0,6 ммоль/л на 14 сутки заболевания. На 21 сутки средние значения глюкозы сыворотки крови были для 1 подгруппы – 5,9±0,8 ммоль/л, 2 подгруппы – 5,5±0,8 ммоль/л, 3 подгруппы – 6,3±0,7 ммоль/л, различия между подгруппами были недостоверны (р1, 2=0,427, р1, 3=0,702 и р2, 3=0,483).
Таким образом, тяжелый ОП с 1 суток сопровождался развитием стресс-индуцированной гипергликемии, уровень которой начинал достоверно снижаться на фоне проведения ИТ уже через сутки после госпитализации. Более выраженная динамика по нормализации уровня глюкозы крови наблюдали у больных 2 подгруппы.
По данным канонической корреляции определено, что на более выраженную динамику уровня глюкозы крови со 2 до 14 суток ИТ влиял метод ППП с использованием трёхкамерных мешков с повышенным содержанием ѡ-3 ЖК (Rс=0,783, р=0,037). Таким образом, можно предположить, что добавление ѡ-3 ЖК в состав ППП способствует более быстрой нормализации уровня гликемии на фоне течения тяжелого ОП.
Исследуя динамику креатинина сыворотки крови обнаружено, что у пациентов 1, 2 и 3 подгрупп с тяжелым ГП с момента госпитализации наблюдалось повышение его уровня до 152,6±20,5 мкмоль/л, 125,4±10,0 мкмоль/л и 152,4±22,4 мкмоль/л, соответственно. Через сутки проведения ИТ регистрировали снижение уровня креатинина сыворотки крови у всех больных с ОП, более выраженное у больных 2 подгруппы (106,4±8,7 мкмоль/л). Различия между группами были статистически достоверны (р1, 2=0,024 и р2, 3=0,064). Дальнейшее достоверное снижение средних значений креатинина крови регистрировали на 3 сутки ИТ у больных подгрупп 1 и 3 (р1=0,041 и р3=0,064 до исходного уровня). С 7 суток уровень креатинина крови был в пределах нормы у всех больных с тяжелым ОП.
Определено, что у больных с тяжелым ОП 1 и 2 подгрупп, которым проводили ППП с использованием трёхкамерных мешков, общий срок стационарного лечения был 27,5±2,7 дней и 22,1±0,8 дней, соответственно, и был статистически значимо меньше, чем у пациентов, которым проводилось ППП с использованием модульных систем (35,5±7,7 дней) (р1, 2=0,001, р1, 3<0,001, р2, 3<0,001).
Заключение
Течение тяжелого острого панкреатита с 1 суток сопровождается развитием синдрома гиперкатаболизма, когда уровень кортизола крови у больных 1, 2 и 3 подгрупп исследования превышал показатели нормы в 1,8, 1,7 и 1,9 раз, соответственно. Этосопровождалось стресс-индуцированной гипергликемией с 1 суток заболевания, нарастанием гипопротеинемии и гипоальбуминемии со 2 суток заболевания.
На фоне проведения ППП с использование смесей в тракамерных мешках, сбалансированными по макронутриентам, средние значения альбумина и общего белка крови начинали увеличиваться на 5 сутки заболевания, достигая нормы на 14 и 21 сутки, соответственно.
Проведение модульного ПП не обеспечивало белковосберегающий эффект на фоне гиперкатаболизма, обусловленном течением тяжкого ОП, сопровождалось увеличением количества осложнений течение ранней фазы заболевания (р=0,005) и увеличением длительности госпитализации (р=0,051).
Добавление ԝ-3 ЖК в состав смесей в трехкамерных мешках для проведения парентерального питания способствовало более быстрому восстановлению уровня общего белка, альбумина и глюкозы сыворотки крови на фоне течения тяжелого ОП.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- ESPEN guideline: Clinical nutrition in surgery / A. Weimann, M. Braga, F. Carli, T. Higashiguchi, M. Hübner, S. Klek, A. Laviano, O. Ljungqvist, D.N. Lobo, R. Martindale, D.L. Waitzberg, S.C. Bischoff, P. Singer // Clinical Nutrition. – – Vol. 36. – P. 623-650.
- ESPEN guideline: Clinical nutrition in surgery / Weimann A., Braga M., Carli F. and others // Clinical Nutrition. – 2017. – Vol. 36. – P. 623-650.
- ESPEN guidelines on parenteral nutrition: surgery / Braga M., Ljungqvist O., Soeters P., Fearon K., Weimann A., Bozzetti F. // Clin Nutr. – 2009. – Vol. 28. – P. 378-386.
- ESPEN guideline on clinical nutrition in the intensive care unit / Singer P., Blaser A.R., Berger M.M. and others // Clinical Nutrition. – 2019. – Vol. 38. – P. 48-79.
- Classification of acute pancreatitis-2012: revision of the Atlanta classification and definitions by international consensus / Banks P.A., Bollen T.L., Dervenis C., Gooszen H.G., Johnson C.D., Sarr M.G. and others / Gut. – 2013/ - Vol. 62. – P. 102–111. doi: 10.1136/gutjnl-2012-302779.
- Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (ASPEN) / McClave S.A., Martindale R.G., Vanek V.W. and others. // JPEN J Parenter Enteral Nutr. – 2009. – Vol. 33. – P. 277-316.
- 2019 WSES guidelines for the management of severe acute pancreatitis / Leppäniemi, M. Tolonen, A. Tarasconi et al // World Journal of Emergency Surgery. – 2019. – N. 14: 27 doi: 10.1186/s13017-019-0247-0.
- 9 ԝ-3 fatty acid-enriched parenteral nutrition regimens in elective surgical and ICU patients: a meta-analysis / L. Pradelli, K. Mayer, M. Muscaritoli, A.R Heller // Critical Care. – 2012. – 16: R184. doi:10.1186/cc11668.
