СПОСОБ ИДЕНТИФИКАЦИИ МИКРООРГАНИЗМОВ С ПОМОЩЬЮ ЭФФЕКТА ГИГАНТСКОГО РАМАНОВСКОГО РАССЕИВАНИЯ
Александров М.Т.1, Буданова Е.В.2, Баграмова Г.Э.3, Пашков.Е.П.4
1ORCID: доктор медицинских наук, профессор Научно-клинического центра» Реабилитации женского здоровья»
2ORCID: 0000-0003-1864-5635, кандидат медицинских наук, доцент,
ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет)
3ORCID: доктор медицинских наук, профессор,
ФГАОУ ВО Российский университет дружбы народов
4ORCID: , доктор медицинских наук, профессор
ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет)
СПОСОБ ИДЕНТИФИКАЦИИ МИКРООРГАНИЗМОВ С ПОМОЩЬЮ ЭФФЕКТА ГИГАНТСКОГО РАМАНОВСКОГО РАССЕИВАНИЯ
Аннотация
Описан экспресс-метод идентификации микроорганизмов с помощью рамановской спектроскопии, основанный на эффекте гигантского рамановского рассеивания при облучении объекта коротковолновым лазером 532 нм с использованием разработанных авторами специальных серебряных SERS-подложек, усиливающих эффект. Результаты исследований показали высокую аналитическую и диагностическую чувствительность и специфичность метода, что позволяет считать его перспективным универсальным экспресс-методом микробиологической диагностики, который не требует длительного культивирования бактерий и специальной пробоподготовки.
Ключевые слова: раман-спектроскопия, рамановское рассеивание, идентификация микроорганизмов.
Aleksandrov M.T.1, Budanova E.V.2, Bagramova G.E.3, Pashkov E.P.4
1ORCID: MD, Professor of the Clinical Research Centre “Women's Health Rehabilitation”
2ORCID: 0000-0003-1864-5635, MD, Associate Professor, FSAEI “Sechenov First Moscow State Medical University of the Ministry of Healthcare of Russia” (Sechenov University)
3ORCID: MD, Professor, FSAEI Peoples' Friendship University of Russia
4ORCID: MD, Professor, FSAEI “Sechenov First Moscow State Medical University
of the Ministry of Healthcare of Russia” (Sechenov University)
METHOD OF MICROORGANISMS IDENTIFICATION WITH THE HELP OF THE EFFECT OF LARGE RAMAN DIFFUSION
Abstract
A rapid method for the identification of microorganisms using Raman spectroscopy is described in the article, based on the effect of large Raman diffusion when the object is irradiated with a 532 nm shortwave laser, using special silver SERS-based substrates that enhance the effect. The results of the studies showed high analytical and diagnostic sensitivity and specificity of the method. This makes it a promising universal express-method for microbiological diagnosis, which does not require long-term bacterial culture and special sample preparation.
Keywords: Raman spectroscopy, Raman diffusion, identification of microorganisms.
Для постановки микробиологического диагноза, основанного на определении вида возбудителя, важным критерием является его быстрота. Однако классический бактериологический метод диагностики, основанный на выделении и идентификации чистой культуры бактерий по совокупности их специфических свойств при всей его достоверности и информативности весьма трудоемок, финансово затратен, а самое главное – длителен (составляет как минимум несколько дней). Кроме того, большую проблему представляет выделение и идентификация трудно культивируемых микроорганизмов – анаэробов и внутриклеточных паразитов, а также некультивируемых форм микробов. В этой связи в настоящее время резко возрос интерес к новым методам спектроскопии, позволяющим проводить качественный и количественный анализ биологических жидкостей и тканей в максимально короткие сроки. Эти методы позволяют получать информацию о видовой характеристике микроорганизмов без их длительного выращивания по физико-химическим свойствам значимых компонентов бактериальной клетки и характерным продуктам ее метаболизма [1-5].
К таким методам, в частности, относится рамановская спектроскопия как один из вариантов метода лазерной конверсионной диагностики (ЛКД). Она основана на том, что при облучении образца светом определенной длины волны начинается процесс неупругого рассеяния оптического излучения на молекулах вещества (твердого, жидкого или газообразного), сопровождающийся заметным изменением частоты излучения. Наблюдаемое явление называют эффектом комбинационного рассеяния или эффектом Рамана, которое регистрируется в виде набора спектральных линий, отсутствующих в спектре первичного (возбуждающего) света. При анализе такого спектра наблюдаемые линии могут быть однозначно отнесены к колебаниям молекул исследуемого вещества и определению частот их вращения, и в зависимости от значения частоты, интенсивности, формы, числа и расположения линий позволяют сделать вывод о структуре и идентичности пробы. Поскольку не существует двух молекул с одинаковыми спектральными характеристиками, можно говорить о рамановском "отпечатке", который позволяет определять разнообразные вещества по спектрам неупругого (рамановского) рассеяния света [6-13]. Важной особенностью этого метода является возможность работы с нативным материалом и интракорпорально (непосредственно в тканях организма), высокая специфичность и чувствительность (как аналитическая, так и диагностическая), получение результатов в максимально короткие сроки (минуты), а также высокая производительность, воспроизводимость результатов, простота выполнения и доступность.
В связи с вышеизложенным, целью нашего исследования было определение возможности идентификации микроорганизмов в чистой культуре на основе эффекта гигантского рамановского рассеивания.
Для этого были поставлены следующие задачи: разработать экспресс-метод индикации микробов на основе эффекта гигантского рамановского рассеивания и флюоресценции; оценить чувствительность и специфичность разработанной методики; провести сравнительную характеристику рамановских спектров различных клинических штаммов микроорганизмов.
Материалы и методы исследования.
Для исследования использовались суточные культуры клинических штаммов Bacillus subtillis, Candida albicans, Enterococcus faecalis, Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, S. haemoliticus, S. saprophyticus. Культуры выращивали на плотной питательной среде мясо-пептонный агар, МПА (ФГУП ГНЦ ПМБ, Россия), помещая их на нефлюоресцирующую подложку (фильтр Millipore Membrane Filter, Merck, USA). Данная подложка представляет собой гидрофильный мембранный микробиологический фильтр из нетканого материала, состоящий из смеси нитрата и ацетата целлюлозы, размер пор 0,45 мкм.
Перед измерением спектров подложку с культурой помещали на предметное стекло и с помощью прибора ИнСпектр М (ООО «ИнСпектр», Россия) [14] регистрировали спектр рамановского рассеивания и флюоресценции. Использованный нами медицинский раман-люминесцентный комплекс компактен, имеет высокую разрешающую способность порядка 1Å (что в 60-80 раз лучше, чем у существующих отечественных аналогов), высокую чувствительность и воспроизводимость измерений, не дает искажений снимаемого сигнала и исключает влияние фоновой засветки на результаты измерений, позволяя использовать микрообъемы исследуемого материала. Важной особенностью данной установки является возможность подавления сигнала рэлеевского рассеяния за счет обрезания Edge-фильтром, что позволяет регистрировать истинные раман-люминесцентные спектры объектов исследования (рис. 1).
Для повышения чувствительности прибора с целью усиления интенсивности флюоресценции нами были разработаны специальные шероховатые серебряные SERS-подложки (Surface-Enhanced Raman Scattering), которые позволяют на непористых субстратах вести анализ бактериальных суспензий в микрообъемах. Они имеют высокий коэффициент усиления (около 107), могут работать на разных длинах волн возбуждающего излучения (от 400 нм до 800 нм), имеют тонкий слой материала на своей поверхности, обволакивающего рельефные выступы и впадины наноструктуры. Плазменный резонанс такой подложки находится в области 450 нм – 550 нм, что позволяет использовать зеленый лазер с длиной волны 532 нм для возбуждения рамановского рассеивания, что имеет бóльшую эффективность благодаря резкой частотной зависимости эффективности рассеяния света.
Результаты исследования. На рис 1 представлена схема установки для получение спектральных характеристик образцов на основе гигантского рамановского рассеивания: за лазером после системы отражающих зеркал стоит узкополосный лазерный фильтр, который пропускает излучение лишь вблизи лазерной частоты. После фильтра лазерное излучение попадает на полупрозрачное зеркало и после прохождения через линзу фокусируется на образец. Далее свет, рассеянный биологическим или любым другим веществом, после обрезания линии лазера интерференционным Edge-фильтром попадает в спектрометр. Спектры неупругого рассеяния света и сигнала флюоресценции с исследуемых веществ записываются на компьютер с помощью специальной программы.
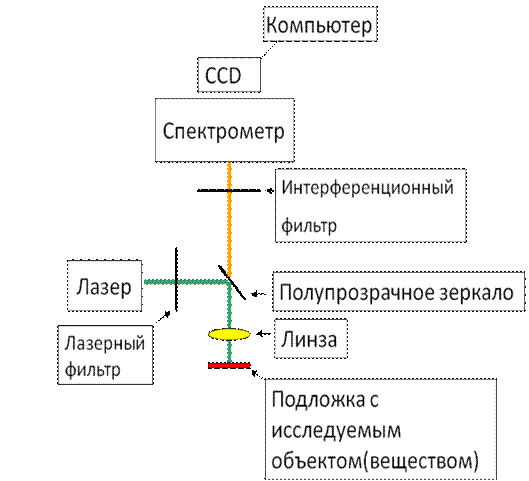
Рис. 1 – Блок-схема установки для измерения неупругого (рамановского) рассеяния света
Результаты наших исследований представлены в виде графиков спектральных характеристик микроорганизмов (рис. 2-5). Всего исследовано 8 видов микробов, 450 тест объектов микробов, проанализировано и систематизировано 1350 спектров микробов.
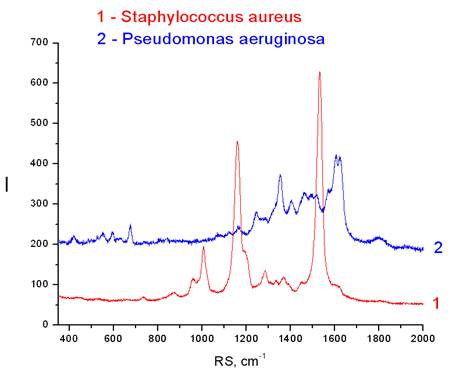
Рис. 2 – Сравнение спектров P. aeruginosa и S. aureus
По оси абсцисс x – рамановское рассеивание, raman shift (см-1) обратные сантиметры приняты в спектроскопии и переводятся в значения длин волн рассеянного света; по оси ординат y – интенсивность рассеянного света.
На рис. 2 показаны примеры спектров Staphylococcus aureus (красный цвет) и Pseudomonas aeruginosa (синий спектр), записанных на SERS-подложках. Оба спектра были измерены после того, как капля бактериальной суспензии высохла и все молекулы раствора с колониями бактерий были осаждены на SERS-подложку. Как видно на графике, пики интенсивности рассеянного света этих двух видов бактерий разных таксономических групп не совпадают по интенсивности и локализации в спектральной области рамановского рассеивания: для S. aureus индивидуальны рамановские пики находятся на 959 см-1, 1006 см-1, 1160 см-1, 1284 см-1, 1530 см-1, а для P. aeruginosa — 675 см-1, 1353 см-1, 1404 см-1, 1605 см-1, 1630 см-1.
На рис. 3 представлены рамановские спектры микроорганизмов разных таксономических групп – бактерий видов Bacillus subtilis, Enterococcus faecalis и грибов рода Candida. Как видно из иллюстраций, спектры и интенсивность рамановского рассеивания представленных к сравнению микроорганизмов не совпадают и отражают их видовую специфичность.
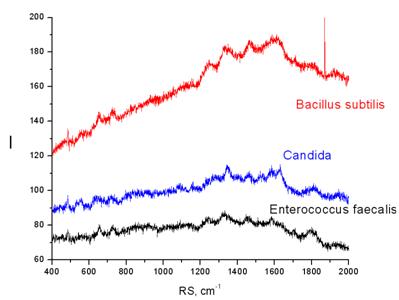
Рис. 3 – Рамановские спектры B. subtilis, C. albicans и E. faecalis
Для оценки диагностической чувствительности и специфичности метода ЛКД, основанного на эффекте гигантского рамановского рассеивания, мы определяли спектры E. coli с использованием SERS-подложек и без них (рис. 4). Из представленных на рисунке результатов экспериментов следует, что отсутствие подложки практически не изменяет амплитудно-спектральные характеристики объекта исследования (характерный для E. coli пик сохраняется в области 480 нм), как в суспензии бактерий в изотоническом растворе натрия хлорида, так и в присутствии антисептика мирамистина.
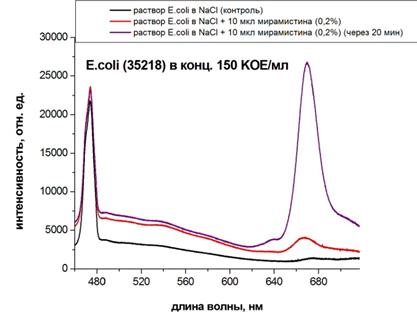
Рис. 4 – Определение концентрации E.coli по флюоресценции (проводили без использования SERS-подложек)
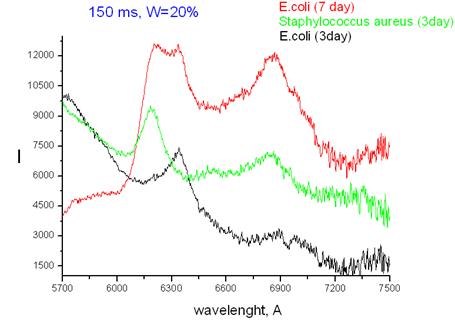
Рис. 5 – Сравнение ЛКД спектров E.coli (7-дневная культура), E.coli (3-дневная культура) и S.aureus (3-дневная культура)
В наших экспериментах показано также, что спектры ЛКД (рамановского рассеивания и флюоресценции) исследованных культур зависят от их возраста (рис. 5). При этом спектры изменяются, а их специфические рамановские линии сохраняются. Выявленная особенность свидетельствует о том, что видовая специфичность микробов сохраняется при старении культур и это расширяет возможности применения методики.
Все измерения повторяли по 100 раз для каждого вида микробов и в результате проведенных исследований показали, что аналитическая чувствительность технологии ЛКД достигала 104 – 105 КОЕ/мл, а специфичность метода составляет практически 100%.
Таким образом, лазерная конверсионная диагностика (ЛКД) на основе эффекта гигантского рамановского рассеивания может рассматриваться как экспрессный метод индикации и идентификации микроорганизмов, который позволяет обнаруживать их в низких концентрациях (104 – 105 КОЕ/мл). Метод рамановской спектроскопии отличается высокой аналитической и диагностической чувствительностью и специфичностью, необходимыми для точной идентификации микроорганизмов, быстротой получения результата (как количественного, так и качественного), не требует культивирования бактерий и специальной пробоподготовки, что в совокупности является важными характеристиками достоверного исследования и обеспечивает такие критерии эффективности работы лаборатории, как аналитическая надежность, своевременность получения результата и экономическая эффективность. Указанные преимущества метода дают основание рассматривать его в качестве перспективного универсального экспресс-метода микробиологической диагностики заболеваний микробной этиологии.
Список литературы / References
- Александров М.Т. Лазерная клиническая биофотометрия (теория, эксперимент, практика)./Александров М.Т. - М., Москва, 2008. - 456 с.
- Александров М.Т. Применение эффекта гигантского рамановского рассеяния для идентификации основных возбудителей гнойно-воспалительных процессов./Александров М.Т., Попов С.Н., Сатушева Е.Н., Кукушкин В.И., Пашков Е.П. // Клиническая медицина. - 2015. - С.110-120.
- Александров М.Т. Идентификация микроорганизмов на основе эффекта гигантского рамановского рассеяния./ Александров М.Т., Кукушкин В.И., Амбарцумян О.А., Пашков Е.П., Буданова Е.В. и др. // ЖМЭИ. - 2013. №5. - С. 97- 100.
- Sundaram J. Surface enhanced Raman scattering (SERS) with biopolymer encapsulated silver nanosubstrates for rapid detection of foodborne pathogens. /Sundaram J, Park B, Kwon Y, Lawrence KC. //Int J Food Microbiol. – - Iss.167. Vol. 1. – Pp. 67-73.
- Boardman AK. Rapid Detection of Bacteria from Blood with Surface-Enhanced Raman Spectroscopy. Boardman AK, Wong WS, Premasiri WR, Ziegler LD, Lee JC, et al.// Anal Chem.-2016 -Vol. 88(16).-Pp. 8026-8035.
- Premasiri WR. Rapid urinary tract infection diagnostics by surface-enhanced Raman spectroscopy (SERS): identification and antibiotic susceptibilities./ Premasiri WR, Chen Y, Williamson PM, Bandarage DC, Pyles C, Ziegler LD, et al. // Anal Bioanal Chem. - 2017 .- Iss. 409(11). - Pp. 3043-3054.
- Sinha SS. Nanoarchitecture Based SERS for Biomolecular Fingerprinting and Label-Free Disease Markers Diagnosis. / Sinha SS, Jones S, Pramanik A, Ray PC. // Chem Res. – 2016. Vol. 49(12).- Pp. 2725-2735.
- Wang P. Label-free mapping of single bacterial cells using surface-enhanced Raman spectroscopy. / Wang P, Pang S, Chen J, McLandsborough L, Nugen SR, et al. // Analyst. – 2016. Vol. 141(4). – Pp. 1356-1362.
- Baritaux JC. A study on identification of bacteria in environmental samples using single-cell Raman spectroscopy: feasibility and reference libraries. / Baritaux JC, Simon AC, Schultz E, Emain C, Laurent P, et al. // Environ Sci Pollut Res Int. – 2016. Vol. 23(9). – Pp. 8184-8191.
- Александров М.Т. Двадцатилетний опыт применения лазерно-флюоресцентной диагностики в клинической микробиологии. / Александров М.Т., Пашков Е.П., Быков А.С., Гунько В.И., Попов С.Н. и др.// Вестник РАМН. - 2011. №1. - С.35-38.
- Alexandrov M.T. Increasing efficiency of laser fluorescence diagnostics of microbial diseases. / Alexandrov M.T., Ivanova M.A., Pashkov E.P., Khomenko V.A., et al. // Laser Physics. 2007. - Vol. 17.№ 12.- P. 1416-1423.
- Alexandrov M.T. Laser fluorescence spectroscopy and factor analysis in diagnostics of microbial diseases. / Alexandrov M.T., Gaponenko O.G., Khomenko V.A., Kuzmin G.P., et al. // Laser Physics. - 2007. - Vol. 17.№ 3. - Pp. 290-295.
- Наумик А.В. Спектроскопия комбинационного рассеянного света в микробиологической диагностике: достижения, преимущества, перспективы. /Наумик А.В. // ЖМЭИ.-2013. №4. – С. 100-110.
- Кулик Л.В. Спектрально-селективный портативный раман-люминесцентный анализатор. /Кулик Л.В., Журавлев А.С., Ваньков А.Б., Кукушкин В.И., Горбунов А.В., Кукушкин И.В.//Патент РФ RU 2526584 C2
Список литературы на английском языке / References in English
- Alexandrov M.T. Lazernaja klinicheskaja biophotometrija (teoria, experiment, practica) [Laser clinical biophotometry (the theory, experiment, practice)]. / Alexandrov M.T. - М., Moscow, 2008.-456 с. [in Russian]
- Alexandrov M.T. Primenenie effekta gigantskogo ramanovskogo rassejania dlya identifikatsii osnovnih vozbuditeley gnoino-vospalitelnykh processov [Application of the giant Raman scattering effect to identify the main pathogens of purulent-inflammatory processes]. / Alexandrov M.T., Popov S.N., Satusheva E.N., Kukushkin V.I., Pashkov E.P. // Clinicheskaya Meditsina [Clinical Medicine]. - 2015.- P.110-120. [in Russian]
- Alexandrov M.T. Identifikatsija mikroorganizmov na osnove effekta gigantskogo ramanovskogo rassejania [The identification of the microorganisms based on the giant Raman scattering effect]. / Alexandrov M.T., Kukushkin V.I., Ambartsumjan O.A, Pashkov E.P., Budanova E.V., et al. // Zhurnal Microbiologii [Journal of Microbiology]. - 2013. №5. - P. 97- 100. [in Russian]
- Sundaram J. Surface enhanced Raman scattering (SERS) with biopolymer encapsulated silver nanosubstrates for rapid detection of foodborne pathogens. /Sundaram J, Park B, Kwon Y, Lawrence KC. //Int J Food Microbiol. – - Iss.167. Vol. 1. – Pp. 67-73.
- Boardman AK. Rapid Detection of Bacteria from Blood with Surface-Enhanced Raman Spectroscopy. Boardman AK, Wong WS, Premasiri WR, Ziegler LD, Lee JC, et al.// Anal Chem.-2016 -Vol. 88(16).-Pp. 8026-8035.
- Premasiri WR. Rapid urinary tract infection diagnostics by surface-enhanced Raman spectroscopy (SERS): identification and antibiotic susceptibilities./ Premasiri WR, Chen Y, Williamson PM, Bandarage DC, Pyles C, Ziegler LD, et al. // Anal Bioanal Chem. - 2017 .- Iss. 409(11). - Pp. 3043-3054.
- Sinha SS. Nanoarchitecture Based SERS for Biomolecular Fingerprinting and Label-Free Disease Markers Diagnosis. / Sinha SS, Jones S, Pramanik A, Ray PC. // Chem Res. – 2016. Vol. 49(12).- Pp. 2725-2735.
- Wang P. Label-free mapping of single bacterial cells using surface-enhanced Raman spectroscopy. / Wang P, Pang S, Chen J, McLandsborough L, Nugen SR, et al. // Analyst. – 2016. Vol. 141(4). – Pp. 1356-1362.
- Baritaux JC. A study on identification of bacteria in environmental samples using single-cell Raman spectroscopy: feasibility and reference libraries. / Baritaux JC, Simon AC, Schultz E, Emain C, Laurent P, et al. // Environ Sci Pollut Res Int. – 2016. Vol. 23(9). – Pp. 8184-8191.
- Alexandrov M.T. Dvadtsatiletny opyt primenenija laserno-fljuorescentnoy diagnostiki v clinicheskoy microbiologii [Twenty-year experience in the use of laser-fluorescent diagnostics in clinical microbiology]. / Alexandrov M.T., Pashkov E.P., Bykov A.S., Gun’ko V.I., Popov S.N., et al. // Vestnik RAMN [Bulletin of Russian Academy of Medical Science]. - 2011. №1. - С.35-38. [in Russian]
- Alexandrov M.T. Increasing efficiency of laser fluorescence diagnostics of microbial diseases. / Alexandrov M.T., Ivanova M.A., Pashkov E.P., Khomenko V.A., et al. // Laser Physics. 2007. - Vol. 17.№ 12.- P. 1416-1423.
- Alexandrov M.T. Laser fluorescence spectroscopy and factor analysis in diagnostics of microbial diseases. / Alexandrov M.T., Gaponenko O.G., Khomenko V.A., Kuzmin G.P., et al. // Laser Physics. - 2007. - Vol. 17.№ 3. - Pp. 290-295.
- Naumyk A.V. Spektroskopiya kombinacionnogo rassejannogo sveta v mikrobiologicheskoy diagnostike: dostizhenija, preimuschestva, perspektivy [The spectroscopy of Raman scattered light in microbiological diagnostics: achievements, advantages, prospects]. / Naumyk A.V. // Zhurnal Microbiologii [Journal of Microbiology]. - 2013. №4. – P. 100-110.
- Kulik L.V. Spektral’no-selktivny portativny raman-luminescentny analyzator [Spectral-selective portable raman-luminescent analyser]. / Kulik L.V., Zhuravlev A.S., Van’kov A.B., Kukushkin V.I., Gorbunov A.V., Kukushkin I.V.//- Patent RF [Patent of Russian Federation] RU 2526584 C2
