СОЧЕТАННЫЕ ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ И ДИСФУНКЦИИ МОЧЕВОГО ПУЗЫРЯ И КИШЕЧНИКА У ЖЕНЩИН С ДИСПЛАЗИЕЙ СОЕДИНИТЕЛЬНОЙ ТКАНИ
Московенко Н.В.
Кандидат медицинских наук, Омская государственная медицинская академия
СОЧЕТАННЫЕ ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ И ДИСФУНКЦИИ МОЧЕВОГО ПУЗЫРЯ И КИШЕЧНИКА У ЖЕНЩИН С ДИСПЛАЗИЕЙ СОЕДИНИТЕЛЬНОЙ ТКАНИ
Аннотация
Целью настоящего исследования явились анализ заболеваемости хроническим циститом и изучение морфофункционального состояния мочевого пузыря и кишечника у данной категории пациенток. Обследовано 205 женщин, страдающих хроническим циститом. Установлена значительная частота синдрома дисплазии соединительной ткани и вегетативных нарушений, воспалительных заболеваний внутренних гениталий, желудочно-кишечного тракта. Исследование также показало, что характерными особенностями у данной когорты пациенток было наличие плоскоклеточной метаплазии переходного эпителия, выраженных перитонеальных спаек и сочетанных дисфункций тазовых органов, которым свойственны висцеральная гиперчувствительность и нарушения моторики, низкая толерантность к боли. Выявление и коррекция сопутствующих заболеваний и функциональных расстройств тазовых органов позволит улучшить результаты лечения больных хроническим циститом.
Ключевые слова: хронический цистит; дисплазия соединительной ткани; вегетативный дисбаланс, синдром «раздраженного кишечника».
Moskovenko N.V.
PhD in science, Omsk state medicine academia
COMBINED INFLAMMATORY DISEASES DYSFUNCTION BLADDER AND BOWEL AT WOMAN WITH CONNECTIVE TISSUE DYSPLASIA
Abstract
The purpose of the present research was study to analyses the incidence of chronic cystitis and study morpho-function condition of the bladder and bowel in this category of patients. 205 women reproductive age suffering by a chronic cystitis are surveyed. Significant frequency syndrome connective tissue dysplasia and vegetative disbalance, inflammatory diseases of internal genital organs, gastro-intestinal tract it is noticed. The research has shown that characteristic were also the presence of squamous methaplasia of the transitional epithelium expressed peritoneal adhesions, no laboratory signs of inflammatory activity and concomitant dysfunction of the pelvic organs, which is characteristic of visceral hypersensitiveness and motility disorders, low tolerance to pain. Exposure and correction of concomitant diseases and functional disorders of the pelvic organs will improve the results of treatment of patients with chronic cystitis.
Keywords: chronic cystitis, connective tissue dysplasia; autonomic imbalance syndrome "irritable bowel".
Хронические инфекционно-воспалительные заболевания в общей популяции выявляются в 60-70%, распространенность хронических инфекций мочевыводящих путей также высока [1]. Анализ открытых официальных и литературных источников позволяет констатировать существенный рост болезней мочеполовой системы за период последних 5 лет с 8777,5 до 10384,2 на 100 тыс. населения планеты (от 18 лет и старше). России заболеваемость хроническими циститами возросла на 52,4% и составляет 549,8 случаев на 100 тыс. населения [2,3]. В структуре патологии мочеполовой системы у женщин одно из первых мест принадлежит воспалительным заболеваниям, среди которых цистит наряду с воспалительными процессами матки и придатков занимает лидирующие позиции. Следует отметить, что у 25-50% женщин в течение года возникают рецидивы заболевания; при этом у 27% молодых женщин они развиваются в течение 6 месяцев и у 50% больных – более трех раз в год [4,5]. Несмотря на успехи в лечении, сохраняется тенденция к увеличению числа больных, страдающих воспалительными заболеваниями мочевого пузыря, «омоложению» этой группы заболеваний [6,7]. Полиэтиологичная природа заболевания и множественность факторов, поддерживающих патологический процесс в мочевом пузыре, обусловливают его значительную частоту [9,10]. Состояние сопряженных органов, в первую очередь – толстой кишки, оказывает непосредственное влияние на течение воспалительного процесса, способствуя хронизации и рецидивированию патологического процесса в мочевом пузыре и органах репродуктивной системы [11]. Осложняя течение основного заболевания, дисфункции тазовых органов обусловливают своеобразность клинического течения, позднюю диагностику, наличие различных осложнений, резистентность к проводимой терапии, усугубляют физические и моральные страдания, негативно влияя на сексуальную активность и нередко являясь причиной депрессии, социальной дезадаптации женщин, снижения трудоспособности [12,13,14]. Это объясняет тот факт, что частота обнаружения воспалительных процессов мочевого пузыря и фактическая заболеваемость не совпадают. Судить о распространенности и характере сопутствующих заболеваний и дисфункций тазовых органов у пациенток с хроническим циститом сложно. Анализу сопутствующих процессов и функций мочевого пузыря, кишечника у больных хроническим циститом посвящены единичные исследования; остаются неизученными изменения с анализом их состояния у пациенток с дисплазией соединительной ткани (ДСТ). Следует отметить, что данная проблема вообще достаточно редко и фрагментарно упоминается в научной литературе, прежде всего по причине чрезвычайной сложности, что обусловлено охватом как минимум двух смежных дисциплин.
Целью настоящего исследования явились анализ заболеваемости хроническим циститом и изучение морфофункционального состояния мочевого пузыря и кишечника у этой когорты пациенток.
Материал и методы исследования. Обследовано 205 женщин репродуктивного возраста, страдающих хроническим циститом и 30 здоровых. Критериями включения были: возраст 18-45 лет, наличие жалоб на дизурию, длительность заболевания более года; критериями исключения – возраст моложе 18 и старше 45 лет, беременность, лактация, длительность заболевания менее года, прием антибактериальных, иммуномодулирующих (если с момента их применения прошло менее трех месяцев), интеркурентные соматические заболевания, отказ от участия в исследовании. Всем пациенткам проводилось комплексное клинико-лабораторное обследование и количественный и качественный анализ фенотипических признаков дисплазии соединительной ткани; определяли маркеры её метаболизма и концентрацию магния в крови. Клинические проявления вегетативной дисфункции устанавливали на основании «Вопросника для выявления признаков вегетативных изменений». Выполняли ультразвуковую биометрию, цистоуретроскопию. Для дифференциальной диагностики нарушений мочеиспускания использовали таблицу IPSS, изучали ритмы суточных колебаний мочеиспускания, проводили комбинированное уродинамическое исследование – КУДИ («Duet Logic», «Medtronic»). Диагноз синдрома «раздраженного» кишечника устанавливали согласно III Римским критериям, оценку клинической симптоматики проводили с помощью полуколичественного метода, предложенного E.J. Bennett et al. (1998). Сенсомоторную функцию прямой кишки и анального канала изучили с помощью метода аноректальной манометрии на аппаратном комплексе PC Polygraf, (Synectics Medical, Швеция). Морфологическому исследованию подвергали биоптаты стенки мочевого пузыря, и сигмовидной кишки. Статистический анализ проводился методом вариационной статистики (с соблюдением общих рекомендаций для медицинских и биологических исследований).
Результаты и обсуждение. Анализ заболеваемости в Омской области показал, что женщины, страдающие хроническим циститом, составили 26,4% от общего числа пациенток репродуктивного возраста, госпитализированных в урологические отделения, из них 36,9% в течение года были госпитализированы повторно. В структуре амбулаторного приема доля хронического цистита достигла 29,6%, на диспансерном учете состояли 7,2% женщин. Ежегодно число больных хроническим циститом увеличивается в среднем на 2,7%.
Средний возраст пациенток составил 29,2±4,9 лет; при этом значительная доля (68,7%) больных была представлена пациентками в возрасте до 33 лет; из них более половины (52,5%) в возрасте до 25 лет. Частота обращений за медицинской помощью в течение года (предшествовавшего включению в проект) составила 6,4±1,2 раз; из них к урологу – 3,7±0,7 раза; гинекологу –1,8±0,5 раза; 93,7% женщин обращались к терапевту или гастроэнтерологу с частотой 1,9±0,5 раза. Продолжительность заболевания в основной массе (82,5%) наблюдаемых не превышала 6 лет (5,6±1,1 лет).
Клинико-анамнестическое исследование позволило выявить значительную частоту заболеваний верхних дыхательных путей, ЛОР-органов, ЖКТ, почек. В структуре заболеваний репродуктивной сферы преобладали воспалительные процессы матки и придатков (95,6%). Дисменорея имела место у каждой второй женщины; нарушение менструальной функции – у 77,6%.
Нами отмечено, что у 77,1% женщин при осмотре имелись внешние стигмы дизэмбриогенеза, среднее количество которых у пациенток с ДСТ было достоверно (p<0,0001) больше по сравнению с группой здоровых женщин и пациенток без ДСТ (7,6±0,5 против 2,0±0,4 и 2,3±0,2 соответственно). Маркерами ДСТ также были: аномалии положения ободочной кишки (42,4%), пролапс гениталий (20,5%), варикозная болезнь нижних конечностей (32,9%), миопия (64,4%), нефроптоз (59,4%) женщин и аномалии почек и матки (70,9%), малые аномалии сердца – у 106 (67,1%). Вегетативная дисфункция верифицирована у 129 (81,6%) женщин с ДСТ и лишь у 24 (51,1%) – без таковой. Средний балл у женщин с ДСТ был достоверно (p<0,05) выше (32,4±2,8 балла) в сравнении с группой контроля (10,0±0,6 баллов) и пациентками без ДСТ (28,2±2,4 баллов). У пациенток с ДСТ выявлено повышение уровня гликозаминогликанов и дезоксипиридинолина в 1,8 раза, оксипролина – в 1,2 раза, снижение концентрации магния в сыворотке крови в 1,4 раза (p<0,01). Пациентки с фенотипическими признаками составили основную группу, без её проявлений – группу сравнения.
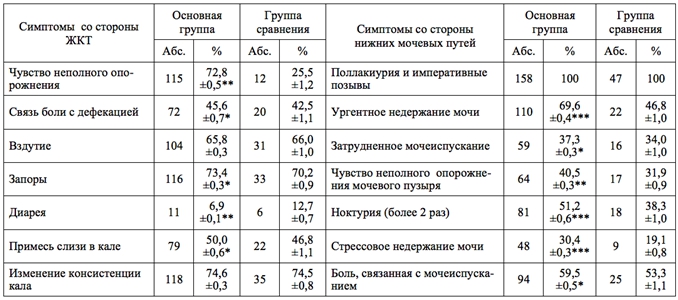
Отмечено наличие однотипных жалоб у пациенток со стороны нижних мочевыводящих путей и ЖКТ (императивные позывы или тенезмы, чувство неполного опорожнения, нарушение ритма опорожнения, распирание, необходимость прилагать усилия при мочеиспускании или дефекации, боль после или перед опорожнением). Среди жалоб независимо от возраста преобладали такие значимые симптомы, как учащенное мочеиспускание, императивные позывы и ургентное недержание мочи (табл. 1). На чувство неполного опорожнения мочевого пузыря, постоянное желание помочиться и затруднённое мочеиспускание указала каждая третья женщина, на недержание мочи в связи с напряжением – каждая четвертая. Другим, не менее частым симптомом была боль, связанная с мочеиспусканием.
Жалобы со стороны ЖКТ беспокоили 94,9% женщин ишечного тракта беспокоили 1й заинтересованности как сегментарных, так и надсегментарных структур вегетативной регуляцииобследованных оооооооооосновной и 87,2% – группы сравнения. Анализ симптомов показал, что у 87,3% представительниц основной и 74,4% – группы сравнения они соответствовали критериям СРК, средний балл которого у пациенток основной группы был достоверно (p<0,001) выше (12,7±0,5 против 10,8±0,7).
Однако частота отдельных симптомов все же не даёт четкого представления о реальной степени тяжести расстройств мочеиспускания.
Таблица 1 - Частота симптомов со стороны нижних мочевыводящих путей и ЖКТ, %
Примечание: достоверность различий * – p<0,05, ** – p<0,01, *** – p<0,001
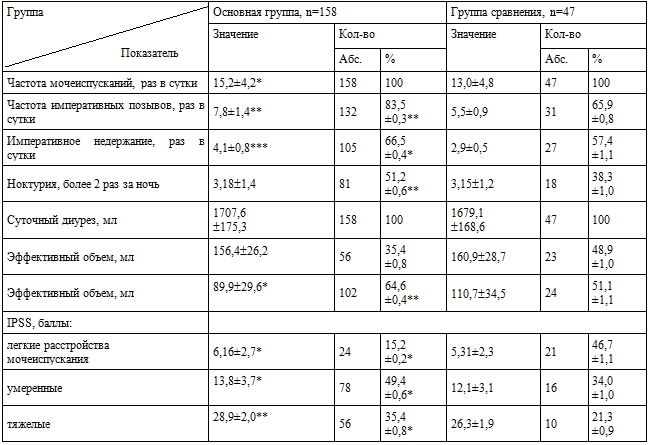
Для оценки тяжести расстройств мочеиспускания использовали оценочную шкалу IPSS, изучали суточные ритмы мочеиспускания (табл. 2).
Таблица 2 - Выраженность симптомов и расстройств мочеиспускания по шкале IPSS, M±σ
Примечание: достоверность различий * – p<0,05, ** – p<0,01, *** – p<0,001Частота легких нарушений мочеиспускания составила 22,0%, умеренных – у 45,9%; выраженных 32,2%.
Значительный интерес представляют данные, полученные при изучении ритма суточных колебаний мочеиспускания. Отмечено, что у пациенток в период с 8 до 12 час. частота мочеиспусканий колебалась в пределах 4-8 раз (5,7±2,1 раз), интервалы между ними – 20-55 минут, эффективный объем – от 40 до 110 мл. После 12 час. наблюдалось снижение частоты мочеиспусканий, удлинение интервалов между ними до 90-120 минут, повышение эффективного объема (140-205 мл). После 16 час. частота мочеиспусканий вновь повышалась до 4-7 раз, особенно к 18–20 часам (6,5±1,4 раз), в ночные часы мочеиспускание становилось реже. У здоровых женщин наибольшая активность мочевыделительной системы отмечалась в периоды 9–12 и 16–19 час.
По данным КУДИ ощущение первого позыва на мочеиспускание возникало при малом эффективном объёме (88,5±33,2 мл в основной и 109,5±24,7 мл в группе сравнения) и сопровождалось резким подъемом внутрипузырного давления (36,1±13,9 и 30,1±7,6 см вод. ст. соответственно); максимальная цистометрическая емкость была снижена (179,2±23,7 мл и 243,7±30,1 мл), амплитуда колебаний внутрипузырного давления достигала 35,3±13,7 см вод. ст., внутриуретрального – 5,2±1,4 см вод. ст., что соответствовало критериям гиперактивного детрузора, выявленного у 64,6% женщин основной и 51,1% группы сравнения.
Результаты анальной манометрии свидетельствовали о снижении порога ректальной чувствительности у пациенток с СРК; наблюдалось снижение давления, при котором возникало ощущение давления, боли и позыв к дефекации; податливость прямой кишки в ответ на растяжение баллоном была снижена (табл. 3). Уровень максимально переносимого объема у всех обследованных пациенток был значительно ниже по сравнению с таковыми показателями здоровых. Порог первого ощущения растяжения и базальное давление в прямой кишке не отличались от соответствующих у здоровых женщин.
Признаки дисфункционального (обструктивного) мочеиспускания несколько чаще выявлялись у пациенток основной группы (37,3% против 34,0%).
Таблица 3 - Показатели анальной манометрии
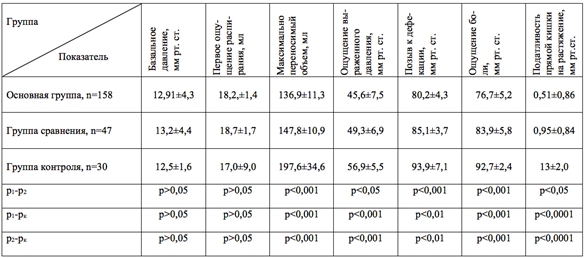
Примечание: p1-p2 – различия между основной и группой сравнения, p1-pк – основной и группой контроля; p2-pк – группой сравнения и группой контроля.
Повышенный тонус наружного анального сфинктера и парадоксальный рост давления при натуживании, имевший место у 25,4% женщин, повышение максимального внутриуретрального давления до 86,4±9,5 см. вод. ст. и отсутствие его падения во время мочеиспускания у 35,1% женщин явились признаками, указывающими на дисфункцию тазового дна, и способствовали развитию дисфункционального мочеиспускания, обструкции дефекации.
У 30,4% представительниц с ДСТ и 19,1% – без признаков независимо от возраста отмечено достоверное снижение максимального уретрального 48,3 ±7,8 и запирательного давлений 48,3±8,8, достоверных различий между группами не выявлено.
Пузырная картина отличалась многообразием проявлений и различной степенью выраженности патологического процесса; у 89,9% пациенток с ДСТ и 25,5% без таковой визуализировались так называемые «островки» лейкоплакии. Сопоставив характер изменений слизистой мочевого пузыря с данными ультразвуковой биометрии и лапароскопии, мы констатировали следующее. Для пациенток с ДСТ и наличием тазовых перитонеальных спаек были характерны гнездное усиление сосудистого рисунка, локальные изменения в области шейки мочевого пузыря и мочепузырного треугольника и наличие островков лейкоплакии (r=0,64, p<0,001); признаки активности воспалительного процесса отсутствовали. У женщин без признаков соединительнотканной дисплазии достоверно чаще (r=0,61, p<0,001) выявлялись геморрагии, фолликулярные и кистозные образования, эрозии, белесоватые островки лейкоплакии значительно визуализировались реже. Признаки спаечного процесса были не характерны или были слабо выражены (p<0,001), выявлялись не выраженные лабораторные признаки активности воспалительного процесса.
При колоноскопии у 56,3% больных основной и 55,3% – группы сравнения наблюдалась гиперкинезия кишки по спастическому типу. Слизистая оболочка выглядела несколько отёчной, гиперемированной, часто с наложениями слизи на стенках кишки, сосудистый рисунок был не выражен; складки были утолщенные, грубые. У пациенток с ДСТ достоверно чаще (p<0,05) выявлялись псевдополипы; атрофический и катаральный проктосигмоидит отмечены у 31,9% женщины основной и 23,1% группы сравнения.
Гистологическое исследование выполнено у 94,3% пациенток основной и 93,6% – группы сравнения, при этом степень выявляемых морфологических изменений в стенке мочевого пузыря варьировала от незначительных до выраженных. Примечательным явился тот факт, что наиболее распространенным (78,2%) морфологическим вариантом хронического воспаления в мочевом пузыре была плоскоклеточная метаплазия переходного эпителия. При этом эпителий, покрывающий слизистую оболочку, был представлен несколькими слоями разной толщины, на ограниченных участках отмечались неравномерное его истончение и дистрофические изменения с участками десквамации, определялись участки слизистой с незаконченной эпителизацией. Нередко переходный эпителий замещался утолщенными пластами многослойного плоского и был представлен крупными светлыми клетками в состоянии гидропической или гиалиново-капельной дистрофии и частично десквамирован, наблюдалась метаплазия переходного эпителия в многослойный плоский. В строме обнаруживались диффузные разрастания волокнистой или фиброзной соединительной ткани с очагами лимфогистиоцитарной инфильтрации (нередко со значительным скоплением плазматических клеток и клеток моноцитарно-макрофагальной системы), полнокровие венул и капилляров, расширение лимфатических сосудов, периваскулярный склероз. В редких случаях строма была бедна сосудами, покрыта переходным метаплазированным эпителием с акантозом. Морфометрический анализ показал, что у пациентов без ДСТ площадь переходного эпителия (35,4±1,65 против 14,7±2,89) и степень образования новых капилляров (26,7±2,87 против 10,7±1,48) в строме стенки мочевого пузыря были достоверно больше, а площадь воспалительного инфильтрата (9,7±2,03 против 18,5±1,66) – меньше (p<0,01).
Полученные при гистологическом исследовании 76,5% биоптатов стенки сигмовидной кишки у женщин основной и 65,9% – группы сравнения вуют в пользу верность различий данные были характерны для адаптивного изменения барьерных свойств слизистых. В стенке кишки у пациенток с ДСТ, так же как и в стенке мочевого пузыря, наблюдалось преимущественное увеличение элементов соединительной ткани. В собственной пластинке слизистой отмечено изменение соотношения клеточных элементов и активности эндотелиоцитов кровеносных сосудов, выявлено истончение выстилки кровеносных сосудов, расширение и разнонаправленность межмышечных интерстициальных пространств, накопление в них коллагена, вакуолизация мышечных клеток и наличие фрагментированных нервных волокон. Отмечены воспалительно-дистрофические изменения слизистой оболочки с гистиолимфоцитарной инфильтрацией, гиперплазией эндотелиоцитов, умеренный фиброз при сохранении общей структуры слизистой.
Выявленные корреляции (r=0,69, p<0,01) вегетативного дисбаланса и дисфункций тазовых органов позволили предположить непосредственное влияние вегетативных нарушений на развитие последних и их функциональный характер. Увеличение числа непроизвольных сокращений детрузора, давления и максимальной амплитуды его колебаний, уровня базального давления внутреннего анального сфинктера, неполное его расслабление указывали на дисфункцию гладких мышц. Разнонаправленность межмышечных интерстициальных пространств, накопление в них коллагена, вакуолизация мышечных клеток и наличие фрагментированных нервных волокон в стенке мочевого пузыря и кишки явились морфологическими признаками дисфункции гладких миоцитов. Дисфункция нервной системы приводит не только к нарушению моторики, но и развитию висцеральной гиперчувствительности, о чем свидетельствовали снижение податливости тканей в ответ на растяжение, низкая толерантность к боли. Наличие воспалительных процессов в стенке мочевого пузыря и кишки указывали на тот факт, что либо функциональные расстройства в своей основе имели органическую природу (вторичная природа дисфункций мочевого пузыря и кишки) либо имело место сочетание этих расстройств с воспалительными заболеваниями. Следовательно, дисфункцию тазовых органов можно рассматривать как частные проявления общего расстройства функции гладких мышц или висцеральной гиперчувствительности, либо их сочетания. В пользу функционального генеза выявленных нарушений говорили изменчивость и рецидивирующий характер жалоб, отсутствие прогрессирования симптомов, усиление расстройств под действием стресса.
Значительная частота фенотипических признаков ДСТ позволила нам заключить, что она определяет особенности течения заболевания, вовлечение в процесс одновременно нескольких органов и систем. Сопоставление данных биопсии стенки мочевого пузыря и сигмовидной кишки указывало на однотипные морфологические изменения, для которых характерно преобладание элементов соединительной ткани. Частота выявления тазовых перитонеальных спаек, лейкоплакии мочевого пузыря, псевдополипов сигмовидной кишки свидетельствовала об усиленной регенерации слизистых оболочек у пациенток с ДСТ (p<0,05). Характерными для пациенток с ДСТ также были значительная частота заболеваний матки и придатков, кишечника, умеренных и тяжелых проявлений вегетативной дисфункции, СРК, расстройств мочеиспускания и отягощенный анамнез; 48,7% опрошенных женщин (против 8,5% в группе сравнения) указали на наличие расстройств мочеиспускания у ближних родственников по женской линии.
Подытоживая, можно заключить, что у обследованных пациенток с хроническим циститом отмечена значительная частота фенотипических признаков ДСТ, распространенность которой и характерные изменения в стенке мочевого пузыря, позволяют предположить, что ДСТ изначально обусловливает состояние слизистых оболочек, их защитных механизмов и определяет течение патологического (воспалительного) процесса. Особенностями пациенток с ДСТ разнообразие клинической симптоматики, значительная доля вегетативной дисфункции, заболеваний инфекционно-воспалительного характера и сочетанных дисфункций тазовых органов, для которых свойственны моторные висцеральная гиперчувствительность и нарушения моторики, низкая толерантность к боли, отсутствие признаков активности воспалительного процесса. Следовательно, выявление и коррекция сопутствующих заболеваний и функциональных расстройств тазовых органов позволит улучшить результаты лечения больных хроническим циститом.
Литература
- Горностаева Ю.А. Иммуномодулирующая терапия в клинической практике // Consilium Medicum. - 2008. - Т. 10,№10. - С. 18-21.
- Infectious Diseases Society of America and the European Society for Microbiology and Infectious Diseases // Clin. Infect. Diseases. - 2011. - № 52 (5). - Р. 103-120.
- Лоран О.Б., Синякова Л.А, Косова И.В. Рецидивирующие инфекции мочевых путей. - М.: Медицинское инф. агентство, 2008. - 29 с.
- Неймарк А.И., Неймарк Б.А., Кондратьева Ю.С. Дизурический синдром у женщин. Диагностика и лечение. - М.: ГЭОТАР-Медиа, 2010. - 256 с.
- Biggs, W.S., Williams R.M. Common gynecologic infections // Prim. Care. -2009. - Vol.36, N1. - P.33-51.
- Judlin, P.G. Current concepts in managing pelvic inflammatory disease // Curr Opin Infect Dis. - 2010. - Vol.23, N1. - P.83-87.
- Кубин Н.Д. Современный патогенетический подход в лечении хронических воспалительных заболеваний мочевого пузыря: Автореф. дис. канд. мед. наук. - М., 2013. - 23 с.
- Стрельцова О.С. Патогенетические аспекты лечения хронического цистита // Саратовский научно-медицинский журнал. - 2009. - Т.5, № 3. - С. 424-428.
- Курносова Н.В. Актуальные аспекты фармакотерапии хронического цистита у женщин в стадии обострения // Саратовский научно-медицинский журнал. - 2010. - Т 6, № 3. - С. 705-708.
- Сизов К.В. Структурная реорганизация слизистой оболочки мочевого пузыря при хроническом цистите и его коррекция: Автореф. дис. канд. мед. наук. - Новосибирск, 2012. - 23 с.
- Birder, L.A., Hanna-Mitchell A.T., Mayer E. Cystitis, co-morbid disorders and associated epithelial dysfunction // Neurourol Urodyn. - 2011. -Vol. 30 (5). - P. 668-672.
- Григорашвили И.И. Гиперактивный мочевой пузырь. Взгляд невролога // Фарматека. - 2008. - №1. - С.23-26.
- Трубина Н.В. Нарушение нейрогуморальной регуляции в патогенезе, клинике и диагностике функциональных заболеваний желудочно-кишечного трата: Автореф. дис. канд. мед. наук. - Волгоград, 2009. - 22 с.
- Goldstein, H.B., Safaeian K., Garrod P. Depression, abuse and its relationship to interstitial cystitis // Int. Urogynecol. J. Pelvic Floor Dysfunct. -2008.-Vol. 19, №12.- 1683-1686.
References
- Gornostaeva Ju.A. Immunomodulirujushhaja terapija v klinicheskoj praktike // Consilium Medicum. - 2008. - T. 10,№10. - S. 18-21.
- Infectious Diseases Society of America and the European Society for Microbiology and Infectious Diseases // Clin. Infect. Diseases. - 2011. - № 52 (5). - R. 103-120.
- Loran O.B., Sinjakova L.A, Kosova I.V. Recidivirujushhie infekcii mochevyh putej. - M.: Medicinskoe inf. agentstvo, 2008. - 29 s.
- Nejmark A.I., Nejmark B.A., Kondrat'eva Ju.S. Dizuricheskij sindrom u zhenshhin. Diagnostika i lechenie. - M.: GJeOTAR-Media, 2010. - 256 s.
- Biggs, W.S., Williams R.M. Common gynecologic infections // Prim. Care. -2009. - Vol.36, N1. - P.33-51.
- Judlin, P.G. Current concepts in managing pelvic inflammatory disease // Curr Opin Infect Dis. - 2010. - Vol.23, N1. - P.83-87.
- Kubin N.D. Sovremennyj patogeneticheskij podhod v lechenii hronicheskih vospalitel'nyh zabolevanij mochevogo puzyrja: Avtoref. dis. kand. med. nauk. - M., 2013. - 23 s.
- Strel'cova O.S. Patogeneticheskie aspekty lechenija hronicheskogo cistita // Saratovskij nauchno-medicinskij zhurnal. - 2009. - T.5, № 3. - S. 424-428.
- Kurnosova N.V. Aktual'nye aspekty farmakoterapii hronicheskogo cistita u zhenshhin v stadii obostrenija // Saratovskij nauchno-medicinskij zhurnal. - 2010. - T 6, № 3. - S. 705-708.
- Sizov K.V. Strukturnaja reorganizacija slizistoj obolochki mochevogo puzyrja pri hronicheskom cistite i ego korrekcija: Avtoref. dis. kand. med. nauk. - Novosibirsk, 2012. - 23 s.
- Birder, L.A., Hanna-Mitchell A.T., Mayer E. Cystitis, co-morbid disorders and associated epithelial dysfunction // Neurourol Urodyn. - 2011. -Vol. 30 (5). - P. 668-672.
- Grigorashvili I.I. Giperaktivnyj mochevoj puzyr'. Vzgljad nevrologa // Farmateka. - 2008. - №1. - S.23-26.
- Trubina N.V. Narushenie nejrogumoral'noj reguljacii v patogeneze, klinike i diagnostike funkcional'nyh zabolevanij zheludochno-kishechnogo trata: Avtoref. dis. kand. med. nauk. - Volgograd, 2009. - 22 s.
- Goldstein, H.B., Safaeian K., Garrod P. Depression, abuse and its relationship to interstitial cystitis // Int. Urogynecol. J. Pelvic Floor Dysfunct. -2008. -Vol. 19, №12.- P. 1683-1686.