СНИЖЕНИЕ АКТИВНОСТИ ТРАНСАМИНАЗ СУММАРНЫМ ЭКСТРАКТОМ ФИТОКОМПОЗИЦИИ ПРИ ТОКСИЧЕСКОМ ПОВРЕЖДЕНИИ ПЕЧЕНИ
Гасанова Д.А.1, Асметов В.Я.2, Искендеров В.Г.3, Гасанова З.З.4
1ORCİD-0000-0002-9626-8997, кандидат медицинских наук, доцент кафедры фармакологии, Азербайджанский Медицинский Университет, 2Доктор медицинских наук, профессор кафедры фармакологии, Азербайджанский Медицинский Университет, 3Кандидат фармацевтических наук, доцент кафедры фармацевтической химии, Азербайджанский Медицинский Университет, 4Студент, Южно-Калифорнийский Университет, Лос Анжелес, Калифорния, США
СНИЖЕНИЕ АКТИВНОСТИ ТРАНСАМИНАЗ СУММАРНЫМ ЭКСТРАКТОМ ФИТОКОМПОЗИЦИИ ПРИ ТОКСИЧЕСКОМ ПОВРЕЖДЕНИИ ПЕЧЕНИ
Аннотация
Целью данного исследования является провести коррекцию суммой экстрактов Фитокомпозиции №1+Phyto F (Ph №1+ Phyto F) повышенной активности трансаминаз, свидетельствующих о некротических изменениях в печени с выходом ферментов в кровяное русло, в условиях токсического гепатита. Ph №1+Phyto F вводили per os ежедневно в течение 10 и 20 дней после воспроизведения патологии. Параллельно , для сравнения, проведена серия лечения препаратом Эссенциале форте Н (ЭФН). В контрольной серии у животных во всех пробах отмечалась четкая картина повышения активности печеночных ферментов, подтвеждающая развитие синдрома цитолиза. После курсов лечения исследовалась активность ферментов сыворотки крови:аланинаминотрансфераза (ALT), аспартат-аминотрансфераза (AST) и щелочная фофатаза (ALP), лактатдегидрогеназа (LDG), гамма-глутамилтрансфераза (γ-GT).
Результаты. Воздействие фитокомпозиции вызвало достоверное снижение активности ферментов и фермента гепатобилиарной системы - щелочной фосфатазы. Коэффициент отклонения от контролей (КОК) показателей активности ферментов печени, свидетельствует об уменьшении повреждения гепатоцитов, а также об эффективности, применяемой Ph№1+PhytoF. Результаты сравнительных анализов, при лечении (ЭФН), также показали достоверную фамакологическую эффективность применяемой Фитокомпозиции №1+ Phyto F. Для определения качественного состава Ph №1+Phyto F был использован метод спектрофотометрии [4]. Установлено совпадение максимумов поглащения рабочего и стандартного растворов, что свидетельствует о возможном наличии в испытуемом Ph №1+ Phyto F эссенциальных фосфолипидов. Применение Ph №1+Phyto F предупреждает формирование гиперферметенемии практически с полным восстановлением изучаемого показателя к концу третьей недели наблюдения. По результатам анализа обсалютных величин, вычислениe коэффициента гепатопротекторной активности (КГА), также подтверждает, что Ph №1+Phyto F обладает гепатопротекторной активностью.
Ключевые слова: токсический гепатат, активность трансаминаз, КОК, КГА.
Gasanova D.A.1, Asmetov V.Ya.2, Iskenderov V.G.3, Gasanova Z.Z.4
1ORCİD-0000-0002-9626-8997, MD, Associate Professor of the Department of Pharmaceutics, Azerbaijan Medical University, 2MD, Professor of the Department of Pharmaceutics, Azerbaijan Medical University, 3PhD in Pharmaceutics, Associate Professor of the Department of Pharmaceutical Chemistry, Azerbaijan Medical University, 4Student of Southern California University, Los Angeles, California, USA
DECREASE OF TRANSAMINASE ACTIVITY BY THE TOTAL EXTRACT OF PHYTOCOMPOSIS IN CASES OF LIVER TOXIC DAMAGE
Abstract
The aim of this study is to conduct the correction of the amount of extracts of Phytocomposition No.1+Phyto F (Ph No.1+Phyto F) with increased activity of transaminases, indicating necrotic changes in the liver with the release of enzymes into the bloodstream under the conditions of toxic hepatitis. Ph No.1+Phyto F was administered per os daily for 10 and 20 days after the reproduction of the pathology. At the same time, a series of treatments with Essentiale Forte N (EFN) was carried out for comparison. In the control series, the animals in all samples showed an increase in the activity of liver enzymes, confirming the development of cytolysis syndrome. After the treatment courses, the activity of serum enzymes was investigated: Alanine aminotransferase (ALT), aspartate aminotransferase (AST) and alkaline phosphatase (ALP), lactate dehydrogenase (LDG), gamma-glutamyltransferase (γ-GT).
Results. The effect of the phytocomposition caused a significant decrease in the activity of enzymes and the enzyme of the hepatobiliary system – alkaline phosphatase. The deflection from control coefficient of liver enzymes activity indices indicates a decrease in hepatocyte damage, as well as the effectiveness of PhNo.1+PhytoF. The results of comparative analyzes, during treatment also showed significant efficiency of the Phytocomposition No.1+Phyto F. Phosphorometric spectrophotometry was used to determine the qualitative composition of Ph No.1+Phyto F [4]. The coincidence of the absorption maxima of the working and standard solutions was found, which indicates possible presence of essential phospholipids in the Ph No.1+Phyto F tested. The use of Ph No.1+Phyto F prevents the formation of hyperfermentation with almost complete recovery of the studied indicator at the end of the third week of observation. Based on the results of the analysis of cessation values, the calculation of coefficient of hepatoprotective activity also confirms that Ph No.1+Phyto F has hepatoprotective activity.
Keywords: toxic hepatitis, transaminase activity, deflection from control coefficient, coefficient of hepatoprotective activity.
Введение. По данным ВОЗ за последние 25 лет в мире наблюдается тенденция к росту числа заболеваний печени, сопровождающейся высокой смертностью населения. На сегодня насчитывается более 2,5 млрд. человек. Этому способствовало резкое увеличение уровня вирусного и токсического гепатита, связанного с алкогольными, медикаментозными поврнждениями печени, а также неалкогольной жировой дистрофии печени [12]. Oбезвреживание нашего организма от промышленных и бытовых ядов, алкоголя, токсических доз лекарственных веществ, некачественных продуктов питания и др., принадлежит печени. В механизме токсического повреждения печени лежит возникновение свободных радикалов. Избыток свободных радикалов, индуцирует аномальную активацию ПОЛ в биологических мембранах гепатоцитов, что приводит к изменению и уменьшению гидрофобности липидного слоя мембран. Активация ПОЛ ведет к нарушению белково-липидных взаимосвязей, ингибированию активности ферментов и другим серьёзным нарушениям, вплоть до гибели печёночных клеток. Антиоксидантная система принимает непосредственное участие в молекулярных механизмах адаптации при поражении печени. В условиях токсического повреждения печени крыс тетрохлорметаном, отмечается снижение активности глютатионпероксидазы, изменение содержания восстановленного глютатиона, содержание которого может быть как сниженным так и повышенным, что индуцирует ПОЛ и способствует прогрессированию процесса повреждения гепатоцитов [16], [21], [22].
Распространённость токсических гепатитов, рост хронических форм болезни, а также омоложение групп больных, снижение трудоспособности, определяют многогранность проблемы [29] поиска эффективных, не токсичных средств растительного и биологического происхождения, оказывающих гепатопротекторное действие. Фиброзирование ткани печени, избыточная активация перекисного окисления липидов, сопровождается истощением антиоксидантной защиты, нарушением углеводного, белкового и др. видов обмена [13], [14], [23], [27]. Учитывая эти обстоятельства, в состав суммарного экстракта Ph№1+PhytoF были включены, изученные нами ранее экстракты из лекарственных растений, обладающих АО, антирадикальной активностью [17], восстанавливающих белковый обмен [30]. Однако, механизмы реализации патологических процессов в клетках печени, различными препаратами выяснены не достаточно [24] и не всегда отвечают требованиям в медицинской практике [20], а также вызывают множество побочных эффектов: диспепсию, озноб, головные боли, слабость, миалгии, лейкопению, тромбоцитопению, тиреотоксикоз и др. [19]. В связи с возрастающим уровнем заболеваемости вирусным гепатитом, хроническим гепатитом и гепатозом, а также с гепатотоксичностью лекарственных средств ведётся постоянный поиск новых малотоксичных средств растительного происхождения [11], [15], [25], [26], [28]. В настоящее время, для лечения печёночной патологии используются Эссенциале, Гептрал, Липофен, растительного происхожения Силибинин (силибор, легалон), содержащий активные вещества расторопша пятнистая, обладающая гепатозащитной активностью, а также Гепабене, содержащий экстракты из дымянки лекарственной и плодов расторопши пятнистой, обладающий желчегонным и гепатопротекторным действием и др. [18]. Горбаков В. В. и др. (1998) отмечали,что Гептрал активен в отношении гипоксии и оксидантного стресса при церрозе печени. Его активным компонентом является адеметионин, выполняющий важную реакцию трансметилирования и синтеза фосфолипидов [9]. Препаратом, содержащим эссенциальные фосфолипиды (EPL), ненасыщенные жирные кислоты и витамины В1, В2, В6, В12, РР, Е является препарат Эссенциале, применяемый при заболеваниях печени. Ушакова Е. А. [8] отмечает, что терапевтический эффект обеспечивают “эссенциальные ” фосфолипиды, а не витамины, входящие в его состав [8]. Поэтому, в настоящее время предпочтение отдаётся препарату Эссенциале форте Н, однокомпонентному препарату, содержащему EPL без витаминов [2], основным механизмом, которого является восстановление клеточных механизмов печени. Фосфадитилхолин, выделенный из сои и входящий в состав препарата липофен, исследовали при гепатитах, вызванных этанолом и CCl4. Препарат проявил высокую антиоксидантную активность и улучшал функциональную активность микросом печени при гепатите [3]. Исследованиями [ Тауки А.Н. и др] препаратов Фосфоглив, Эссенциале, Глицеризиновой кислоты, отвара корня Солодки, Ликвиритон авторы пришли к заключению, что комбинация эссенциальных фосфолипидов и глицеризиновой кислоты показали существенно более значительную гепатопротекторную активность, чем компоненты этой комбинации в отдельности.
После медикаментозного лечения тактивином и токоферолом токсического гепатита наилучший результат был получен при сочетанном их применении. При этом устранялась активность аланинаминотрансферазы (ALT) и аспартатаминотрансферазы (AST), нормализовалось содержание билирубина [1]. С 1998 года в при лечении многих заболеваний и в частности гепатитов, наблюдается тенденция к комплексной терапии [6].
Таким образом, особую актуальность приобретает изыскание и разработка безопасных, комбинированных высокоэффективных гепатопротекторов с оптимальными фармакологическими свойствами, а также создание удобной для приёма лекарственной формы. К такого рода лекарственным формам относятся настои, настойки, экстракты издавна применяемые в научной и народной медицине.
Нами, путём фармакологического поиска [10], [17], [11], [30] подобраны те лекарственные растения, которые были малотоксичными, биологически активны, оказывали антигипоксантное, антиоксидантное, адаптогенное действия, а также показали себя как антирадикальные гасители активной формы кислорода (АФК) [17] . В сумму экстрактов Ph №1+Phyto F, входят растения, имеющие в своем составе флавоноиды, рутин, эссенциальные фосфолипиды, глицеризиновую кислоту, витамины, А, Е, С, а также инулин. Учитывая эти данные, интерес представили следующие экстракты из лекарственных растений: Agrimonia Eupatoria L., Artemisia absinthium L., Cichorium intybus L., Humulus lupulus L., Salvia off. L., Echinops Ritro L., Glycyrrhiza glabra L., Sambucus nigra, Thymus L., Green tea, Herakleum L., Fumaria off., Calamagrjstis epigejos, Dischampsia caespitosa, Alfalfa, Paleurus Spina christa.
В отдельности многие из растений , входящих в фитокомпозицию, применяются в народной медицине Азербайджана, России, немецкой народной медицине, Средней Азии, Корочаево- Черкесии, Китае, Иране, Украине и многих других странах при болезнях печени, желчного пузыря, желтухе и других заболеваниях желудочно-кишечного тракта [ Махлаюк В. П. (1992,1993); Соколов С. Я., Замотаев И. П. (1990); Дамиров И. А., Прилипко Л. И., Шукуров Д. З. (1989).
Целью данного исследования явился тот факт, что большое количество лекарственных растений, представляющих интерес в лечебной практике и широко используемых в народной медицине многих народностей, не имеют научного обоснования в области терапии. В связи с чем, поставлена задача: 1. Исследовать воздействие суммарного экстракта Фитокомпозиции №1 + Phyto F (Ph №1 + Phyto F) на активность трансаминаз при токсическом повреждении печени; 2. Рассмотреть его фармакологические и биохимические спектры действия на функциональное состояние гепатоцитов; 3. Сравнить гепатопротекторную активность Ph №1 + Phyto F c известным препаратом Эссенциале форте Н (ЭФН); 4. Определить коэффициент отклонения от контроля (КОК) Ph №1 + Phyto F и ЭФН; 5. Определить коэффициент гепатопротекторной активности (КГА) Ph №1 + Phyto F и ЭФН; 6. Оценить антиоксидантные свойства исследуемых средств; 7. Сопоставить, изучаемые средства, по фармакологической актвности.
Материалы и методы исследования. Исследования выполнены на 42 кроликах рода шиншиллы обоего пола, массой 2,0 – 2,5 кг. Животные находились в условиях вивария, получали стандартное питание по установленным нормам [5], имели свободный доступ к воде. Экспериментальной моделью служил патологический процесс (токсический гепатит), который развивался у животных при внутримышечном введении четырехлористого углерода в дозе 0,1 мл/кг в равной части соответственно с персиковым маслом в течение 10 дней. Ph №1+Phyto F вводили per os 2ml/kg., EFN (в серии для сравнения) (Фармацевтическая компания Наттерман энд.Гм 6X. Германия) per os по 4mg/kg веса кролика. Животным ежедневно вводили, указанные препараты, в течение 10, 20 дней после воспроизведения патологии. До и после курсов лечения в сыворотке крови исследовались показатели ферментов печени: аланинаминотрансферазы (ALT), аспартатаминотрансферазы (AST), щелочной фосфатазы (ALP), лактатдегидрогеназы (LDH), гаммаглютаминтрансферазы (γ-GT)
Эксперименты проводились в 6 сериях. В каждую серию входило по 7 кроликов:
I-серия интактные животные, которым per os давали пить в соответствующем объеме воду для инъекций:
II- серия животных, которым воспроизводился токсический гепатит;
III- серия животных с токсическим гепатитом, получаших Ph №1+Phyto F в течение 10 дней;
IV- серия животных с токическим гепатитом, получавших лечение Ph №1+Phyto F в течение 20 дней;
V- серия животных, получавших лечение ЭФН в течении 10 дней;
VI – серия животных, получавших лечение ЭФН в течении 20 дней.
Определение активности ALT, AST, LDH проводили c помощью набора реактивов фирмы «Human» (Германия). Измерение проводили на биохимическом анализаторе STAT FAX - в кювете с толщиной 1 см при длине волны 340 нм.
Определение активности общей ALP проводили помощью набора реактивов фирмы «Human» (Германия). Принцип определения активности фермента в сыворотке крови основан на способности щелочной фосфатазы катализировать гидролиз р-нитрофенилфосфата до нитрофенола, окрашенного в щелочной среде в желтый цвет и неорганического фосфата. Количество образовавшегося в единице времени р-нитрофенола, который пропорционален активности фермента, определялся по оптической плотности образца при 405 нм.
Определение активности γ-GT проводили помощью набора реактивов фирмы «Human» (Германия). Измерение проводили на биохимическом анализаторе STAT FAX - в кювете с толщиной 1 см при длине волны 410 нм.
Для определения качественного состава Суммы экстрактов Ph№1+PhytoF использовали метод спектрофотометрии [4]. Для идентификации компонентов водно-спиртового экстракта Ph №1+Phyto F, сняты спектры поглащения в ультрофиолетовом и видемой областьях спектра света. Параллельно, в качестве сравнения, использовали раствор стандартного образца ЭФН, содержащего эссенциальные фосфолипиды.
(Продолжаются более глубокие исследования по качественному и количесвенному составу Ph №1+ Phyto F).
Для оценки направления и степени изменений показателей ферментов печени аспартатаминотрансферазы и др. рассчитывали коэффициент отклоненияо от контроля (КОК) по формуле:
КОК = [ (ASTоп - ASTи ) / ASTи] × 100% (Аналогичные расчеты сделаны для ALT, ALP, LDH, γ- GT ).
Где: ASTоп - показатели опытной серии;
ASTи - показатели интактной серии. (рис. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10).
Полученные результаты обрабатывали статистически на персональном компьютере на базе процессора Intel Pentium-II з тактовой частотой 900 MHz c использованием стандартного пакета программ «Mathematica V. 5,0 ». и t критерия Стьюдента.
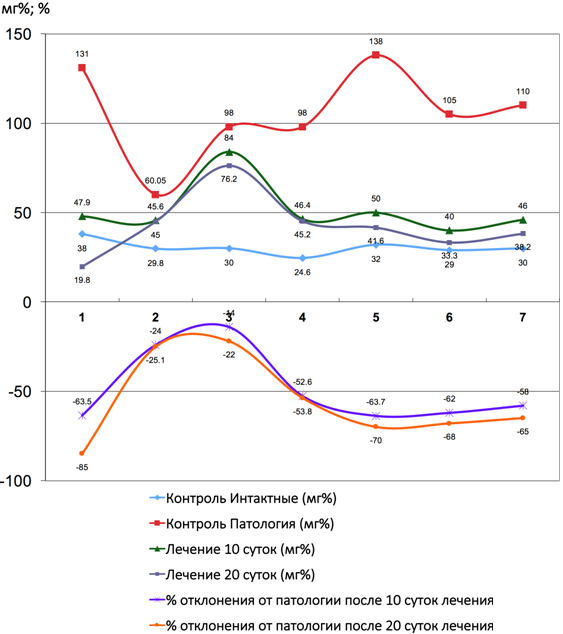
Рис. 1 – Показатели количества аланинаминотрансферазы и коэффициента отклонения от патологии до и после введения Фитокомпозиции № 1+Phyto F при токсическом гепатите у кроликов. (1 - 7 порядковые номера животных)
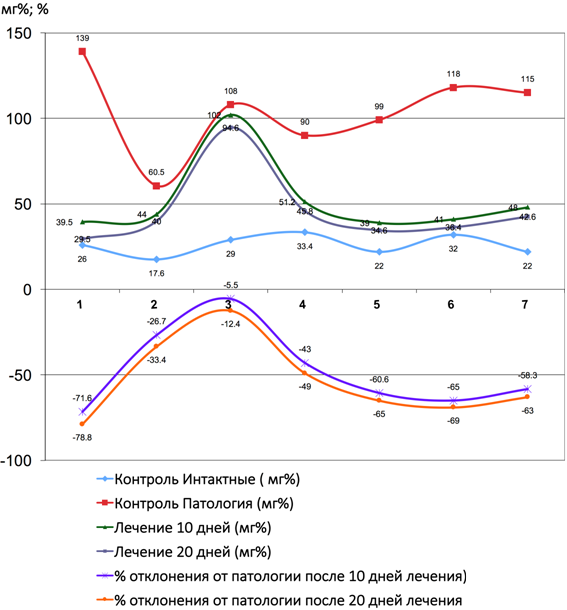
Рис. 2 – Показатели количества аспартатаминотрансферазы и коэффициента отклонения от патологии до и после лечения Фитокомпозицией № 1+Phyto F при токсическом гепатите у кроликов. (1 - 7 порядковые номера животных)
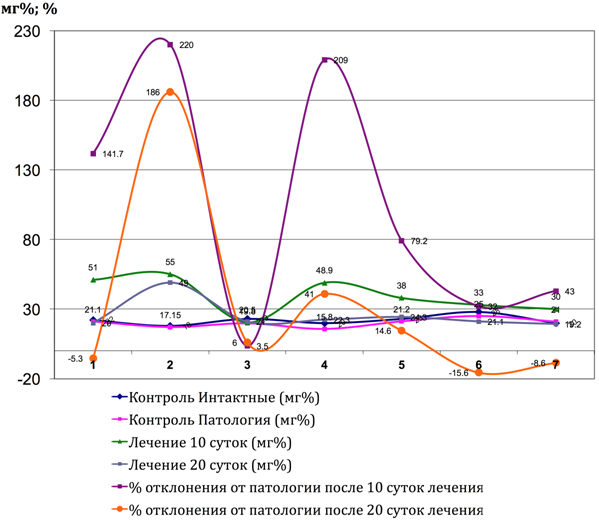
Рис. 3 – Показатели количества гаммаглютаминтрансферазы и коэффициента отклонения от паталогии до и после лечения Фитокомпозцией № 1 + Phyto F при токсическом гепатите у кроликов. (1 - 7 порядковые номера животных)
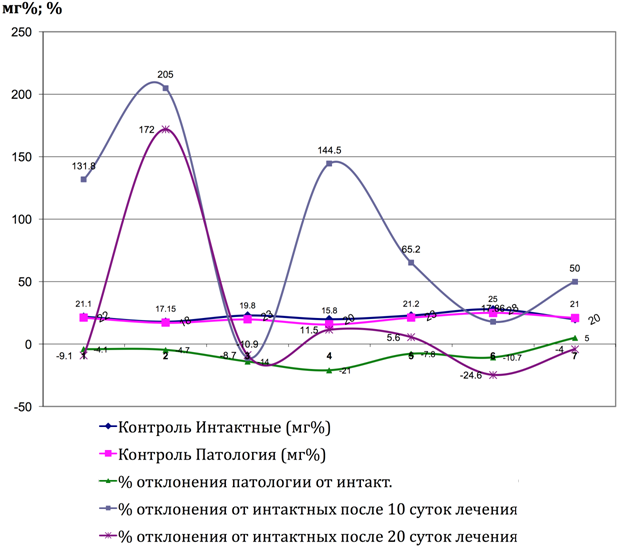
Рис. 4 – Показатели коэффициента отклоненеия гаммаглютамин трансферазы от интактных до и после лечения Фитокомпозицией № 1 + PhytoF при токсическом гепатите у кроликов. (1 - 7 порядковые номера животных)
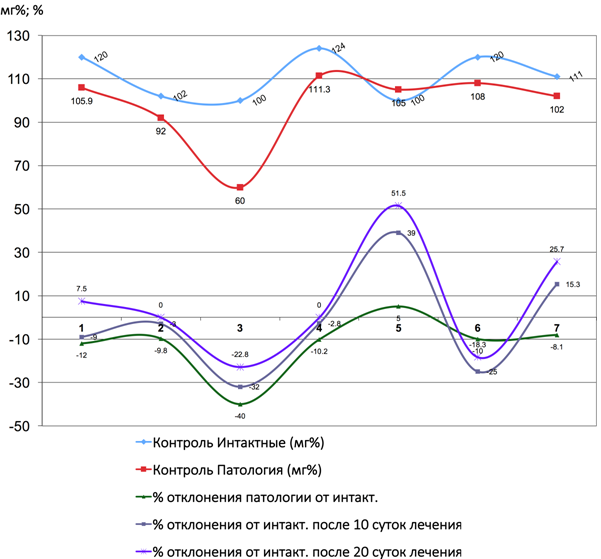
Рис. 5 – Показатели коэффициента отклонения щелочной фосфатазы от интактных до и после лечения Фитокомпозицией № 1+Phyto F при токсическом гепатите у кроликов. (1 - 7 порядковые номера животных)
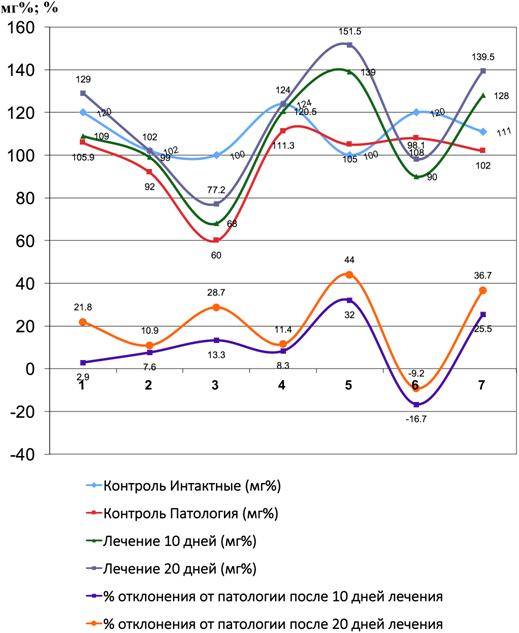
Рис. 6 – Показатели щелочной фосфатазы и коэффициента отклонения от патологии до и после лечения Фитокомпозицией № 1+Phyto F при токсическом гепатите у кроликов. (1 - 7 порядковые номера животных)
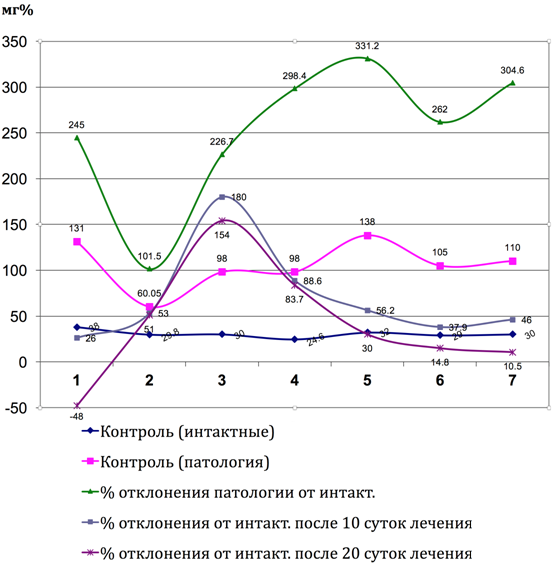
Рис. 7 – Показатели коэффициента отклонения аланинаминотрансферазы от интактных до и после лечения Фитокомпозицией № 1+Phyto F при токсическом гепатите у кроликов. (1 - 7 порядковые номера животных)
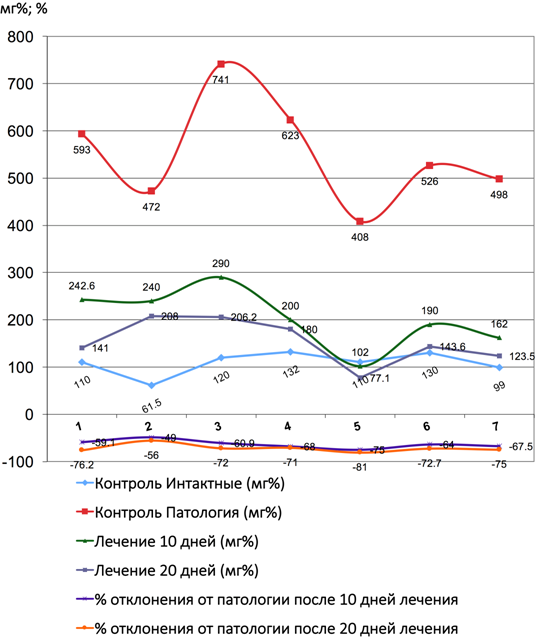
Рис. 8 – Показатели количества лактатдегидрогеназы и коэффициента отклонения от патологии до и после лечения Фитокомпозицией №1 + Phyto F при токсическом гепатите у кроликов. (1 - 7 порядковые номера животных)
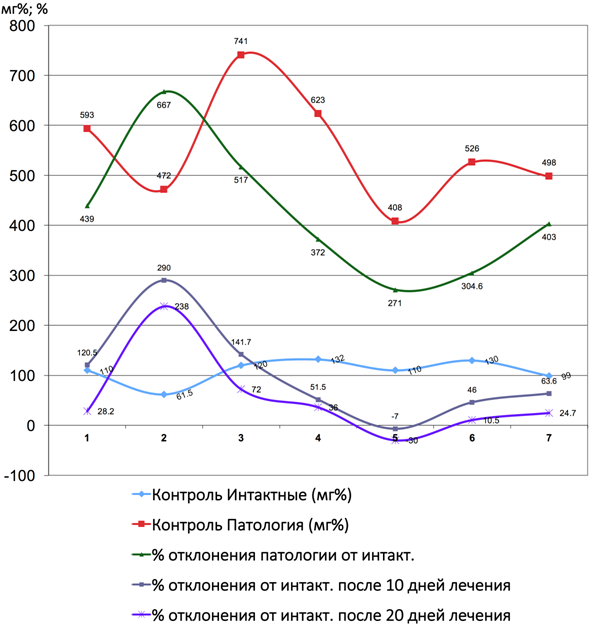
Рис. 9 – Показатели коэффициента отклонения лактатдегидрогеназы от интактных до и после лечения Фитокомпозицией № 1 + Phyto F при токсическом гепатите у кроликов. (1 - 7 порядковые номера животных)
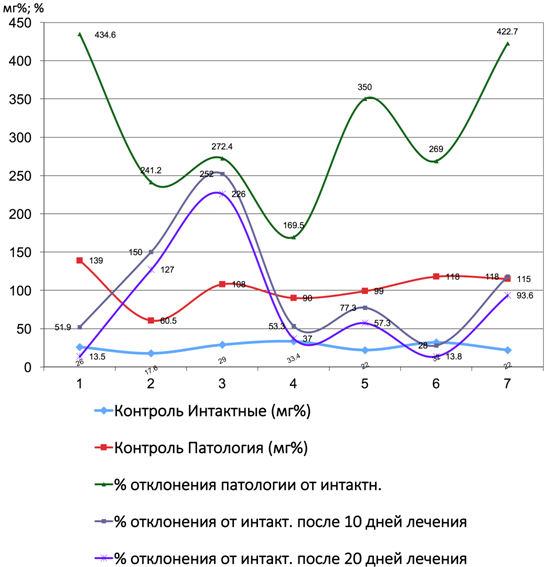
Рис. 10 – Показатели коэффициента отклонения аспартатаминотрансферазы от интактных до и после лечения Фитокомпозицией № 1 + Phyto F при токсическом гепатите у кроликов. (1 - 7 порядковые номера животных)
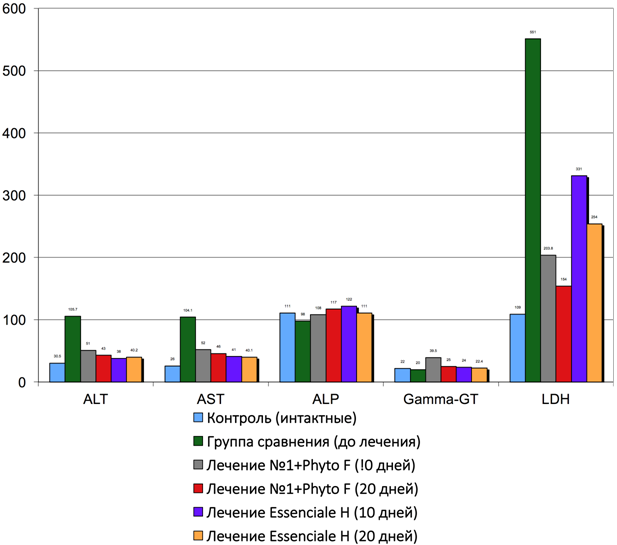
Рис. 11 – Изменение активности ферментов сыворотки крови под влиянием Фитокомпозиции Ph № 1+ Phyto F и Эссенциале Н при токсическом гепатите у кроликов (U/L)
Было установленно, что по спектру гепатопротекторного действия Ph №1+ Phyto F обладает гепатозащитным действием, и фармакологически высоко активна.
В группе сравнения у животных с моделью токсического гепатита через 10 дней отмечались во всех пробах признаками выраженной интоксикации (пассивное поведение, аппатия к еде, отвислые уши), а также повышение активности трансаминаз, подтвеждающих развитие синдрома цитолиза, что совпадает с результатами исследователей Тейибов Р. А. (1967) и Мязин Р. Г. и др. [7]. Проведенные исследования показали, что формирование токсического гепатита приводит к значительному увеличению активности как ALT так и AST относительно показателей у интактных животных в различные сроки наблюдения с максимально выраженными нарушенияи к 10-ым суткам наблюдения. Повышение активности трансаминаз в изучаемых условиях эксперимента свидетельствует о некротических изменениях в печени, сопровождающихся выходом ферментов в кровяное русло. Достаточно выраженное повышение активности AST вероятнее всего происходит за счёт высвобождения митхондриальной фракции AST, что свидетельствует о тяжести клеточного повреждения. У животных группы сравнения, наблюдаемых нами в течении последующих 20 дней, отмечалось значительное ухудшение состояния как визуально, так и со стороны биохимических показателей. Часть животныж (4), взятых в опыт погибли на 17 день. У всех животных после курса лечения наблюдались достоверные (таб. № 1) положительные результаты по нормализации процессов активности ферментов печени. Цитолиз уменьшался и у животных отмечалась редукция ряда проявлений: повышение двигательной активности, улучшение аппетита, отвисшие уши в группе сравнения, приняли нормальное положение в опытных сериях. Под действием Фитокомпозиции наблюдается выраженное обезвреживающая способность гепатоцитов печени (Рис. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10). В сравнительном аспнкте с ЭФН Ph№1+ Phyto F оказывает аналогическое фармакотерапевтическое действие . Однако, Ph№ 1+ Phyto F по некоторым показателям уступает ЭФН, а по некоторым - превосходит (таблица № 1).
В тоже время на фоне применения Ph № 1 + Phyto F уже к 10 суткам курса лечения в наших наблюдениях отмечается достоверное снижение активности ALT и AST в сравнении с показателями, зарегистрированными в этот же срок наблюдения у животных группы сравнения (рис. 1). К окончанию экперимента исследуемые показатели у группе животных, получавших лечение Ph № 1 + Phyto F и у группы животных, получавших широко применяемый в медицинской практике препарат Эссенсиале форте Н, имели сравнительные, достверные показатели. Так по паказателям ALP, превосходит, по - γ- GT уступает, по- ALT, LDH, AST аналогичные показатели. Применение Ph № 1 + Phyto F предупреждает формирование гиперферметенемии практически с полным восстановлением изучаемых показателей к 20-му дню наблюдения. Результаты статистической отчетности представлены в таблице № 1.
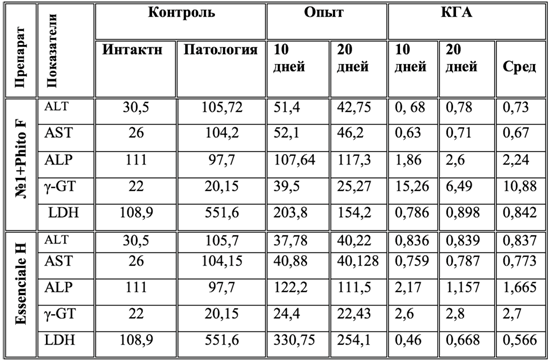
Таблица 1 – Изменение активности ферментов сыворотки крови под влиянием Фитокомпозиции № 1+Phyto F и Essenciale H при токсическом гепатите у кроликов (U/L)
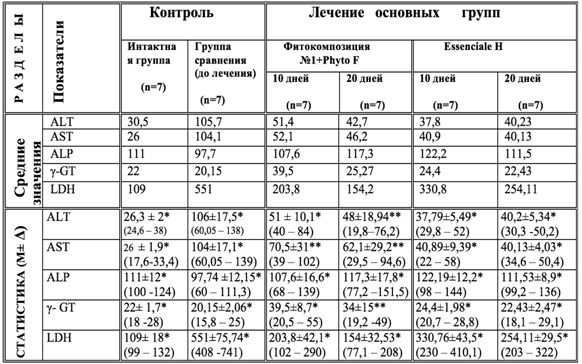
Примечания к разделу “СТАТИСТИКА (M±Δ)”
- В первой строке указаны доверительные интервалы (M±Δ) по критерию Стьюдента. (* - с вероятностью p<0,01; ** - с вероятностью p<0,05).
- Во втрой строке указаны минимальное и максимальное значения параметра.
Далее определён коэффициент гепатопротекторной активности (КГА). Результаты пркдставленны в таблице № 2
Таблица 2 – Гепатопротекторная активность препаратов КГА = (K-O)/K-И) при токсическом гепатите у кроликов (U/L)
Спектрофотометрическими исследованиями качественного состава Ph № 1 + Phyto F, установлено совпадение максимумов поглащения рабочего и стандартного растворов (ЭФН), что свидетельствует о возможном наличии в испытуемой Сумме экстрактов Ph № 1 + Phyto F эссенциальных фосфолипидов (Рис. 12 и 13):
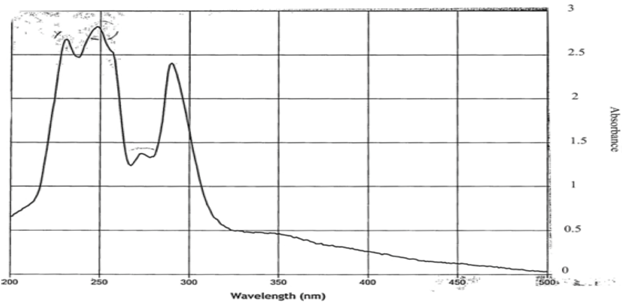
Рис. 12 – Спектрофотометрический анализ качественного состава препарата Эссенциале форте Н (1 : 5)
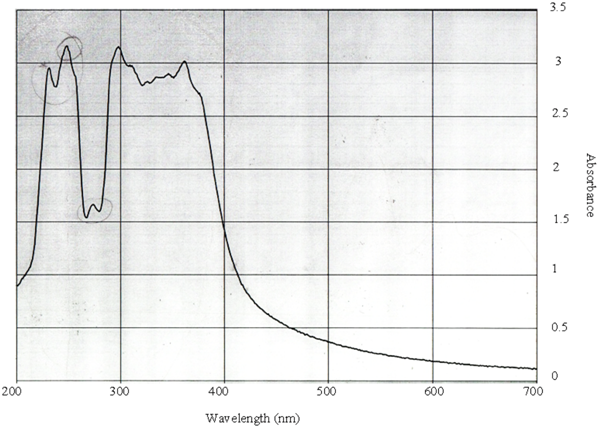
Рис. 13 – Спектрофотометрический анализ качественного состава препарата Суммы экстрактов Ph №1 + Phyto F (2 : 3)
Указанные положительные результаты изменяются в соответствии с продолжительностью курса лечения Ph №1 + Phyto F, которая активна в отношении нормализации метаболизма белка гепатоцитами, наблюдаемые нами ранее [30], а именно, церулоплазмина, входящего в состав γ 2- глобулиновой фракции, как одного из главных компонентов антиоксидантной защиты и адаптации организма к стрессовым факторам.
Во всех сериях результаты положительной динамики наблюдались также за счёт антитоксического, антиоксидантного, холеретичекого и, возможно, антирадикального действий, наблюдаемого нами в предыдущих исследованиях [17]. Ph №1 + Phyt F также активна в отношении гипоксии антиоксидантного стресса при токсическом гепатите.
Эффекты гепатопротекторной функии Ph № 1 + Phyto F практически идентичны по многим показателям сравнительной серии опытов с ЭФН.
Список литературы / References
- Ахметченко З. А., Муфазалова Н. А., Муфазалова Л. Ф., и др. Эффективность тактивина и токоферола для коррекции гептотоксического действия аминной соли 2,4 – дихлорфеноксиуксусной кислоты. // Казанский медицинский журнал.- 2013. Выпуск 5.- С.651-655.
- Бабак О. Я. Первый клинический опыт применения эссенциале Н на Украине // Consilium Medicum. - 2001. - Экстравыпуск. – С. 11 - 14.
- Гордиенко А. Д. Гепатозащитное действие липофена – нового комбинированного фосфолипидного препарата природного происхождения. // Экспериментальная и клиническая фармакология. - 2001. – Т. 64. - №3. – С. 45 - 47.
- ГФ Российской Федерации, XII издание, часть I. М., - 2007, - С.
- Западнюк И. П., Западнюк В. И., Захария Е. А., Западнюк Б. В. Лабораторные животные. Разведение, содержание, использование в эксперименте.// Киев.- Головное издательство издательского объединения «Вища школа». - 1983.- С. 195 - 223.
- Ивашкин В.Т. Комбинированное лечение хронического гепатита В. // Российский журнал гастроэнтерологии, гепатологии, колопрактологии -1998. - № 5.- стр. 57 - 60.
- Мязин Р.Г., Емельянов Д.Н., Снигур Г.Л., и др. Изучение динамики печеночных проб в эксперименте при моделировании острого токсического гепатита у крыс. // «Гастроэнтерология Санкт – Петербурга».- Санкт – Петербург.- 2013. - №2 – 69 стр .- М 22.
- Ушакова Е. А. Место эссенциальных фосфолипидов в современной медицине // Фарматека. – 2003. - №10. – С. 40 - 47.
- Яковенко Э. П., Григорьев П. Я. Гептрал в лечении внутрипеченочного холестаза // Российский журнал гастроэнтерологии, гепатологии, колопрактологии. – 2002. – Т.12. - №1. - С. – 84 - 87.
- 10. Гасанова Д.А., Ганиева Р.А., Мехралиева С. Д. Изучение токсичности, некоторых растений, входящих в состав Фитокомпозиции. // Азербайджанский Фармацевтический и фармакотерапевтический журнал.- - № 1. - Баку. -с.– 38 - 40
- Гасанова Д. А. Определение токсичности растений , произрастающих в Азербайджане. // Азербайджанский Фармацевтический и фармакотерапевтический журнал.-2013.- № 2. - Баку. - с. – 7 - 10
- Владимиров Ю.А. Свободные радикалы и антиоксиданты. // Вестник РАМН. 1998. - №8.- С. 43 - 51.
- Гульман Л. А., Кришвиц Т. С. , Мартынова Г. П. Мобилизация катехоламинов и обмен индолилалкламинов при вирусном гепатите А у детей. // Биологическая роль и обмен моноаминов и циклонуклеотидов.
- Звягинцева Т. Д. Лечение хронических диффузных заболеваний печени: какие возможности открывает перед нами применение гепатопротекторов. // Здоровье Украины. – 2009. - №12/1. – С. 32 - 33.
- Меерсон Ф. З. Общий механизм адаптации и роль в нем стресс- реакциц, основные стадии процесса. // Физиология адаптационных процессов. М., 1986. – С. 77 - 123 Красноярск, 1983. – С. 110 - 114.
- Губский Ю. И. Коррекция химического поражения печени // «Здоров*я».- Киев. - 1989. - 168 с.
- Dadashova S., Hasanova D., Kurbanova I.and all. Antioxidant and free radical scavenging activities of plant compounds.// Journal of BIOTECHNOLOGY.- Volum 161. - Supplement . - November. - 2012. – Eurobiotech.
- Hoffman La Roche LTD. Швейцария; Schering Plough США.- “О контроле качества лекарств”. - от – 31/12 – 2008.
- Roti E., Minelly R. et al. Multiple changes in thyroid function in patients with chronic active HCV – hepatits treated with recombinant interferon – alpha. // The American Journal of Medicine - 1996. - November. Vol. 101. - p. 482 - 487.
- Sherlock S., Dooley J. Diseases of the liver and biliary system. //London: Black well. 2002. pp 706. - Agriculture Symposium.
- Shedlofsky S. İ., Bonkoüsky H. L., Sinclair P. R. et. al. İron loading of cultured hepatocytes: Effect of iron on 5-fvinolaevulinate synthase is independent of lipid peroxsidation //Biochem. J. -1983. - Vol 212, № 2. - P. 32 - 330
- Allen C. M., Hockin L. J., Paine A. J. The control of glutathione and cytochrome P - 450 concentrations of primary cultures of rat hepatocytes //Biochem. Pharmacol. - 1981. - Vol. 30, N 19. - P. 2739 - 2742
- Скакун Н. П., Шманько В. В., Охримович Н. М.- Тернополь: Збруч, - 1995. – 270 с.
- Дектярова И. И., Козачек Н. Н., Лоховский О. И. Эффективность применения холивера при заболеваниях гепатобилиарной системы. // Сучасна гастроэнтерология.- 2003. - №3 (13). – С. 80 - 86.
- Arivzhagan P., Juliet P., Panneerselvam C. Effect of DL alpha li-poic acid on the status of lipid pero[idation and antioxidants in aged rats//Pharmacol/ Res/ 2000/ - Mar. 41 (3). – p. 299 - 303.
- Etimof O. E. Hepatotoc[icity of carbon tetrachloride protective effect of Gongronema latifolium. //Pakistan jornal of pharmaceutical sciences. 2008. – vol 21. - issue № 3. P. 268 - 274.
- Hayashi P. H. Causality assessment in drug-induced liver injury // Seminars in Liver Disease. 2009. - vol. № 4. - p. 348- 356.
- Nose H., Terawaki K., Oguri K., et al. Activatin of macrophages by crude polysaccharide fractions obtained from shoots of Glycyrrhiza glabra and hairy roots of Glycyrrhiza uralensis I vitro. // Biol. Pharm. Bull .- 1998. - vol. 21, №10. - p. 1110 – 1112.
- Zhang B. J. Protection by and anti- oxidant mechanism of berberine against rat liver fibrosis induced by multiple hepatotoxic factors. // Clinical and experimental pharmacology and physiology. 2008. Vol. 35 issue 3. - p. 303-309
- Hasanova D. A., Gasanova Z. Z. The role of ceruloplazminin the γ2 – globulin fraction of protein metabolism in the liver induced by carbon tetrachloride and its correction dy Phytocomposition №1+Phyto F// İnternational Reserch Jornal. 2016. - Vol. - № 8 (50). - P. 147 - 153.
Список литературы на английском языке / References in English
- Akhmetchenko Z. A., Mufazalova N. A., Mufazalova L. F., i dr. Effektivnost taktivina i tokoferola dlia korrektsii geptotoksicheskogo deistviia aminnoi soli 2,4 – dihlorfenoksiuksusnoi kisloty [Akhmetchenko ZA, Moufazalova NA, Mufazalova LF, et al. Efficiency of Tactivin and Tocopherol for Correction of the Heptotoxic Effect of the Amine Salt of 2,4-Dichlorophenoxyacetic Acid].// Kazan Medical Journal.- 2013. Issue 5.- P.651-655.
- Babak O. Ya. Pervyi klinicheskii opyt primeneniia essenciale N v Ukraine [First Clinical Experience of Applying Essentiale N in Ukraine] // Consilium Medicum. - 2001. - Ekstravypusk. – P. 11 - 14.
- Gordienko A. D. Gepatozashhitnoe deistvie lipofena – novogo kombinirovannogo fosfolipidnogo preparata prirodnogo proishozhdenija [Gepatoprotective Effect of Lipofen - New Combined Phospholipid Preparation of Natural Origin]. // Experimental and Clinical Pharmaceutics. - 2001. – V. 64. – No.3. – P. 45 - 47.
- GF Rossijskoj Federacii [GF of the Russian Federation] XII edition, Part I. M., - 2007, - S.
- Zapadniuk I. P., Zapadniuk V. I., Zahariia E. A., Zapadniuk B. V. Laboratornye zhivotnye. Razvedenie, soderzhanie, ispolzovanie v eksperimente [Laboratory Animals. Breeding, Keeping, Use in Experiment] // Kyiv.- Head Publishing House of the Publishing Association “Vishcha shkola.” - 1983.- P. 195 - 223.
- Ivashkin V.T. Kombinirovannoe lechenie hronicheskogo gepatita V. [Combined Treatment of Chronic Hepatitis B] // Russian Journal of Gastroenterology, Hepatology, Colopractology -1998. – No. 5.- P. 57 - 60.
- Miazin R.G., Emelianov D.N., Snigur G.L., i dr. Izuchenie dinamiki pechenochnyh prob v eksperimente pri modelirovanii ostrogo toksicheskogo gepatita u krys [Study of the Dynamics of Hepatic Samples in an Experiment Aimed at Modeling Acute Toxic Hepatitis of Rats]. // “Gastroenterology of St. Petersburg.” - St. Petersburg. - 2013. - No. 2 - 69 p. - M 22.
- Ushakova E. A. Mesto essencialnykh fosfolipidov v sovremennoj medicine [Place of Essential Phospholipids in Modern Medicine] // Farmateka. – 2003. – No.10. – P. 40 - 47.
- Yakovenko Ye. P., Grigoriev P. Ja. Geptral v lechenii vnutripechenochnogo holestaza [Heptral in the Treatment of Intrahepatic Cholestasis] // Russian Journal of Gastroenterology, Hepatology, Colorectology. - 2002. - V.12. – No 1. - P. - 84 - 87.
- 10. Gasanova D.A., Ganieva R.A., Mehralieva S. D. Izuchenie toksichnosti, nekotorykh rastenii, vkhodiashhikh v sostav Fitokompozitsii [Study of Toxicity, of Certain Plants that Make up Phytocompositions]. // Azerbaijan Pharmaceutical and Pharmacotherapeutic Journal. 2015. - No. 1. - Baku. - p. - 38 – 40
- Gasanova D. A. Opredelenie toksichnosti rastenii, proizrastajushchikh v Azerbajdzhane [Determination of the Toxicity of Plants Growing in Azerbaijan]. // Azerbaijan Pharmaceutical and Pharmacotherapeutic Journal.-2013.- No. 2. - Baku. - p. - 7 - 10
- Vladimirov Yu.A. Svobodnye radikaly i antioksidanty [Free Radicals and Antioxidants] // Bulletin of the Russian Academy of Medical Sciences. 1998. - No.8.- P. 43 - 51.
- Gulman L. A., Krishvic T. S. , Martynova G. P. Mobilizacija kateholaminov i obmen indolilalklaminov pri virusnom gepatite A u detej [Mobilization of Catecholamines and Exchange of Indolylalclamines in Viral Hepatitis A of Children] // Biological Role and Exchange of Monoamines and Cyclone Nucleotides.
- Zviaginceva T. D. Lechenie hronicheskih diffuznykh zabolevanii pecheni: kakie vozmozhnosti otkryvaet pered nami primenenie gepatoprotektorov [Treatment of Chronic Diffuse Liver Diseases: What Opportunities are Opened for us by the Use of Hepatoprotectors] // Zdorovie Urkainy. – 2009. - No.12/1. – P. 32 - 33.
- Meerson F. Z. Obshhii mekhanizm adaptacii i rol v nem stress-reakcii, osnovnye stadii processa [General Mechanism of Adaptation and the Role of Stress Reactions in it, Main Stages of the Process] // Physiology of Adaptation Processes. M., 1986. - P. 77 - 123 Krasnoyarsk, 1983. - P. 110 - 114.
- Gubskij Yu. I. Korrektsiya himicheskogo porazheniya pecheni [Correction of Chemical Damage of the Liver] // “Zdoroviya.”- Kyiv. - 1989. - 168 p.
- Dadashova S., Gasanova D., Kurbanova I.and all. Antioxidant and Free Radical Scavenging Activities of Plant Compounds.// Journal of BIOTECHNOLOGY. - Volume 161. - Supplement . - November. - 2012. – Eurobiotech.
- Hoffman La Roche LTD. Switzerland; Schering Plough США.- “ On Quality Control of Medicines ”. - of – 31/12 – 2008.
- Roti E., Minelly R. et al. Multiple Changes in Thyroid Function of Patients with Chronic Active HCV – Hepatits Treated with Recombinant Interferon – Alpha. // The American Journal of Medicine - 1996. - November. Vol. 101. - p. 482 - 487.
- Sherlock S., Dooley J. Diseases of the Liver and Biliary System. //London: Black Well. 2002. p.706. - Agriculture Symposium.
- Shedlofsky S. I., Bonkoüsky H. L., Sinclair P. R. et. al. Iron Loading of Cultured Hepatocytes: Effect of Iron on 5-fvinolaevulinate Synthase is Independent of Lipid Peroxsidation //Biochem. J. -1983. - Vol 212, No. 2. - P. 32 - 330
- Allen C. M., Hockin L. J., Paine A. J. Control of Glutathione and Cytochrome P - 450 Concentrations of Primary Cultures of Rat Hepatocytes //Biochem. Pharmacol. - 1981. - Vol. 30, N 19. - P. 2739 - 2742
- Skakun N.P., Shmanko V.V., Okhrimovich N.M.- Ternopil: Zbruch, - 1995. – 270 p.
- Dektiarova I. I., Kozachek N. N., Lokhovskii O. I. Effektivnost primeneniia holivera pri zabolevaniiakh gepatobiliarnoi sistemy [Effectiveness of Holiver in Diseases of the Hepatobiliary System] // Modern Gastroenterology. - 2003. - No.3 (13). – P. 80 - 86.
- Arivzhagan P., Juliet P., Panneerselvam C. Effect of DL Alpha Lipoic Acid on the Atatus of Lipid Peroidation and Antioxidants of Aged Rats//Pharmacol/ Res/ 2000/ - Mar. 41 (3). – p. 299 - 303.
- Etimof O. E. Hepatotocicity of Carbon Tetrachloride Protective Effect of Gongronema Latifolium. //Pakistan Journal of Pharmaceutical Sciences. 2008. – Vol. 21. - Issue No. 3. P. 268 - 274.
- Hayashi P. H. Causality Assessment in Case of Drug-Induced Liver Injury// Seminars in Liver Disease. 2009. - Vol. No. 4. - p. 348- 356.
- Nose H., Terawaki K., Oguri K., et al. Activatin of Macrophages by Crude Polysaccharide Fractions Obtained from Shoots of Glycyrrhiza Glabra and Hairy Roots of Glycyrrhiza Uralensis I Vitro. // Biol. Pharm. Bull. - 1998. - Vol. 21, No.10. - p. 1110 - 1112.
- Zhang B. J. Protection by and Antioxidant Mechanism of Berberine against Rat Liver Fibrosis Induced by Multiple Hepatotoxic Factors. // Clinical and Experimental Pharmacology and Physiology. 2008. Vol. 35 issue 3. - p. 303-309
- Gasanova D. A., Gasanova Z. Z. Role of Ceruloplazminin the γ2 – Globulin Fraction of Protein Metabolism in the Liver Induced by Carbon Tetrachloride and its Correction dy Phytocomposition No.1+Phyto F // International Reserch Journal. 2016. - Vol. - No. 8 (50). - P. 147 - 153.
