PRP-ТЕРАПИЯ ЯИЧНИКОВ: МОЛЕКУЛЯРНЫЕ АСПЕКТЫ
DOI: https://doi.org/10.23670/IRJ.2022.118.4.081
PRP-ТЕРАПИЯ ЯИЧНИКОВ: МОЛЕКУЛЯРНЫЕ АСПЕКТЫ
Обзорная статья
Громенко Д.Д.1, *, Надеждина Е.А.2, Громенко И.Д.3, Бердигулова Э.Ф.4, Янбарисова А.Р.5, ГалимовШ.Н.6
1 ORCID:0000-0001-5638-1779;
2 ORCID: 0000-0002-8129-0665;
3 ORCID: 0000-0001-8582-660X;
4 ORCID: 0000-0002-5111-0256;
5 ORCID: 0000-0003-3799-4080;
6 ORCID: 0000-0002-5871-515X;
1, 2, 3, 4, 5, 6Башкирский государственный медицинский университет, Уфа, Россия
* Корреспондирующий автор (dasha.gromenko[at]mail.ru)
Аннотация
Бесплодие – заболевание, характеризующееся невозможностью достичь клинической беременности после 12 месяцев регулярной половой жизни без контрацепции вследствие нарушения способности субъекта к репродукции. В последние годы увеличилась частота встречаемости этого диагноза по причине преждевременной недостаточности яичников, а низкий овариальный резерв совместно с «бедным» ответом яичников на стимуляцию остаются основными факторами бесплодия у женщин старшего репродуктивного возраста. Применение вспомогательных репродуктивных технологий у данных пациенток ассоциировано с низкой частотой наступления беременности. Обогащенная тромбоцитами плазма (PRP), содержащая различные факторы роста, усиливающие регенерацию, ангиогенез и процесс пролиферации клеток, представляет собой интерес как метод преодоления бесплодия при вышеупомянутых состояниях.
Ключевые слова: PRP-терапия, обогащенная тромбоцитами плазма, преждевременная недостаточность яичников, овариальный резерв.
OVARIAN PRP THERAPY: MOLECULAR ASPECTS
Review article
Gromenko D.D.1, *, Nadezhdina E.A.2, Gromenko I.D.3, Berdigulova E.F.4, Yanbarisova A.R. 5, Galimov Sh.N.6
1 ORCID: 0000-0001-5638-1779;
2 ORCID: 0000-0002-8129-0665;
3 ORCID: 0000-0001-8582-660X;
4 ORCID: 0000-0002-5111-0256;
5 ORCID: 0000-0003-3799-4080;
6 ORCID: 0000-0002-5871-5151,
1, 2, 3, 4, 5, 6Bashkir State Medical University, Ufa, Russia
* Corresponding author (dasha.gromenko[at]mail.ru)
Abstract
Infertility is a disease characterized by the inability to achieve clinical pregnancy after 12 months of regular sexual activity without contraception due to the subject's hindered ability to reproduce. In recent years, the frequency of this diagnosis has increased due to premature ovarian insufficiency, and low ovarian reserve, together with a "poor" ovarian response to stimulation, remain the main factors of infertility in older women of reproductive age. The use of assisted reproductive technologies in these patients is associated with a low frequency of pregnancy. Platelet-rich plasma (PRP), which contains various growth factors that enhance regeneration, angiogenesis, and cell proliferation, is of interest as a method of overcoming infertility in the above-mentioned conditions.
Keywords: PRP therapy, platelet-rich plasma, premature ovarian insufficiency, ovarian reserve.
Введение
Бесплодие – одна из самых актуальных проблем человечества на сегодняшний день. В России частота бесплодия колеблется от 17,2% до 24% в различных регионах [1]. Несмотря на наличие вспомогательных репродуктивных технологий (ВРТ), эти методы имеют весьма ограниченное применение у 2-х групп пациентов - с низким овариальным резервом и с «бедным» ответом яичников на гормональную стимуляцию.
К первой группе относятся женщины с преждевременной недостаточностью яичников (состояние, характеризующееся снижением функции яичников в возрасте до 40 лет, за последние несколько десятилетий его частота выросла с 1% до почти 2%); и женщины позднего репродуктивного возраста, у которых снижение овариального резерва сочетается с низким качеством ооцитов [2], [3]. Следует отметить, что в последнее время произошло значительное увеличение среднего возраста первородящих матерей, который колеблется между третьим и четвертым десятилетием [4], [5], и в связи с этим доля женщин позднего репродуктивного возраста среди пациентов репродуктологов также возросла.
Женщины с «бедным» ответом яичников на стимуляцию представляют собой вторую основную группу пациентов. К ним относятся около 20% пациенток, у которых после индукции суперовуляции с дозировкой не менее 150 МЕ ФСГ в день в ходе экстракорпорального оплодотворения (ЭКО), было получено менее 4 ооцитов или произошла отмена цикла (после развития менее трех растущих фолликулов) [6], [7].
На сегодняшний день существуют варианты преодоления данного вида бесплодия при помощи программы донорства ооцитов или усыновления. Тем не менее, стремление женщин иметь здоровое генетически родственное потомство заставляет ученых исследовать подходы к восстановлению функции яичников у таких пациенток.
Появление аутологичной внутрияичниковой инъекции обогащенной тромбоцитами плазмы (PRP) отражает прорывной подход, демонстрирующий многообещающие результаты. Применение PRP и её эффективность были продемонстрированы в контексте регенеративной медицины [8], [9], с весьма многообещающими результатами.
PRP - плазма, полученная из периферической крови пациентки, состоит из большого количества тромбоцитов (около 1000000 тромбоцитов/мкл в 5 мл плазмы) [10], [11].Альфа-гранулы активированных тромбоцитов обеспечивают и высвобождают сверхфизиологическое количество факторов роста и цитокинов, которые способствуют пролиферации и дифференциации клеток, хемотаксису и ангиогенезу, тем самым оптимизируя процесс регенерации. В яичнике PRP и содержащиеся в нем факторы роста стимулируют васкуляризацию и привлечение имеющихся примордиальных фолликулов, которые уже не могут быть стимулированы иным способом [12].
В ряде исследований было продемонстрировано, что интраовариальная инъекция PRP способствовала росту фолликулов и улучшила результаты лечения у бесплодных женщин с плохим прогнозом, что привело к нескольким случаям рождения детей в доношенном сроке безосложнений [13]. Вместе с тем, несмотря на большой интерес специалистов различного профиля, в литературе отсутствуют обзорные работы с анализом теоретических и практических аспектов использования PRP в репродуктивной медицине.
Данная статья посвящена изучению молекулярных механизмов восстановления функции яичников после интраовариальной инъекции PRP в отношении пациенток с низким овариальным резервом и «бедным» ответом яичников на стимуляцию.
Основная часть
PRP-терапия – это метод, направленный на восстановление функции яичников. В ходе этого метода периферическая кровь подвергается 1 или нескольким циклам центрифугирования с/без последующей активацией тромбоцитов [14].Среди важнейших биологически активных веществ, высвобождаемых тромбоцитарными гранулами, влияние на ткань яичника оказывают:
- Тромбоцитарный фактор роста (PDGF)
- Трансформирующий фактор роста β (TGF-β, в т. ч. фактор дифференцировки роста GDF-9)
- Сосудистый эндотелиальный фактор роста (VEGF)
- Инсулиноподобный фактор роста-1 (IGF-1)
- Фактор роста фибробластов bFGF
- Фактор роста гепатоцитов (HGF)
Важно отметить, что механизмы оказания воздействия на яичники у этих веществ различны (Таблица 1).
Таблица 1 – Вещества тромбоцитарного происхождения, обладающие активностью в отношении яичников
| Биологически активное вещество тромбоцитарного происхождения | Оказываемые эффекты |
| PDGF | •Усиление синтеза ДНК в фолликулах •Усиление перифолликулярного кровотока через a.ovarica •Репарация соединительной ткани |
| Трансформирующий фактор роста β (TGF-β, в т.ч. фактор дифференцировки роста GDF-9) | •Участие в регуляции перехода от примордиального фолликула к первичному и стимуляции экспрессии рецепторов ФСГ в яичниках •Регуляция апоптотических механизмов фолликулов •Регуляция ангиогенеза с VEGF •Осуществление взаимодействия между текальными, гранулезными клетками и ооцитом во время фолликулогенеза и созревания •Репарация соединительной ткани совместно с PDGF |
| Сосудистый эндотелиальный фактор роста (VEGF) | •Усиление ангиогенеза •Подавление повреждений, вызванных окислительным стрессом •Стимуляция активации фолликулов •Ингибирование апоптоза гранулезных клеток яичников |
| Инсулиноподобный фактор роста-1 (IGF-1) | •IGF-I совместно с IGF-II стимулируют рост вторичных фолликулов. |
| Фактор роста фибробластов (bFGF) | •Активация ангиогенных процессов •Усиливает действие VEGFR2 •Усиление пролиферации и развития фолликулов •Усиление пролиферации гранулезы и клеток стромы яичников |
| Фактор роста гепатоцитов (HGF) | •Поддержка фолликулогенеза путем регуляции клеток гранулезы •Подавление апоптоза в клетках гранулезы •Индукция фолликулогенеза |
Окончание таблицы 1 – Вещества тромбоцитарного происхождения, обладающие активностью в отношении яичников
| Биологически активное вещество тромбоцитарного происхождения | Оказываемые эффекты |
| Эпидермальный фактор роста (EGF) | •Увеличение размера фолликула за счет стимулирования роста ооцитов |
| Интерлейкин-8 (IL-8) | •Участие в нейтрофильной, гранулоцитарной инфильтрации теки и гранулезо-лютеинового слоя. •Ассоциируется с более высокими показателями беременности и качества эмбрионов |
| Интерлейкин-1b (IL-1b) | •Улучшение перифолликулярного кровотока, привлечения макрофагов/Т-клеток в фолликул |
Условно по механизму действия факторы тромбоцитов подразделяются на:
- Регуляторы митотической активности: фибронектин (Fn), витронектин (Vn), PDGF, IGF, bFGF, EGF, HGF, TGF-β;
- Регуляторы ангиогенеза и перифолликулярного кровотока:TGF-β, VEGF (в т.ч. VEGF-А), bFGF, IL-1b, PDGF
- Регуляторы хемотаксической функции, способствующие гранулоцитарной инфильтрации теки: TGF-β, IL-8, IL-1b
Регуляторы митотической активности
Тромбоцитарный фактор роста (PDGF) является одним из важнейших факторов, регулирующих рост и деление клеток. В частности, PDGF играет ключевую роль в росте кровеносных сосудов и усилении митотической активности фолликулов. Свое воздействие данный фактор оказывает аутокринно и паракринно, влияя на клетки теки и гранулезы.
Вклад тромбоцитарного фактора роста в стимуляцию яичников был выявлен опытным путем. Доказано, что при ингибировании PDGF у мышей фолликулы подвергаются атрезии из-за дисбаланса в соотношении антиапоптотических и проапоптотических белков, а также происходит уменьшение диаметра a. ovarica [15].
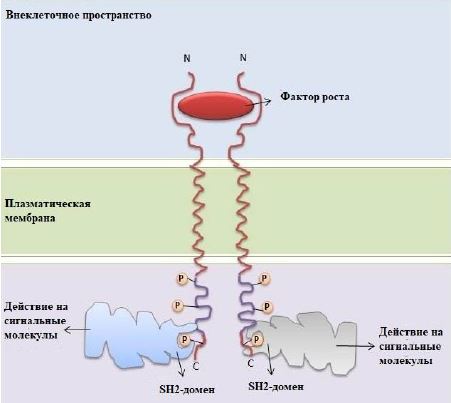
На данный момент выделяют четыре полипептидные цепи PDGF, которые образуют пять димерных PDGF-изоформ: PDGF-AA, -AB, -BB, -CC и -DD [16]. В случае PRP-терапии, мы искусственно активируем тромбоциты и вызываем выброс тромбоцитарного факторов роста, в организме же его выработка зависит от взаимодействия с рецептором (рисунок 1). Индуцированная лигандом димеризация рецептора вызывает его аутофосфорилирование, после чего активация внутриклеточных сигнальных путей осуществляется благодаря присоединению SH2-домен-содержащих сигнальных молекул к определенным фосфорилированным остаткам тирозина [17].
Рис. 1 – Активация рецептора фактора роста [17]
Потенцированию митогенной активности тромбоцитарного фактора роста способствуют фибронектин и витронектин. Клеточное взаимодействие фибронектина опосредуется интегринами [18]. Таким образом, предполагается, что для достижения оптимальной репаративной стимуляции PDGF следует вводить вместе с фибронектином [19].
Регуляторы ангиогенеза и перифолликулярного кровотока
Многие исследования показывают, что случаи позднего репродуктивного возраста, преждевременной недостаточности яичников и «бедного» ответа на стимуляцию сопряжены со снижением овариального кровотока [20], [21], [22], [23], [24]. Этот дефицит васкуляризации может быть еще одним фактором, способствующим нарушению функциональности яичников [20], [21], [23], [24], поскольку таким образом прекращается поступление кислорода, питательных веществ и гормонов, и из-за этого нарушается рост фолликулов. Однако существуют свидетельства, что это состояние может быть обратимым [25], [26], [27].
На роль основного регулятора ангиогенеза претендует сосудистый эндотелиальный фактор роста А (VEGF-A), концентрация которого находится в прямой зависимости от инсулиноподобного фактора роста 1 (IGF-1), гормона роста (GH), гонадотропинов, фактора роста фибробластов 2 (FGF-2), тромбоспондина (THSP-1), интерлейкина 1b (IL-1b), TGF-β1.VEGF также необходим для поддержания сосудистой функции и структуры во время нормальной лютеиновой фазы. Ингибирование VEGF в середине лютеиновой фазы приводит к снижению секреции прогестерона и гибели эндотелиальных клеток [28].
В литературе отмечено, что IL-1b способствует нормализации перифолликулярного кровотока. Приводятся сведения о возрастании уровня мРНК, экспрессирующей цитокин IL-1b, по мере приближения к овуляции. У людей уровень мРНК IL-1b увеличивается в макрофагах фолликулярной жидкости и гранулезных клетках по мере того, как фолликул приближается к разрыву [29].
Регуляторы хемотаксической функции, способствующие гранулоцитарной инфильтрации теки
IL-8 является одним из действующих компонентов PRP-терапии. В физиологических условиях уровни IL-8 являются наиболее высокими в клетках теки в позднефолликулярном и раннеовуляторном периодах, ближе к овуляции. Количество тека-нейтрофилов увеличивается с ростом концентрации IL-8, что согласуется с предполагаемой хемотаксической ролью этого цитокина в привлечении Т-клеток, нейтрофилов, гранулоцитов [30].
Одним из потенциальных тромбоцитарных хемоаттрактантов является трансформирующий фактор роста β (TGF-β). Предполагают, что TGF-β может быть вовлечен в сигнальные пути, связанные с пролиферацией, дифференцировкой предшественников и клеток фибробластического ряда с последующей репарацией ткани и восстановлением функции [31].
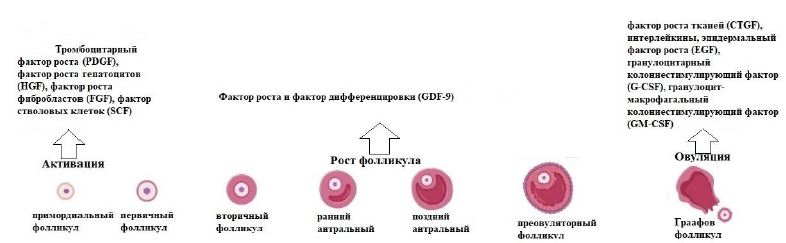
В этой статье мы условно разделили функции тромбоцитарных факторов роста, однако следует подчеркнуть, что многие из этих веществ не ограничены одной ролью и, кроме того, в процессе фолликулогенеза этапность воздействия этих молекул также отличается (рисунок 2).
На ранней стадии фолликулогенеза активация примордиального фолликула стимулируется тромбоцитарным фактором роста (PDGF), фактором роста гепатоцитов (HGF), фактором роста фибробластов (FGF) и фактором стволовых клеток (SCF). Со стадии первичного фолликула до антрального рост сопровождают факторы роста и дифференцировки (GDF-9). Ключевое влияние на овуляцию и созревание фолликулов на поздних стадиях имеют следующие биологически активные вещества: фактор роста соединительной ткани (CTGF), интерлейкины, эпидермальный фактор роста (EGF), гранулоцитарный колониестимулирующий фактор (G-CSF) и гранулоцит-макрофагальный колониестимулирующий фактор (GM-CSF) [32].
Рис. 2 – Вклад тромбоцитарных факторов роста в фолликулогенез на различных стадиях [32]
Заключение
Современные исследования указывают на преимущества внедрения технологии внутрияичниковой инъекции PRP плазмы для пациенток с низким овариальным резервом и «бедным» ответом яичников. Изучение влияния PRP на яичник на молекулярном уровне продемонстрировало три ключевых механизма действия: ряд тромбоцитарных факторов, действуя на разных этапах фолликулогенеза, регулируют митотическую активность (PDGF, IGF, Fn, Vn, bFGF, EGF, HGF, TGF-β;), в то время как другие группы способствуют васкуляризации и улучшению качества перифолликулярного кровотока (TGF-β, VEGF, bFGF, IL-1b, PDGF) и хемотаксису к теке, что приводит к ее гранулоцитарной инфильтрации с развитием физиологического воспаления ткани (TGF-β, IL-8, IL-1b). Несмотря на многочисленные работы, молекулярные механизмы воздействия обогащенной тромбоцитами плазмы остаются не до конца изученными, что диктует необходимость продолжения исследований в этой области.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Российская Федерация. Клинические рекомендации. Клинические рекомендации - Женское бесплодие. 2021-2022-2023 [разработаны Российское общество акушеров-гинекологов. Утверждены Минздравом РФ 24.06.2021] – 7с.
- Lagergren K. The prevalence of primary ovarian insufficiency in Sweden: A national register study/ Lagergren K., Hammar M., Nedstrand E. // BMC Womens Health. – – Vol.18. – P. 175.
- Franasiak J.M. The nature of aneuploidy with increasing age of the female partner: a review of 15,169 consecutive trophectoderm biopsies evaluated with comprehensive chromosomal screening / Franasiak J.M., Forman E.J., Hong K.H. // Fertil Steril. –2014. –Vol.101 (3). – P. 656.
- Martin J.A. Births: Final Data for 2016./ Martin J.A., Hamilton B.E., Osterman M.J.K. // Natl. Vital Stat. Rep. – – Vol.67. – P. 1–55.
- Mathews T.J. Mean Age of Mothers is on the Rise: United States, 2000–2014. / Mathews T.J., Hamilton B.E. // NCHS Data Brief. – 2016. – Vol.232. – P.1–8.
- Vaiarelli A. What is new in the management of poor ovarian response in IVF? / Vaiarelli A., Cimadomo D., Ubaldi N. //Curr Opin Obstet Gynecol – – Vol.30. – P. 155–162.
- Ferraretti A.P. ESHRE working group on Poor Ovarian Response Definition. ESHRE consensus on the definition of 'poor response' to ovarian stimulation for in vitro fertilization: the Bologna criteria. / Ferraretti A.P., Marca A.L, Fauser B.C. // Hum Reprod. – – Vol.26(7). – P.1616.
- Borrione P. Platelet-rich plasma in muscle healing / Borrione P., Gianfrancesco A.D., Pereira M.T. // Am. J. Phys. Med. Rehabil. – – Vol.89:854– P.861.
- Alio J. The role of “eye platelet rich plasma” (E-PRP) for wound healing in ophthalmology / Alio J., Arnalich-Montiel F., E Rodriguez A. // Curr. Pharm. Biotechnol. – – Vol.13:1257 – P.1265.
- Sundman E.A. Growth factor and catabolic cytokine concentrations are influenced by the cellular composition of platelet-rich plasma / Sundman E.A.; Cole B.J.; Fortier L.A. // Am. J. Sports Med. – – Vol.39 – P.2135–2140.
- Marx R.E. Platelet-rich plasma (PRP): What is PRP and what is not PRP? / Marx R.E. // Implant. Dent. – – Vol. 10 – P.225–228.
- Ferrari A.R. Evaluation of the Effects of Platelet-Rich Plasma on Follicular and Endometrial Growth: A Literature Review. / Ferrari A. R., Cortrezzi S., Borges E. // JBRA assisted reproduction, – – Vol.25(4) – P.601–607.
- Sfakianoudis K. Reactivating Ovarian Function through Autologous Platelet-Rich Plasma Intraovarian Infusion: Pilot Data on Premature Ovarian Insufficiency, Perimenopausal, Menopausal, and Poor Responder Women/ Sfakianoudis K., Simopoulou M., Grigoriadis S. // Journal of clinical medicine, – – Vol.9(6) – P.1809.
- Dhurat R. Principles and Methods of Preparation of Platelet-Rich Plasma: A Review and Author's Perspective. / Dhurat R., Sukesh M. // J Cutan Aesthet Surg. – – Vol.7 – P.189–197.
- Parborell M.F. Inhibition of platelet-derived growth factor (PDGF) receptor affects follicular development and ovarian proliferation, apoptosis and angiogenesis in prepubertal eCG-treated rats. / Parborell M.F. // Mol.Cell Endocrinol – –Vol.412 – P.148–158.
- Aaronson S.A. Growth factors cancer. /Aaronson S.A.// Science. Nov. –– Vol.254(5035) – P.1146-53.
- Guo D. Vascular Endothelial Cell Growth Factor Promotes Tyrosine Phosphorylation of Mediators of Signal Transduction That Contain SH2 Domains. / Guo D., Jia Q., Song H.-Y. // Journal of Biological Chemistry, – – Vol.270(12) –P.6729–6733.
- Larivière B. Human plasma fibronectin potentiates the mitogenic activity of platelet-derived growth factor and complements its wound healing effects. / Larivière B., Rouleau M., Picard S. // Wound Repair Regen. – – Vol.11(1) – P.79-89.
- Lariviere B. Human plasma fibronectin potentiates the mitogenic activity of platelet-derived growth factor and complements its wound healing effects. / Lariviere B., Rouleau M., Picard S. // Wound Repair Regen – – Vol.11 – 79-89.
- Badawy A. Prediction and Diagnosis of Poor Ovarian Response: The Dilemma. /Badawy A., Wageah A., Gharib M. // J. Reprod. Infertil. – – Vol.12:241 – P.248.
- Broekmans F.J. Ovarian Aging: Mechanisms and Clinical Consequences. / Broekmans F.J., Soules M.R., Fauser B.C. // Endocr. Rev. – – Vol.30:465. – P.493.
- Fenton A.J. Premature ovarian insufficiency: Pathogenesis and management. / Fenton A.J.// J. Life Health. – – Vol.6. – P.147–153.
- Şükür Y.E. Ovarian aging and premature ovarian failure. J. Turk. / Şükür Y.E., Kıvançlı İ.B., Özmen B. // Ger. Gynecol. Assoc. – – Vol.15:190. – P.196.
- Younis J.S. Undetectable basal ovarian stromal blood flow in infertile women is related to low ovarian reserve. / Younis J.S., Haddad S., Matilsky M. // Gynecol. Endocrinol. Off. J. Int. Soc. Gynecol. Endocrinol. – – ; Vol.23:284. – P.289.
- Herraiz S. Autologous stem cell ovarian transplantation to increase reproductive potential in patients who are poor responders. / Herraiz S., Romeu M., Buigues A. // Fertil. Steril. – – Vol.110:496 – P.505.
- Ozcan P. The protective effect of platelet-rich plasma administrated on ovarian function in female rats with Cy-induced ovarian damage. / Ozcan P., Takmaz T., Tok O.E. // J. Assist. Reprod. Genet. – – Vol.37:865 – P.873.
- Sills E.S. Autologous activated platelet-rich plasma injection into adult human ovary tissue: Molecular mechanism, analysis, and discussion of reproductive response. / Sills E.S., Wood S.H. // Biosci.Rep. – – P.39.
- Duncan W.C. Inhibition of Vascular Endothelial Growth Factor in the Primate Ovary Up-Regulates Hypoxia-Inducible Factor-1 in the Follicle and Corpus Luteum. / Duncan W.C., Sander D., and Hamish M. // Endocrinology, – – Vol.149(7) –P.3313-20.
- Levitas E. Periovulatory and interleukin-1 beta-dependent up-regulation of intraovarian vascular endothelial growth factor (VEGF) in the rat: potential role for VEGF in the promotion of periovulatory angiogenesis and vascular permeability. /Levitas E., Chamoun D., Udoff L.C. // J Soc Gynecol Investig. – –Vol.7(1) – P.51-60.
- Szukiewicz D. Interleukin-8 may be involved in the ovarian mechanisms of follicle growth and ovulation. / Szukiewicz D., Pyzlak M., Klimkiewicz J. // Inflamm.res.56, –
- Gonçalves L.F. Effect of EDTA on TGF-β1 released from the dentin matrix and its influence on dental pulp stem cell migration. / Gonçalves L.F., Fernandes A.P., Cosme-Silva L. // Braz Oral Res. – – Vol.30:e131.
- Vo T.K.C. Ovarian Rejuvenation Using Autologous Platelet-Rich Plasma. / Vo T.K.C., Tanaka Y., Kawamura K. // Endocrines– – Vol.2– P.15-27.
Список литературы на английском языке / References in English*
- Russian Federation. Clinical recommendations. Clinical Recommendation - Jenskoe besplodie. 2021-2022-2023 [produced Russian Society of obstetrics and gynecology. Approved Ministry of healthcare of Russia 24.06.2021] – 7 p. [in Russian]
- Lagergren K. The prevalence of primary ovarian insufficiency in Sweden: A national register study/ Lagergren K., Hammar M., Nedstrand E. // BMC Womens Health. – – Vol.18. – P. 175.
- Franasiak J.M. The nature of aneuploidy with increasing age of the female partner: a review of 15,169 consecutive trophectoderm biopsies evaluated with comprehensive chromosomal screening / Franasiak J.M., Forman E.J., Hong K.H. // Fertil Steril. –2014. –Vol.101 (3). – P. 656.
- Martin J.A. Births: Final Data for 2016./ Martin J.A., Hamilton B.E., Osterman M.J.K. // Natl. Vital Stat. Rep. – – Vol.67. – P. 1–55.
- Mathews T.J. Mean Age of Mothers is on the Rise: United States, 2000–2014. / Mathews T.J., Hamilton B.E. // NCHS Data Brief. – 2016. – Vol.232. – P.1–8.
- Vaiarelli A. What is new in the management of poor ovarian response in IVF? / Vaiarelli A., Cimadomo D., Ubaldi N. //Curr Opin Obstet Gynecol – – Vol.30. – P. 155–162.
- Ferraretti A.P. ESHRE working group on Poor Ovarian Response Definition. ESHRE consensus on the definition of 'poor response' to ovarian stimulation for in vitro fertilization: the Bologna criteria. / Ferraretti A.P., Marca A.L, Fauser B.C. // Hum Reprod. – – Vol.26(7). – P.1616.
- Borrione P. Platelet-rich plasma in muscle healing./ Borrione P., Gianfrancesco A.D., Pereira M.T. // Am. J. Phys. Med. Rehabil. – – Vol.89:854– P.861.
- Alio J. The role of “eye platelet rich plasma” (E-PRP) for wound healing in ophthalmology / Alio J., Arnalich-Montiel F., E Rodriguez A. // Curr. Pharm. Biotechnol. – – Vol.13:1257 – P.1265.
- Sundman E.A. Growth factor and catabolic cytokine concentrations are influenced by the cellular composition of platelet-rich plasma./ Sundman E.A.; Cole B.J.; Fortier L.A. // Am. J. Sports Med. – – Vol.39 – P.2135–2140.
- Marx R.E. Platelet-rich plasma (PRP): What is PRP and what is not PRP? / Marx R.E. // Implant. Dent. – – Vol. 10 – P.225–228.
- Ferrari A.R. Evaluation of the Effects of Platelet-Rich Plasma on Follicular and Endometrial Growth: A Literature Review. / Ferrari A. R., Cortrezzi S., Borges E. // JBRA assisted reproduction, – – Vol.25(4) – P.601–607.
- Sfakianoudis K. Reactivating Ovarian Function through Autologous Platelet-Rich Plasma Intraovarian Infusion: Pilot Data on Premature Ovarian Insufficiency, Perimenopausal, Menopausal, and Poor Responder Women./ Sfakianoudis K., Simopoulou M., Grigoriadis S. // Journal of clinical medicine, – – Vol.9(6) – P.1809.
- Dhurat R. Principles and Methods of Preparation of Platelet-Rich Plasma: A Review and Author's Perspective. / Dhurat R., Sukesh M. // J Cutan Aesthet Surg. – – Vol.7 – P.189–197.
- Parborell M.F. Inhibition of platelet-derived growth factor (PDGF) receptor affects follicular development and ovarian proliferation, apoptosis and angiogenesis in prepubertal eCG-treated rats. / Parborell M.F. // Mol.Cell Endocrinol – –Vol.412 – P.148–158.
- Aaronson S.A. Growth factors cancer. /Aaronson S.A.// Science. Nov. –– Vol.254(5035) – P.1146-53.
- Guo D. Vascular Endothelial Cell Growth Factor Promotes Tyrosine Phosphorylation of Mediators of Signal Transduction That Contain SH2 Domains. / Guo D., Jia Q., Song H.-Y. // Journal of Biological Chemistry, – – Vol.270(12) –P.6729–6733.
- Larivière B. Human plasma fibronectin potentiates the mitogenic activity of platelet-derived growth factor and complements its wound healing effects. / Larivière B., Rouleau M., Picard S. // Wound Repair Regen. – – Vol.11(1) – P.79-89.
- Lariviere B. Human plasma fibronectin potentiates the mitogenic activity of platelet-derived growth factor and complements its wound healing effects. / Lariviere B., Rouleau M., Picard S. // Wound Repair Regen – – Vol.11 – 79-89.
- Badawy A. Prediction and Diagnosis of Poor Ovarian Response: The Dilemma. /Badawy A., Wageah A., Gharib M. // J. Reprod. Infertil. – – Vol.12:241 – P.248.
- Broekmans F.J. Ovarian Aging: Mechanisms and Clinical Consequences. / Broekmans F.J., Soules M.R., Fauser B.C. // Endocr. Rev. – – Vol.30:465. – P.493.
- Fenton A.J. Premature ovarian insufficiency: Pathogenesis and management. / Fenton A.J.// J. Life Health. – – Vol.6. – P.147–153.
- Şükür Y.E. Ovarian aging and premature ovarian failure. J. Turk. / Şükür Y.E., Kıvançlı İ.B., Özmen B. // Ger. Gynecol. Assoc. – – Vol.15:190. – P.196.
- Younis J.S. Undetectable basal ovarian stromal blood flow in infertile women is related to low ovarian reserve. / Younis J.S., Haddad S., Matilsky M. // Gynecol. Endocrinol. Off. J. Int. Soc. Gynecol. Endocrinol. – – ; Vol.23:284. – P.289.
- Herraiz S. Autologous stem cell ovarian transplantation to increase reproductive potential in patients who are poor responders. / Herraiz S., Romeu M., Buigues A. // Fertil. Steril. – – Vol.110:496 – P.505.
- Ozcan P. The protective effect of platelet-rich plasma administrated on ovarian function in female rats with Cy-induced ovarian damage. / Ozcan P., Takmaz T., Tok O.E. // J. Assist. Reprod. Genet. – – Vol.37:865 – P.873.
- Sills E.S. Autologous activated platelet-rich plasma injection into adult human ovary tissue: Molecular mechanism, analysis, and discussion of reproductive response. / Sills E.S., Wood S.H. // Biosci.Rep. – – P.39.
- Duncan W.C. Inhibition of Vascular Endothelial Growth Factor in the Primate Ovary Up-Regulates Hypoxia-Inducible Factor-1 in the Follicle and Corpus Luteum. / Duncan W.C., Sander D., and Hamish M. // Endocrinology, – – Vol.149(7) –P.3313-20.
- Levitas E. Periovulatory and interleukin-1 beta-dependent up-regulation of intraovarian vascular endothelial growth factor (VEGF) in the rat: potential role for VEGF in the promotion of periovulatory angiogenesis and vascular permeability. /Levitas E., Chamoun D., Udoff L.C. // J Soc Gynecol Investig. – –Vol.7(1) – P.51-60.
- Szukiewicz D. Interleukin-8 may be involved in the ovarian mechanisms of follicle growth and ovulation. / Szukiewicz D., Pyzlak M., Klimkiewicz J. // Inflamm.res.56, –
- Gonçalves L.F. Effect of EDTA on TGF-β1 released from the dentin matrix and its influence on dental pulp stem cell migration. / Gonçalves L.F., Fernandes A.P., Cosme-Silva L. // Braz Oral Res. – – Vol.30:e131.
- Vo T.K.C. Ovarian Rejuvenation Using Autologous Platelet-Rich Plasma. / Vo T.K.C., Tanaka Y., Kawamura K. // Endocrines– – Vol.2– P.15-27.