ОЦЕНКА СПЕЦИФИЧНОСТИ ПРОТИВОТУБЕРКУЛЕЗНЫХ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ В ДВУСАЙТОВОМ ИМMУНОФЕРМЕНТНОМ АНАЛИЗЕ
Авдиенко В.Г.1, Бабаян С.С.2, Козлова И.В.3, Бочарова И.В.4
1ORCID: 0000-0002-1991-9549, кандидат медицинских наук, 2ORCID: 0000-0002-3900-9155, кандидат биологических наук, 3ORCID: 0000-0002-6328-363X, младший научный сотрудник, 4кандидат биологических наук,
ФГБНУ "Центральный научно-исследовательский институт туберкулеза"
ОЦЕНКА СПЕЦИФИЧНОСТИ ПРОТИВОТУБЕРКУЛЕЗНЫХ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ В ДВУСАЙТОВОМ ИМMУНОФЕРМЕНТНОМ АНАЛИЗЕ
Аннотация
В двусайтовом иммуноферментном анализе с антимикобактериальными моноклональными антителами (МАТ) и кроличьей противотуберкулезной сывороткой (АС) проанализирована специфичность распознаваемых МАТ антигенов микобактерий. Исследованы 14 МАТ против различных антигенов M.tuberculosis и 12 нетуберкулезных микобактерий. Наибольший интерес вызвал антиген против которого были направлены МАТ 1B7 (конформационный эпитоп?). Авторы считают, что исследование микобактериальных антигенов в подобном «гетеросэндвиче» МАТ-АГ-АС позволяет быстро проверить специфичность как самих МАТ, так и нативных АГ цельных клеток микобактерий с которыми они реагируют.
Ключевые слова: антимикобактериальные моноклональные антитела, микобактериальные антигены.
Avdienko V.G.1, Babayan S.S.2, Kozlova I.V.3, Bocharova I.V.4
1ORCID: 0000-0002-1991-9549, MD, 2ORCID: 0000-0002-3900-9155, PhD in Biology, 3ORCID: 0000-0002-6328-363X, Junior Research Associate, 4PhD in Biology,
FSBSI, Central Science and Research Institute for Tuberculosis
ESTIMATION OF SPECIFICS OF ANTITUBERCULOUS HOMOGENEOUS ANTIBODIES IN THE SANDWICH IMMUNOENZYMOMETRIC ANALYSIS
Abstract
The specifics of AHA recognized antigens of mycobacteria was analyzed in a sandwich immunoenzymometric analysis with antimycobacterial homogeneous antibodies (AHA) and rabbit antituberculosis serum (AS). 14 AHAs were tested on various antigens of M.tuberculosis and 12 nontuberculous mycobacteria. The antigen of AHA 1B7 (conformational epitope?) was of a particular interest. The authors believe that the study of mycobacterial antigens in such a "heterosandwich" AHA-AG-AS makes it possible to quickly test the specificity of both AHA themselves and the native AG of whole mycobacterial cells with which they react with.
Keywords: antimycobacterial monoclonal antibodies, mycobacterial antigens.
ВведениеМоноклональные антитела давно и активно используются в диагностике туберкулеза. Например, для быстрой идентификации Mycobacterium tuberculosis complex применяются иммунохроматографические тесты для выявления антигена MPT64 в микробиологических посевах на селективных жидких средах Мидлбрюка, в BACTEC MGIT 960 [9, С. 902]. Определение липоарабиноманнана B (LAM B) в биологических жидкостях больных туберкулезом также основано на МАТ [10, С. 2280], и на их основе создан коммерческий тест. Однако, диагностическая чувствительность выявления LAM B в моче не высока и составляет по разным источникам от 25% до 95%, а специфичность до 97% [11, С. 150], [1, С. 735].
Учитывая, что микобактерии — это живой организм, следует помнить, что в большинстве случаев нативные микобактериальные белки входят в состав мультипротеиновых комплексов. Например, антиген 38кДа (Psts1) входит в суперсемейство АТФ-связывающих кассетных субстрат-связывающих транспортеров, куда входят 15 различных белков [7, С. 78]. Кроме того, в этот комплекс ABC-транспортера входят 38 белков, относящихся к мембрансвязанному домену и еще 45 к нуклеотидсвязывающему домену [3, С. 450].
Имеются и другие не менее сложные комплексы. Так в клеточной стенке микобактерий существует 7 поровых систем для секреции белков как наружу, так и в состав внешнего слоя микобактериальной клеточной стенки, которая, как известно, представляет единый липидогликопептидогликановый комплекс [5, С. 3]. Наиболее показательны PE-PPE белки, осуществляющие как метаболические функции клеточной стенки, так и являющиеся фактором вирулентости патогенных микобактерий. Из 38 известных в этом семействе белков только 7 секретируются, остальные локализуются во внешних и внутренних слоях клеточной стенки [6, С. 905]. В связи с этим, выявление моноантигенов в таких сложных агрегированных комплексах как клеточная стенка микобактерий не всегда возможно, особенно в случае исследования образцов без предварительной пробоподготовки, содержащих нативный неразрушенный материал микобактерий.
Таким образом, целью этого исследования было изучить возможность использования антимикобактериальных МАТ для специфического выявления нативных антигенов туберкулезных микобактерий в двусайтовом иммуноферментном анализе.
Материал и методы
В экспериментах применяли культуру M.tuberculosis H37Rv, а также нетуберкулезные микобактерии из коллекции ФГБНУ «ЦНИИ туберкулеза», Москва. Для получения бактерий культуру микобактерий выращивали в синтетитческой среде Сотона в течение 28 дней при 37оС. 3-х кратно отмывали в PBS, ресуспендировали в небольшом объеме PBS и далее в суспензиях определяли концентрацию белка методом Брэдфорда [2, С. 250].
В исследовании были использованы антимикобактериальные моноклональные антитела, полученные прежде против цельных клеток M.tuberculosis H37Rv: 1D4 (IgG1, k), реагирующие с антигеном 7кДа; 2F9 (IgG2b, l), направленные против антигена 10кДа (CFP10); 2E11A3 (IgG2a, l), против 19кДа (Rv0009, PPIase A, rotamase A); 1C10G10 (IgG1, k), против 20-23кДа (MPT83); 1A5 (IgG2a, l) против 24кДа; 2C2G7C6 (IgG2b, l) против 23кДа; 1D2 (IgG2b, k) против 25кДа; 2E8C2 (IgG2a, k) против 25-26кДа; 1B7 (IgG1, k) против 25-26кДа; 1F2A7(IgG2a, l) против 38кДа (PstS-1); 1A6 (IgG2a, k) против 30кДа (ESAT6); 2F5 (IgG1, k) против полисахаридного антигена на белках с мол.массой более 30кДа; 1G4 (IgG2b, k) и 1C1 (IgG2b, k) против 38, 39, 40кДа; 1F1 (IgG2b, k) против 58, 100кДа. Кроме того, в исследовании были применены МАТ, полученные против иммуноглобулинов кролика 1C9E1 (IgG2a, k). Все МАТ созданы методом гибридомной технологии, и их специфичность в основном была в пределах M.tuberculosis complex.
Гибридомы, продуцирующие МАТ, выращивали in vitro в культуральной среде, содержащей аффинноочищенную на белкaх A и G фетальную сыворотку, не содержащую иммуноглобулинов крупного рогатого скота. Это позволяло очищать иммуноглобулины МАТ на этих же сорбентах с белками A и G. Для очистки фетальной сыворотки и МАТ из супернатантов культуральных жидкостей использовали иммуноаффинную хроматографию на колонках с сефарозой, ковалентносвязанной с белками A, G или L в FPLC (Pharmacia, Швеция). Эффлюаты МАТ диализовали против физраствора забуференного фосфатами (PBS), концентрировали ультрафильтрацией, после диализа добавляли 0,02% азид натрия в качестве консерванта. МАТ против иммуноглобулинов кролика 1C9E1 ковалентно конъюгировали с пероксидазой хрена методом Наканэ-Уилсона [13, С. 171].
Гипериммунную кроличью антисыворотку получали многократной иммунизацией животных цельными клетками M.tuberculosis H37Rv в неполном адъюванте Фрейнда. Очистку кроличьих иммуноглобулинов проводили на сорбенте Sepharose–CL6B с ковалентно связанными антигенами ультразвукового дезинтеграта M.tuberculosis H37Rv. Истощение полученных антимикобактериальных иммуноглобулинов от перекрёстных реакций производили на сорбенте Sepharose–CL6B с ковалентно связанными иммуноглобулинами мыши. Полученный препарат концентрировали иммунофильтрацией и добавляли 0,02% азид натрия.
Спектр и активность МАТ и антимикобактериальных иммуноглобулинов кролика (АС) проверяли в иммуноблоттинге на расфракционированном в редуцирующих условиях в диск-электрофорезе в 12,5% ПААГ цельноклеточном препарате M.tuberculosis H37Rv.
Специфичность МАТ и связывающихся с ними антигенов оценивали в двусайтовом иммуноферментном анализе. Для этого иммуноглобулины антимикобактериальных МАТ наносили на поверхность планшетов для ИФА, инкубировали в течение ночи при 4оС, отмывали PBS - 0,001% Tween 20 (PBST), далее титровали цельноклеточную суспензию M. tuberculosis H37Rv в качестве стандарта и добавляли цельные клетки других нетуберкулезных микобактерий. После инкубации и тщательной отмывки PBS-T наносили антимикобактериальные иммуноглобулины кролика. Детекцию связанных в тройной комплекс МАТ-АГ-АС иммуноглобулинов кролика проводили с помощью иммунопероксидазных конъюгатов МАТ 1C9E1 против IgG кролика. Реакцию проявляли с помощью ТМБ, спектрофотометрировали при 450нм и определяли концентрацию в исследуемых образцах по стандартам.
Результаты
На Рисунке 1 представлен иммуноблоттинг со всеми исследуемыми МАТ и антимикобактериальными иммуноглобулинами кролика. Как видно из приведенного рисунка, не все МАТ реагировали с денатурированными антигенами цельных клеток.
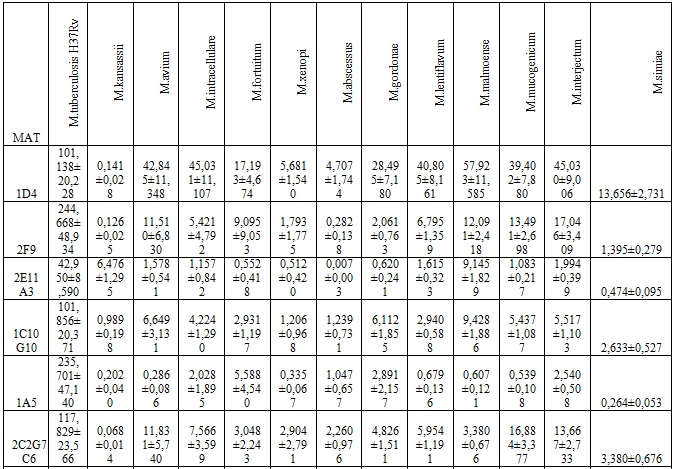
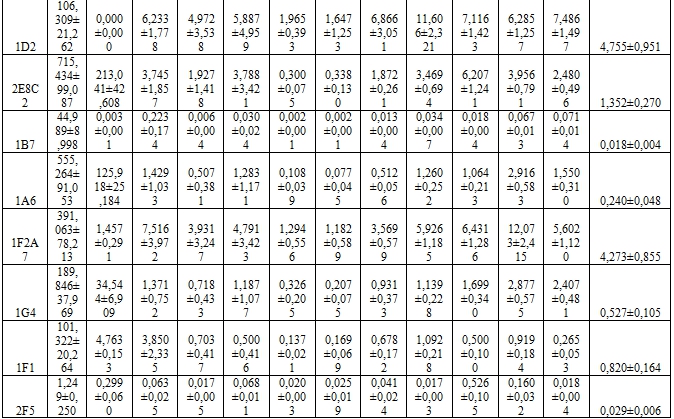
В Таблице 1 приведены данные двусайтового иммуноферментного анализа МАТ и цельных клеток микобактерий (Таблица 1).
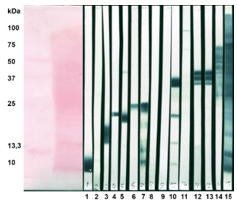
Рис. 1 – Иммуноблоттинг антимикобактериальных МАТ с антигенами. Справа приведены молекулярные массы белков маркеров и расфракционированные в редуцирующих условиях в 12,5% ПААГ цельные клетки M.tuberculosis H37Rv. МАТ: 1- 1D4, 2- 2F9, 3- 1C10G10, 4- 1A5, 5-2C2G7C6, 6-1D2, 7- 2E8C2, 8-1B7, 9- 1A6, 10- 1F2A7, 11- 1F1, 12- 1G4, - 1C1, 14- 2F5, 15- антимикобактериальные иммуноглобулины кролика
Таблица 1 – Концентрация исследуемых антигенов микобактерий (мкг/мл), реагирующих с МАТ в двусайтовом ИФА
Как видно из представленной таблицы, большинство МАТ не были специфичны только в отношении M.tuberculosis и реагировали с нетуберкулезными микобактериями.
Обсуждение.
Для исследования были взяты МАТ против различных по молекулярной массе, специфичности и свойствам антигенов микобактерий.
Так микобактериальные белки 6кДа (ESAT-6) и 10кДа (CFP10) секретируются в раннюю фазу роста вирулентных микобактерий. Кроме того, ESAT-6 в экзосомах (мембранных везикулах), активно вырабатываемых вирулентными микобактериями. Оба белка секретируются через микобактериальную систему секреции Type VII или ESX-5 (early secretory antigenic target 6 (ESAT-6) system) [5, P. 3].
Белок 19кДа (Rv009) – железо-регулируемая пептидил-пропил цис-транс изомераза A (ротомаза А), которая идентифицируется масс-спектрометрией в культуральных фильтратах, мембранной фракции и в цельноклеточных лизатах M. tuberculosis H37Rv – аналогичен белкам нетуберкулезных микобактерий. Белок необходим для in vitro роста на холестерине [12, P. 504].
Липогликопротеин MPT/MPB-83 присутствует в клеточной стенке и культуральных фильтратах M. tuberculosis и M. bovis и является агонистом TLR2, т.е. MPB83 можно рассматривать как фактор вирулентности микобактерий [4, P. 94].
Антиген 38кДа (PstS-1) – известный фосфатсвязывающий белок микобактерий, входящий в состав ABC-транспортера клеточной стенки микобактерий [3, P. 450]. Он вызывает сильный специфический антительный ответ на самых ранних этапах заболевания туберкулезом у человека [8, P. 524]. 38кДа входит в комплекс из PstA2, PstB2, PstC1 и PstS2, относящихся к фосфатным пермеазам [7, P. 79] и, по-видимому, распознается МАТ 1G4 и 1С1. Аналогичные белки имеются у всех микобактерий.
Заключение
Из полученных данных видно, что МАТ распознают антигены, входящие в мультипротеиновые комплексы и мембранные комплексы, представленные не только в M. tuberculosis, но и в других нетуберкулезных микобактериях. Это прежде всего указывает на то, что антимикобактериальные иммуноглобулины кролика имеют перекрестные реакции с многими микобактериями, а также на то, что нативные антигены микобактерий входят в сложные биологические комплексы, выполняющие метаболические и катаболические функции, сходные у разных бактерий.
Интересен антиген, выявляемый МАТ 1B7, поскольку он определяется только на цельных клетках M. tuberculosis, но идентифицировать его в иммуноблоттинге невозможно, т.к. эпитоп, распознаваемый МАТ 1B7, конформационный.
Таким образом, исследование микобактериальных антигенов в «гетеросэндвиче» МАТ-АГ-АС позволяет быстро проверить специфичность как самих МАТ, так и нативных АГ цельных клеток микобактерий, с которыми они реагируют.
Список литературы / References
- Balcha T.T. Detection of lipoarabinomannan in urine for identification of active tuberculosis among HIV-positive adults in Ethiopian health centres / T.T. Balcha, N. Winqvist, E. Sturegård, S. Skogmar and others // Trop Med Int Health. – 2014. – Vol. 19. – №6. – P. 734-742.
- Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding / M.M. Bradford // Anal Biochem. – 1976 – Vol.7. – №72. – P. 248-254.
- Braibant M.M. The ATP binding cassette (ABC) transport systems of Mycobacterium tuberculosis / M.M. Braibant, J.P. Gilot // FEMS Microbiology Reviews. – 2000. – Vol. 24. – P. 449-467.
- Chambers M.A. Antibody bound to the surface antigen MPB83 of Mycobacterium bovis enhances survival against high dose and low dose challenge / M.A. Chambers, D. Gavier-Widen, R.G. Hewinson // FEMS Immunol Med Microbiol. – 2004. –Vol. 41. – P. 93-100.
- Chiaradia L. Dissecting the mycobacterial cell envelope and defining the composition of the native mycomembrane / L. Chiaradia, C. Lefebvre, J. Parra, J. Marcoux and others // Sci Rep. – 2017. – Vol.7. – №1. – P.1-12.
- Fishbein S. Phylogeny to function: PE/PPE protein evolution and impact on Mycobacterium tuberculosis pathogenicity / S. Fishbein, N. van Wyk, R.M. Warren, S.L. Sampson // Mol Microbiol. – 2015. – Vol.96. – №5. – P.901-916.
- Hwang W.H. Expression, purification and improved antigenicity of the Mycobacterium tuberculosis PstS1 antigen for serodiagnosis / W.H. Hwang, W.K. Lee, S.W. Ryoo, K.Y. Yoo and others // Protein Expr Purif. – 2014. – Vol.95. – P.77-83.
- Ivanyi J. Significance of antigen and epitope specificity in tuberculosis / J. Ivanyi, T.H. Ottenhoff // Front Immunol. – 2014. – Vol. 23. – №5. – P.524.
- Maurya A.K. Evaluation of an immunochromatographic test for discrimination between Mycobacterium tuberculosis complex & non tuberculous mycobacteria in clinical isolates from extra-pulmonary tuberculosis./ A.K. Maurya, V.L. Nag, S. Kant, R.A. Kushwaha and others // Indian J Med Res. – 2012. – Vol.135. – №6. – P.901-906.
- Pereira Arias-Bouda L.M. Development of antigen detection assay for diagnosis of tuberculosis using sputum samples / L.M. Pereira Arias-Bouda, L.N. Nguyen, L.M. Ho, S. Kuijper and others // J Clin Microbiol. – 2000. – Vol.38. – №6. – P.2278-83.
- Shah M. Diagnostic accuracy of a urine lipoarabinomannan test for tuberculosis in hospitalized patients in a High HIV prevalence setting / M. Shah, E. Variava, C.B. Holmes, A. Coppin and others // J Acquir Immune Defic Syndr. – 2009. – Vol.52. – №2. – P.145-151.
- de Souza G.A. Bacterial proteins with cleaved or uncleaved signal peptides of the general secretory pathway / G.A. de Souza, N.A. Leversen, H. Målen, H.G. Wiker // J Proteomics. – 2011. – Vol.75. – №2. – P.502-510.
- Wilson M.B. The covalent coupling of proteins to periodate-oxidized sephadex: a new approach to immunoadsorbent preparation / M.B. Wilson, P.K. Nakane // J Immunol Methods. – 1976. – Vol.12. – №1-2. – P.171-181.