ОЦЕНКА БЕЗОПАСНОСТИ И ЭФФЕКТИВНОСТИ СЕЛЕКТИВНОЙ ПЛАЗМОСОРБЦИИ И ПЛАЗМООБМЕНА ПРИ ПЕЧЁНОЧНОЙ НЕДОСТАТОЧНОСТИ У БОЛЬНЫХ С МЕХАНИЧЕСКОЙ ЖЕЛТУХОЙ
ОЦЕНКА БЕЗОПАСНОСТИ И ЭФФЕКТИВНОСТИ СЕЛЕКТИВНОЙ ПЛАЗМОСОРБЦИИ И ПЛАЗМООБМЕНА ПРИ ПЕЧЁНОЧНОЙ НЕДОСТАТОЧНОСТИ У БОЛЬНЫХ С МЕХАНИЧЕСКОЙ ЖЕЛТУХОЙ
Научная статья
Титова Г.В.1, *, Фомин А.М.2
1 ORCID:0000-0001-6010-9583;
2 ORCID:0000-0002-9187-8489;
1, 2 Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского, Москва, Россия;
* Корреспондирующий автор (galinatitova[at]mail.ru)
АннотацияЭкстракорпоральные методы гемокоррекции и детоксикации при печеночной недостаточности у больных с механической желтухой эффективны и нуждаются в оценке их безопасности в предоперационном и послеоперационном периодах, особенно на фоне длительного желтушного периода. Была проведена оценка безопасности и эффективности селективной плазмосорбции и плазмообмена при печеночной недостаточности у больных с механической желтухой у 32 пациентов. Из них - 14 пациентам был выполнен плазмообмен, 18 пациентам проводилась селективная плазмосорбция. Уровень общего билирубина до начала лечения был от 285 мкмоль/л до 589 мкмоль/л. Каждому пациенту было проведено 3 процедуры плазмообмена с удалением 1 ОЦП (объём циркулирующей плазмы). Удаляемый объем плазмы восполнялся донорской свежезамороженной плазмой и введением 5% раствора альбумина в соотношении 1:1. С целью антикоагуляции применяли гепарин. В другой группе каждому пациенту было проведено 3 процедуры с обработкой 2 ОЦП за процедуру. При этом одна процедура проводилась непосредственно накануне операции, а две другие – в раннем послеоперационном периоде. С целью антикоагуляции применяли гепарин. Изучали состояние пациентов и динамику биохимических показателей до начала процедуры, во время процедуры и по окончании процедуры. При плазмообмене отмечалось снижение уровней общего билирубина на 38,5±6,4%, конъюгированного билирубина на 37,2±5,0%, неконъюгированного билирубина на 27,5±2,3%, АЛТ – на 23,4±4,1%, АСТ – на 30,4±3,5%, желчных кислот на 30,3±5,4%, щелочной фосфатазы на 34,2±3,5% к концу процедуры. Было отмечено снижение общего билирубина после селективной плазмосорбции на 39,8 ± 3,8%, конъюгированного билирубина на 38,2 ± 18%, неконъюгированного билирубина на 32,5 ± 11,9%, АЛТ – на 23,5±3,4%, АСТ – на 37±2,3%, желчных кислот на 31,4±2,8% к концу процедуры. При этом другие биохимические показатели существенно не менялись. В ходе процедуры плазмосорбции геморрагических осложнений не было ни у одного пациента.
Ключевые слова: экстракорпоральная гемокоррекция, плазмообмен, печеночная недостаточность, механическая желтуха, селективная плазмосорбция.ASSESSMENT OF SAFETY AND EFFICIENCY OF SELECTIVE PLASMA SORPTION AND PLASMA EXCHANGE AT HEPATISM IN PATIENTS WITH OBSTRUCTIVE JAUNDICE
Research article
Titova G.V.1٫ * Fomin A.M.2
1 ORCID:0000-0001-6010-9583;
2 ORCID:0000-0002-9187-8489;
1, 2 Moscow Regional Research Clinical Institute named after M.F. Vladimirskiy, Moscow, Russia;
* Corresponding author (galinatitova[at]mail.ru)
Abstract
Extracorporeal haemocorrection and detoxification methods for hepatic insufficiency in patients with obstructive jaundice are effective and need to be assessed for their safety in preoperative and postoperative periods, in particular, against the background of a lengthy period of jaundice. The safety and efficiency of selective plasma sorption and plasma exchange at hepatism in patients with obstructive jaundice was evaluated in 32 patients. Of these, 14 patients underwent plasma exchange, 18 patients underwent selective plasma sorption. The level of total bilirubin before the treatment was from 285 µmol/L to 589 µmol/L. Each patient underwent 3 plasma exchange procedures with the removal of 1 VPC (volume of plasma circulation). The removed plasma volume was filled with fresh donor frozen plasma and 5% solution of albumin in a 1:1 ratio was introduced. Heparin was used for anticoagulation. In another group, each patient underwent 3 procedures with a treatment of 2 VPC per procedure. In this case, one procedure was carried out directly on the eve of the operation, and the other two – in the early postoperative period. Heparin was used for anticoagulation. We studied the patient’s condition and the dynamics of biochemical parameters before the procedure, during the procedure and at the end of the procedure. During plasma exchange, there was a decrease in the levels of total bilirubin by 38.5 ± 6.4%, conjugated bilirubin by 37.2 ± 5.0%, unconjugated bilirubin by 27.5 ± 2.3%, ALT – by 23.4 ± 4, 1%, GOT – by 30.4 ± 3.5%, bile acids by 30.3 ± 5.4%, and alkaline phosphatase by 34.2 ± 3.5% by the end of the procedure. There was a decrease in total bilirubin after selective plasma sorption by 39.8 ± 3.8%, conjugated bilirubin by 38.2 ± 18%, and unconjugated bilirubin by 32.5 ± 11.9%, ALT – by 23.5 ± 3.4 %, GOT – by 37 ± 2.3%, bile acids by 31.4 ± 2.8% by the end of the procedure. However, other biochemical parameters did not change significantly. In the course of the plasma sorption procedure, none of the patients had hemorrhagic complications.
Keywords: extracorporeal haemocorrection, plasma exchange, hepatic extracorporeal hemocorrection insufficiency, obstructive jaundice, selective plasma sorption.
Ведение.
Ежегодно количество больных механической желтухой различной этиологии увеличивается в Российской Федерации на 800 000 человек [1, С. 58]. В последние 15 лет отмечается увеличение количества заболеваний, которые сопровождаются развитием внепеченочного холестаза, в связи с этим прогнозируется рост заболеваемости органов желчевыводящей системы на 30-50%.
Оперативные вмешательства у больных с блоком желчевыводящих путей, которые выполняются по экстренным показаниям, сопровождаются большим числом осложнений, эти осложнения в основном связанны с нарушениями в системе гемостаза и повышенной кровоточивостью в зоне операции. Это приводит к росту летальности, которая в случае развития осложнений достигает 15-30%, это в 4 раза выше, чем в тех случаях, когда холестаз удается разрешить или хотя бы уменьшить до операции [1, С.58], [2, С. 328], [3, С. 47], [4, С. 468], [5, С. 9], [6, С. 19]. Хирургические риски значительно снижаются, если печёночная недостаточность купирована до оперативного вмешательства [7, С. 60]. Длительный желтушный период с высокими цифрами билирубина приводит к тяжелой печеночной недостаточности, дальнейшее ее прогрессирование в послеоперационном периоде является причиной летального исхода почти в 50% случаев, при общей летальности 12,5%. Экстракорпоральные методы гемокоррекции при печеночной недостаточности осуществляют временное протезирование и поддержку функции печени, предупреждают дальнейшее развитие печеночной недостаточности, создавая при этом условия для восстановления поврежденных структур печени. Таким образом развитие вторичных осложнений со стороны органов и систем сводятся к минимуму [9, С. 49].
Плазмообмен, плазмофильтрация, плазмосорбция являются основными методами экстракорпоральной гемокоррекции, которые используют при лечении больных с печёночной недостаточностью [10, С. 50]. Эффективность плазмообмена и плазмофильтрации ограничена объемами удаляемых компонентов крови [10, С. 49], [11, С. 10]. Системы Prometheus (сепарация и адсорбция фракционированной плазмы или FPSA) и MARS (молекулярная адсорбирующая рециркулирующая система) широко не используются в связи высокой стоимостью расходного материала. Перспективным направлением в настоящее время из экстракорпоральных методов гемокоррекции является применение сорбционных методов, обладающих определенной селективностью [6, С. 28].
Цель работы: провести оценку эффективности и безопасности селективной плазмосорбции и плазмообмена при печёночной недостаточности у больных с механической желтухой.
Материалы и методы
В отделении хирургической гемокоррекции и детоксикации ГБУЗ МО «МОНИКИ имени М.Ф.Владимирского» в период с 2014 г. по 2017 г. проводился анализ двух методов экстракорпоральной гемокоррекции – плазмообмена и селективной плазмосорбции при печеночной недостаточности у больных с механической желтухой. Мы провели оценку безопасности и эффективности этих методов.
Исследование проведено у 32 (15 мужчин и 17 женщин) больных с механической желтухой обструктивного генеза с длительным желтушным периодом. Средний возраст пациентов составил 57 ± 10 лет (мин. - 48, макс. - 67 лет). Длительность желтухи в среднем составляла 9,1 ± 1,5 недель (мин. - 3 , макс. - 14 нед.). (табл. 3).
Основными причинами механической желтухи были желчнокаменная болезнь с холедохолитиазом и стриктуры холедоха разных уровней локализации, при этом у 9 пациентов был диагностирован острый холангит. Исходный средний уровень общего билирубина был (385,6 ± 34,6) мкмоль/л (мин. - 285, макс. - 589 мкмоль/л). Всем больным были выполнены оперативные вмешательства, направленные на ликвидацию блока желчевыводящих путей.
Степень печеночной дисфункции и тяжесть состояния оценивали по следующим параметрам: тяжести холестаза (уровень билирубинемии, АЛТ, АСТ, желчных кислот, ЩФ), степени печёночной энцефалопатии, состоянию гемостаза (фибриноген, АЧТВ, МНО, протромбин, антитромбин III). C целью определения прогноза заболевания, использовали классификацию печёночной недостаточности при механической желтухе, предложенную В.Д. Федоровым и В.А. Вишневским в 2004 г. (табл. 1, 2) [3, C. 47].
Не всегда клинические проявления и лабораторные данные соответствуют глубине патологических изменений, в связи с этим поиск объективных критериев оценки тяжести состояния больных при механической желтухе продолжается. Оценочные шкалы в отношении определенных форм печеночной недостаточности имеют достоверно значимую прогностическую точность (Schindl - для смешанной формы печёночной недостаточности и гепаторенального синдрома, Child-Turcotte-Pugh - для определения тяжести цирроза печени, шкалы MELD и SOFA - для печеночной энцефалопатии), но ни одна из предложенных шкал не обладала прогностической значимостью по отношению ко всем формам печеночной недостаточности [12, C. 74].
В 2009 г. на Пленуме Правления Ассоциации хирургов-гепатологов России и стран СНГ Э.И. Гальперин отметил, что что печёночная недостаточность при механической желтухе в основном носит скрытый характер и редко сопровождается явлениями энцефалопатии в отличие от печёночной недостаточности при циррозе печени и предложил рабочую классификацию печёночной недостаточности, которая, по его мнению, позволяет определить прогноз предстоящей операции и лечебные действия, в зависимости от тяжести холестаза [4, С. 468].
Ранее В.Д. Федоров и В.А. Вишневский в 2004 г. предложили свою балльную классификацию печёночной недостаточности при механической желтухе (табл. 1, 2) [4, С. 468].
Таблица 1 – Бальная оценка тяжести печёночной недостаточности при механической желтухе [4, С. 468]
| Показатель | Баллы | ||
| 1 | 2 | 3 | |
| Длительность желтухи, дни | < 7 | 7–14 | > 14 |
| Общий билирубин, мкмоль/л | < 100 | 100–200 | > 200 |
| Альбумин – глобулиновый коэффициент | > 1,2 | 1,2–0,9 | < 0,9 |
| Наличие неврологической симптоматики | 0 | Слегка выраженная | Выраженная |
Таблица 2 – Степень тяжести механической желтухи и исход заболевания [4, С. 468]
| Степень тяжести | Количество баллов | Общая летальность, % |
| Легкая | 4–5 | 0 |
| Средняя | 6–8 | 10,5 |
| Тяжелая | 9–12 | 42,9 |
Критериями исключения из исследования были: 1. Выявленные у пациентов в процессе обследования и лечения злокачественные опухоли гепатопанкреатобилиарной зоны с обструкцией желчевыводящих путей. 2. Пациенты моложе 18 лет и старше 80 лет.
Исходные клинико-демографические характеристики пациентов с механической желтухой представлены в таблице 3.
Таблица 3 – Исходные клинико-демографические характеристики пациентов с механической желтухой
| Показатель | I группа (СПС) | II группа (ПО) |
| Всего пациентов (мужчины / женщины) | 18 (9/9) | 14 (6/8) |
| Средний возраст, лет | 54,4 ± 3,4 | 56,3 ± 4,2 |
| Уровень среднего артериального давления, мм рт. ст. | 93,3 ± 10 | 90,1 ± 11,3 |
| Средняя длительность желтухи, недель (минимальное / максимальное значение) | 8,3 ± 1,8 (4/12) | 10,3 ± 2,3 (3/14) |
| Средняя длительность желтухи в обеих группах , недель (минимальное / максимальное значение) | 9,1 ± 1,5 (3/14) | |
| Диагноз, n | ||
| ЖКБ. Холедохолитиаз. Холангит. Механическая желтуха | 5 | 4 |
| ЖКБ. Холедохолитиаз. Механическая желтуха | 10 | 7 |
| ЖКБ. Стриктура холедоха. Механическая желтуха | 3 | 3 |
| Степень энцефалопатии, n (% от количества больных в группе) | ||
| Легкая | 10 (55,5%) | 8 (57,1%) |
| Средней тяжести | 7 (38,9%) | 4 (28,6%) |
| Тяжелая | 1 (5,6 %) | 2 (14,3 %) |
| Тяжесть состояния по классификации В.Д. Федорова и В.А. Вишневского до начала экстракорпоральной гемокоррекции, среднее количество баллов | 9 ± 1,4 | 10 ± 1,6 |
Окончание табл. 3 – Исходные клинико-демографические характеристики пациентов с механической желтухой
| Показатель | I группа (СПС) | II группа (ПО) |
| Тяжесть состояния по классификации В.Д. Федорова и В.А. Вишневского после окончания экстракорпоральной гемокоррекции, среднее количество баллов | 7 ± 1,1* | 8 ± 0,9* |
| Характер оперативного вмешательства на желчных путях, n (% от общего числа оперативных вмешательств) | ||
| Эндоскопическая папиллосфинктеротомия и эндоскопическая литоэкстракция | 12 | 10 |
| Лапаротомия, холедохолитотомия, дренирование холедоха | 6 | 4 |
| Умерло, человек | 1 | 1 |
Пациенты, участвующие в исследовании, были разделены на две группы. Первая группа – 18 пациентов (9 мужчин и 9 женщин), которым в качестве экстракорпоральной гемокоррекции выполнялась селективная плазмосорбция (СПС). Вторая группа - 14 пациентов (6 мужчин и 8 женщин), которым в качестве экстракорпоральной гемокоррекции выполнялся плазмообмен (ПО). Каждому пациенту было выполнено по 3 процедуры СПС или ПО – по 1 процедуре перед операцией и по 2 процедуры в раннем послеоперационном периоде.
Для проведения плазмообмена использовался аппарат «Haemonetics PCS-2» производства США с соответствующим комплектом магистралей и расходного материала «Haemonetics». Аппарат представляет собой автоматизированную систему для сбора плазмы методом центрифугирования и работает по принципу прерывисто-поточного центрифугирования крови. Один комплект расходного материала рассчитан на удаление 1000 мл плазмы. Эритроцитарная масса возвращается пациенту перед началом нового цикла.
Каждому пациенту второй группы было проведено по 3 сеанса плазмообмена с эксфузией 1 объема циркулирующей плазмы (ОЦП), что в среднем составило 2976 ±243 мл. При этом один сеанс проводился непосредственно за 1 день перед операцией, а два других – в раннем послеоперационном периоде. Перерыв между процедурами после операции составил 1–2 дня. В качестве сосудистого доступа наиболее часто использовалась периферическая вена, в основном кубитальная, с установкой диализной иглы. Антикоагулянт – гепаринизированный физиологический раствор 250 мл с добавлением 10000 ЕД гепарина. Подача антикоагулянта регулируется автоматически с достижением соотношения антикоагулянт – кровь, стандартное соотношение – 1:14 – 1:16. Удаляемый объем плазмы восполнялся введением 5% раствора альбумина и донорской свежезамороженной плазмой в соотношении 1:1. С целью снижения потерь плазменных факторов свёртывания замещение начинали 5% раствором альбумина в первой половине процедуры, а СЗП вводили во второй части плазмообмена.
Селективная плазмосорбция выполнялась на аппарате «Octo Nova» («Asahi Kasei Medical», Япония-Германия) с использованием сорбента «Plasorba BR-350». Многофункциональный аппарат «Octo Nova» представляет собой гемопроцессор и предназначен для проведения методов заместительной почечной терапии, каскадной плазмофильтрации и плазмосорбции. Схема процедуры селективной плазмосорбции представлена на рис. 1.
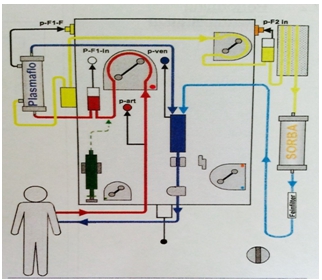
Рис. 1 – Схема процедуры селективной плазмосорбции (Liver Support)
Кровь от пациента с помощью роликового насоса поступает в плазмофильтр «Plasmaflo», где происходит отделение плазмы от крови, после чего плазма проходит через сорбционную колонку «Plasorba BR-350», далее соединяется с деплазмированной кровью и возвращается обратно к пациентую. Сорбент Рlasorba BR-350 состоит из самой адсорбирующей колонки и фильтра. (рис. 1).
Процесс очищения крови основан на принципе ионообмена, то есть на замещении ионов на поверхности сорбента ионами сорбата. Сорбционная способность колонки Plasorba BR-350 основана на принципе анионного обмена для селективного удаления билирубина и желчных кислот из крови при печеночной недостаточности различной этиологии [13, С. 2]. Действующим веществом является дивинилбензола стирол и пропилен, покрытый этиленвиниловым спиртом сополимера. В данной системе лиганд представляет собой заряженную четвертичную соль аммония, которая позволяет селективно захватывать билирубин, имеющий отрицательный заряд на карбоксильных группах [14, С. 89].
Каждому пациенту первой группы было проведено по 3 процедуры селективной плазмосорбции с обработкой двух объемов циркулирующей плазмы (2 ОЦП). При этом один сеанс проводился непосредственно за 1 день перед операцией, а два других – в раннем послеоперационном периоде. Перерыв между процедурами после операции составлял 1–2 дня. Длительность процедуры в среднем составляла 4 часа, скорость кровотока – от 150 мл/мин. Скорость плазмотока поддерживалась на уровне 30-32 мл/мин. Антикоагуляция проводилась раствором гепарина: магистрали и фильтр промывали раствором гепарина из расчета 4000 ЕД на 2 литра физиологического раствора, пациентам вводили 5000 ЕД гепарина в начале процедуры. Для сосудистого доступа использовали двухпросветный диализный катетер, установленный в центральную вену.
Для оценки эффективности селективной плазмосорбции и плазмообмена нами изучена динамика некоторых биохимических показателей и показателей коагулограммы в ходе процедуры (табл. 4, 5, 6).
Полученные данные обрабатывали при помощи описательной и параметрической статистики. Количественные данные представлены, как среднее значение ± стандартное отклонение. Попарные сравнения связанных выборок (до и после проведения процедур) проводили парным критерием Стьюдента в программе SPSS. Значения p менее 0,05 считали статистически значимыми.
Результаты
В обеих группах перед началом процедур экстракорпоральной гемокоррекции у пациентов оценивали волемический статус и показатели гемодинамики. Для профилактики гемодинамических нарушений проводили подготовку путём введения раствора хлористого натрия 0,9% - 500 – 1000 мл или изотонического раствора стерофундина – 500 - 1000 мл [7, С. 60]. При гиповолемических состояниях проводилась необходимая дополнительная инфузионная терапия. При проведении плазмообмена у 10 (71,5 %) пациентов в середине процедуры отмечалось снижение среднего артериального давления до 70 мм рт ст. При проведении селективной плазмосорбции примерно на 30 - 40-й минутах от начала процедуры у 12 (66,6%) пациентов отмечалось снижение среднего артериального давления до 65 мм рт. ст. В обеих группах явления гипотензии медикаментозно купировались. После окончания процедуры ни у кого из пациентов гемодинамически значимых нарушений не отмечали.
После окончания лечения экстракорпоральными методами была оценена тяжесть состояния пациентов по классификации В.Д. Федорова и В.А. Вишневского (табл. 1 и 2).
К окончанию процедур состояние пациентов в обеих группах улучшилось, это отразилось в бальном исчислении. Согласно этой классификации, уменьшение количества баллов в каждой группе (табл. 3), влияет на дальнейший прогноз и исход заболевания. Видно, что летальность составляет не 42,9%, а 10,5% (табл. 1 и 2) и это статистически достоверно.
Для оценки эффективности и безопасности селективной плазмосорбции (СПС) и плазмообмена (ПО) исследовали динамику некоторых биохимических показателей. В таблице 4 показана сравнительная характеристика и динамика биохимических показателей двух групп исследуемых пациентов. Проводили забор венозной крови перед процедурой и сразу после нее. Установлено снижение уровней общего билирубина на 39,8 ± 3,8% после проведения селективной плазмосорбции, по сравнению с плазмообменом, после которого снижение общего билирубина составляло 38,5±6,4%, что может расцениваться как сопоставимое снижение в обеих группах. Снижение конъюгированного билирубина после селективной плазмосорбции было на 38,2 ± 18%, после проведения плазмообмена этот показатель составлял 37,2±5,0%, что так же может быть расценено как равнозначное снижение. Однако снижение неконъюгированного билирубина после селективной плазмосорбции было на 32,5 ± 11,9%, а после плазмообмена снижение составляло 27,5±2,3%, что почти на 5% больше. Динамика АЛТ в виде снижения на 23,5±3,4% после селективной плазмосорбции и снижения АЛТ на 23,4±4,1% после плазмообмена была примерно одинаковой. АСТ снизилась после селективной плазмосорбции на 37±2,3%, а после плазмообмена снижение АСТ было на 30,4±3,5%, что составляет разницу в почти в 6,5% в пользу селективной плазмосорбции. снижение желчных кислот после селективной плазмосорбции было на 31,4±2,8%, после плазмообмена этот показатель снизился на 30,3±5,4%, это снижение мы посчитали равнозначным. Обращает на себя внимание снижение уровня щелочной фосфатазы после плазмообмена на 34,2 %, в то время как после селективной плазмосорбции снижения уровня щелочной фосфатазы не происходило. При проведении селективной плазмосорбции и плазмообмена выявлено незначительное снижение уровня общего белка и альбумина по окончании процедур. Так, после проведения селективной плазмосорбции уровень общего белка снизился на 2,05 ± 0,8 %, уровень альбумина снизился на 3,9 ± 2,4%. После плазмообмена уровень снижения общего белка составлял 6,6±1,0%, уровень альбумина - 6,5±1,3%. Не смотря на отсутствие достоверного снижения уровня белка в обеих группах, содержание белка во 2 группе было более значимым и превышало уровень снижения белка в 1 группе. Отмечен больший процент (в 2-3 раза больше) снижения общего белка и альбумина при проведении плазмообмена, чем при плазмосорбции.
Таблица 4 – Влияние плазмосорбции и плазмообмена на основные биохимические показатели пациентов с механической желтухой
| Показатель | Результаты, средняя величина | Процент снижения (%) | ||||
| I группа (СПС) | II группа (ПО) | |||||
| до проц. | после проц. | до проц. | после проц. | I группа (СПС) | II группа (ПО) | |
| Общий билирубин | 385,6 ± 34,6 | 232,13 ± 43* | 288,3 ± 10,2 | 177,3 ± 11,7* | 39,8 ± 3,8 | 38,5 ± 6,4 |
| Конъюгированный билирубин, мкмоль/л | 200,3 ± 98,3 | 123,79 ± 14,5 | 176,2±15,1 | 110,65 ± 7,5 | 38,2 ± 18 | 37,2 ± 5,0 |
| Неконъюгированный билирубин, мкмоль/л | 185,4 ± 82,4 | 125,15 ± 10,4 | 122,3 ± 11,2 | 88,67 ± 9,4 | 32,5 ± 11,9 | 27,5 ± 2,3 |
| Общий белок, г/л | 53,8 ± 12,7 | 52,7 ± 7,8 | 62,4 ± 10,5 | 58,3 ± 5,6 | 2,05 ± 0,8 | 6,6 ± 1,0 |
| Альбумин, г/л | 30,8 ± 9,17 | 29,6 ± 8,9 | 32,2 ± 8,2 | 30,1 ± 7,5 | 3,9 ± 2,4 | 6,5 ± 1,3 |
| АЛТ, ед/л | 92,4 ± 8,6 | 70,69 ± 5,9* | 68,4 ± 13,3 | 52,4 ± 11,2* | 23,5 ± 3,4 | 23,4 ± 4,1 |
| АСТ, ЕД/л | 121,21 ± 40 | 76,36 ± 5,9 | 102,4 ± 17,2 | 71,3 ± 10,2 | 37 ± 2,3 | 30,4 ± 3,5 |
| Желчные кислоты | 98,8 ± 9,1 | 67,78 ± 3,2* | 86,5 ± 10,1 | 60,3 ± 9,3* | 31,4 ± 2,8 | 30,3 ± 5,4 |
| Щелочная фосфатаза, ЕД/л | 135 ± 8,9 | 133 ± 6,7 | 183,4 ± 9,8 | 120,5 ± 8,6 | 1,5 ± 0,9 | 34,2 ± 3,5 |
| Калий, ммоль/л | 4,3 ± 1,2 | 4,2 ± 0,8 | 4,1 ± 0,8 | 4,0 ± 0,6 | 2,32 ± 1,3 | 2,3 ± 1,1 |
| Натрий, ммоль/л | 138 ± 12,5 | 137 ± 10,3 | 137 ± 10,2 | 136 ± 9,7 | 0,72 ± 0,5 | 0,6 ± 0,06 |
Примечание: Сокращения: АЛТ – аланинаминотрансфераза, АСТ – аспартатаминотрансфераза. Данные представлены как среднее значение и стандартное отклонение (M±SD). *Достоверность различий с исходным показателем при р <0,05.
Исходный уровень электролитов плазмы в обеих группах был в пределах нормы. Процедуры селективной плазмосорбции не оказывали влияния на уровень электролитов плазмы.
После проведения плазмообмена у 4 пациентов отмечались посттрансфузионные реакции в виде озноба, кожных высыпаний в виде крапивницы, зуда, повышения температуры тела до 38,0 º С. Эти симптомы появились примерно через 1,5 – 2 час после окончания процедуры плазмообмена и купировались внутривенным введением антигистаминных препаратов, преднизолона и 10% раствора хлористого кальция.
Обсуждение
Мы наблюдали у части больных снижение артериального давления, оно носило временный характер, максимальное снижение среднего артериального давления до указанных показателей наблюдали у 2 х пациентов первой группы и у 1 пациента второй группы. При этом показатели АД составляли 82/57 мм рт ст. и 79/56 мм рт ст. Объясняется это несколькими причина: во-первых, состояние многих пациентов было тяжелым. Печеночная недостаточность, независимо от её причины, часто связана с гемодинамической нестабильностью, при этом снижается системное сосудистое сопротивление и среднее артериальное давление, в этих условиях эксфузия крови в экстракорпоральный контур также оказывала негативное воздействие на гемодинамику. Во-вторых – имеются данные, что на колонке «Plasorba BR-350» сорбируется кортизол (патент на изобретение №2607193 «Способ лечения желтухи у больных острой печёночной недостаточностью», зарегистрированный в Государственном реестре изобретений РФ 10.01.2017 г). Возникающее в связи с этим снижение уровня кортизола крови может приводить к снижению артериального давления, которое может быть купировано внутривенным введением преднизолона. В-третьих, одной из причин снижения артериального давления может быть усиление ваготропного эффекта, связанного с дисбалансом между парасимпатическим и симпатическим отделами нервной системы у больных с механической желтухой [15, С. 22]. После окончания процедур у больных исследуемых групп стабилизировалась гемодинамика, скорее всего это было связано с коррекцией эндотоксикоза и адекватным лечением.
Таким образом можно утверждать, что селективная плазмосорбция и плазмообмен при печёночной недостаточности у пациентов с механической желтухой положительно влияют на динамику биохимических показателей. Улучшение влияния плазмообмена согласуется с литературными данными [16, С. 76]. Полученные результаты позволяют нам сделать вывод о снижении уровней билирубина, АСТ, АЛТ, желчных кислот после проведения СПС и ПО. Так, билирубин снизился на 39,8 ± 3,8% после СПС и на 38,5±6,4% после ПО. Динамика снижения неконъюгированного билирубина отличалась на 5% в пользу СПС. Снижение желчных кислот признаны равнозначными в обеих группах и составляли немного больше 30%. В динамике некоторых биохимических показателей статистически значимых различий отмечено не было, возможно это обусловлено малым количеством наблюдений. При анализе предварительных результатов, была отмечена чётко однонаправленная тенденция к улучшению анализируемых показателей. Это позволяет нам считать, что предварительные результаты нашего исследования являются удовлетворительными. Следует отметить, что в целом при равнозначном эффекте, для достижения нужного уровня детоксикации необходимо соблюдение принципа достаточного объёма эксфузии плазмы при проведении плазмообмена, что, в свою очередь, требует адекватного восполнения СЗП и раствором альбумина. Увеличение объёма введения компонентов и препаратов крови может способствовать увеличению числа посттрансфузионных осложнений. В нашем исследовании отмечен больший процент (в 2-3 раза больше) снижения общего белка и альбумина при проведении плазмообмена, чем при плазмосорбции даже при адекватном его восполнении. Так, после проведения селективной плазмосорбции уровень общего белка снизился на 2,05 ± 0,8 %, уровень альбумина снижался на 3,9 ± 2,4%. После плазмообмена уровень снижения общего белка составлял 6,6±1,0%, уровень снижения альбумина составлял 6,5±1,3%. Не смотря на отсутствие достоверного снижения уровня белка в обеих группах, содержание белка во 2 группе было более значимым и превышало уровень снижения белка в 1 группе.
При проведении плазмообмена мы не можем не рассматривать риски посттрансфузионных осложнений и аллергических реакций у данной категории больных, связанных с введением донорской плазмы и альбумина, что уже само по себе снижает уровень безопасности этой процедуры. Следует учитывать, что при плазмообмене для восполнения белковых и жидкостных потерь использовали 5% раствор альбумина и донорскую СЗП. Преимуществом селективной плазмосорбции является отсутствие необходимости в введении раствора альбумина и донорской плазмы, что уменьшает риск посттрансфузионных осложнений и повышает уровень безопасности по сравнению с плазмообменом. Кроме того, при СПС снижается риск заражения опасными инфекционными заболеваниями такими как ВИЧ, гепатиты В и С [17, С.105].
Смертность в нашем исследовании составила 5,5% и 7,14% в первой и во второй группах соответственно. Умерли по 1 пациенту из обеих групп после оперативного лечения, на 31 сутки - из I группы и на 28 сутки - из II группы. Причиной смерти в обеих группах было наличие у пациентов гнойного холангита, осложнившегося сепсисом и синдромом полиорганной недостаточности. Длительность желтухи этих пациентов варьировала от 10 до 12 недель. Смертности в обеих группах считается сопоставимой.
Выводы
- Мы считаем, что селективная плазмосорбция и плазмообмен являются достаточно безопасными и эффективными экстракорпоральными методами при печёночной недостаточности у больных с механической желтухой, особенно при длительном желтушном периоде. Эти методы позволяют корригировать эндотоксикоз при высоком уровне билирубина перед операцией, а также в послеоперационном периоде.
- Отмечено, что селективная плазмосорбция имеет преимущества в сравнении с плазмообменом. Потери белка и альбумина после селективной плазмосорбции минимальны и нет необходимости в дополнительной трансфузии донорской плазмы и альбумина, что повышает уровень безопасности этой процедуры и исключает возможность развития связанных с этим осложнений.
- При проведении плазмообмена отмечалось снижение общего белка на 6,5% и альбумина на 3,9%, чего не отмечалось в ходе селективной плазмосорбции. Это говорит не только о селективности сорбента, но и о большей безопасности селективной плазмосорбции в сравнении с плазмообменом.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Хорошилов С. Е. Острая (молниеносная) и острая/хроническая печеночная недостаточность: возможности коррекции альбуминовым диализом на аппарате MARS. Российский журнал гастроэнтерологии, гепатологии, колопроктологии / С. Е. Хорошилов, С. Г. Половников, В. Л. Асташев и др. 2007:17(2) С. 57–62.
- Гальперин Э.И, Семендяева М.Н, Неклюдова Е.А.. М.: Медицина; 1978. 328 с.
- Натальский А. А. Недостаточность печени. Современные представления о печёночной недостаточности в хирургии / А. А. Натальский, С. В. Тарасенк, О. В. Зайцев и др. // Российский медико-биологический вестник имени академика И.П. Павлова. 2014;(4) С. 138–47.
- Бокерия Л. А. . Руководство по экстракорпоральному очищению крови / Л. А. Бокерия М. Б. Ярустовский // ред. М.: НЦССХ им. А.Н. Бакулева РАМН; 2009. 468 с
- Фомин А. М. Селективная плазмофильтрация при механической желтухе. Эфферентная терапия / А. М. Фомин, Л. С. Ладенкова, В. Ю. Бабушкин 2013;19(1) С. 108–9.
- Симутис И. С. Экспериментально-клиническое обоснование применения озонмодифицированных гемосорбентов в интенсивной терапии механической желтухи. Диссертация на соискание учёной степени кандидата медицинских наук // И. С. Симутис. Нижний Новгород 2006: 8 - 28.
- Семёнов В. Б. Метаболическая коррекция желчеоттока при механической желтухе. // Анестезиология и реаниматология / В. Б. Семёнов, А. Ю. Яковлев, Р. М. Зайцев. 2012;(2). С. 58 – 61.
- Ивашкин В. Т. Болезни печени и желчевыводящих путей: руководство для врачей / В. Т. Ивашкин. М.: М-Вести; 2005. 416.
- Еремеева Л. Ф. Экстракорпоральные методы лечения у пациентов с печеночно-клеточной недостаточностью. Актуальные проблемы транспортной медицины / Л. Ф. Еремеева, А. Ф. Ямпольский. 2010;(4). С. 139–49.
- Садыков Р. А. Терапевтический плазмаферез на этапе экстракорпоральной детоксикации / Р. А. Садыков, О. В. Ким, З. Р. Хайбуллина // Вестник интенсивной терапии. 2015;(4). С. 49-52
- Ярустовский М. Б. Экстракорпоральные методы гемокоррекции при острой печёночной недостаточности у пациентов после кардиохирургических вмешательств. Анестезиология и реаниматология // М. Б. Ярустовский, М. В. Абрамян, Е. В. Комардина и др. 2014;(5). С. 4-10.
- Синьков С. В. Прогнозирование различных форм послеоперационной острой печеночной недостаточности. Анестезиология и реаниматология / С. В. Синьков, И. В. Жилин, И. Б. Заболотских. 2017;62(1). С. 73-76
- Иоффе И. В. Печеночная недостаточность у больных с механической желтухой неопухолевого генеза / И. В. Иоффе, В. П. Потеряхин // Український журнал клінічної та лабораторної медицини. 2009;4(3). С. 130–2.
- Морозов А. С. Сорбенты для экстракорпорального удаления токсических веществ и молекул с нежелательной биологической активностью (обзор) / А. С. Морозов, И. В. Бессонов, А. В. Нуждина и др. // Общая реаниматология. 2016:12(6). С. 82–107.
- Бирюшев В. И. Оптимизированный плазмаферез в комплексном лечении механической желтухи. Автореферат диссертации на соискание учёной степени кандидата медицинских наук / В. И. Бирюшев 1992; 21-23 с.
- Кутепов Д. Е. Использование экстракорпоральных методов лечения печёночной недостаточности / Д. Е. Кутепов // Казанский медицинский журнал. 2014: 95(1). С. 75-79.
- Фомин А. М. Оценка эффективности плазмосорбции (Liver Support) при печёночной недостаточности у больных с механической желтухой. Альманах клинической медицины / А. М. Фомин, А. И. Лобаков, Г. В. Титова и др. 2015(40). С. 101-108.
Список литературы на английском языке / References in English
- Khoroshilov S. E. Ostraya (molnienosnaya) i ostraya/khronicheskaya pechenochnaya nedostatochnost': vozmozhnosti korrektsii al'buminovym dializom na apparate MARS [Acute (lightning) and acute / chronic liver failure: the possibility of correction for albumin dialysis unit MARS ] // S. E. Khoroshilov, S. G. Polovnikov, V. L. Astashev and others // Rossijskij zhurnal gastroehnterologii, gepatologii, koloproktologii [Russian Journal of Gastroenterology, Hepatology, Coloproctology] 2007:17(2):57–62 [in Russian]
- Gal’perin E. I. Nedostatochnost’ pecheni [Liver failure] // E. I. Gal’perin, M. N. Semendyaeva, E. A. Neklyudova. Мoscow: Меditsina; 1978. 328 p. [in Russian]
- Natal’skiy A. A. Sovremennye predstavleniya o pechenochnoy nedostatochnosti v khirurgii [Modern understanding of liver failure in surgery] // A. A. Natal’skiy, S. V. Tarasenko, O. V. Zaytsev and others // Rossiyskiy mediko-biologicheskiy vestnik imeni akademika I. P. Pavlova [Russian Medical and Biological Bulletin named after academician I. P. Pavlov]. 2014;(4):138–47 [in Russian]
- Bokeriya L. A. Rukovodstvo po ekstrakorporal’nomu ochishcheniyu krovi [Guidelines for extracorporeal blood purification] / L. A. Bokeriya, M. B. Yaroustovskiy. Moscow: NTsSSKh im. A.N. Bakuleva RAMN [Bakulev Scientific Center for Cardiovascular Surgery]; 2009. 468 p. [in Russian]
- Fomin A. M. Selektivnaya plazmofil'tratsiya pri mekhanicheskoy zheltukhe [Coupled plasma filtration adsorption in abdominal severe sepsis . Efferent Therapy] // A. M. Fomin, L. S. Ladenkova, V. Yu. Babushkin. 2013;19(1):108–9 [in Russian]
- Simutis I. S. Eksperimental’no-klinicheskoe obosnovanie primeneniya ozonmodifitsirovannyh haemosorbentov v intensivnoy terapii mekhanicheskoy jeltukhi [Experimental-clinical substantiation of application of hemosorbents ozonedepleting in intensive therapy of obstructive jaundice]. Dissertatsiya na soiskaniye ucheonoy stepeny kandidata medicinskych nauk. Nijniy Novgorod 2006. P. 8 - 28. [in Russian]
- Semeonov V. B. Metabolicheskaya correktsiya jelcheottoka pri mekhanicheskoy jeltukche [Metabolic correction of bile flow in mechanical jaundice] / V. B. Semeonov, A. Yu. Yakovlev, R. M. Zaytsev and others. // Anesteziologiya i reanimatologiya [Anesthesiology and reanimatology] 2012;(2):58 – 61[in Russian]
- Ivashkin V. T. Bolezni pecheni i zhelchevyvodyashchikh putey: rukovodstvo dlya vrachey [Diseases of the liver and biliary tract: a guide for doctors] / V. T. Ivashkin. Moscow: M-Vesti; 2005. 416 p. [in Russian]
- Eremeeva L. F. Ekstrakorporal'nye metody lecheniya u patsientov s pechenochno-kletochnoy nedostatochnost'yu [Eхtracorporal methods of treatment in patients with hepatocellular insufficiency. Actual problems of transport medicine] // L. F. Eremeeva, A. F. Yampol'skiy. 2010;(4):139–49 [in Russian]
- Sadykov R. A.Terapevtichesky plasmafers na etape ekstrakorporal’noy detoxikatsii [Therapeutic apheresis at the Stage of extracorporeal detoxification] / R. A. Sadykov, O. V. Kim, Z. R. Khaybullina // Vestnik intensivnoj terapii [The Bulletin of intensive therapy]. 2015(4) P. 49-52 [in Russian]
- Yaroustovskiy M. B. Ekstrakorporal’nye metody haemokorrektsii pri ostroy pecheonochnoy nedostatochnosti u patsientov posle kardiokhirurgicheskyh vmeshatelstv [Artificial liver support devices in patients with acute liver failure after cardiac surgery] / M. B. Yaroustovskiy, M. V. Abramyan, E. V. Komardina and others // Anesteziologiya i reanimatologiy Anesteziologiya i reanimatologiy [Anesthesiology and reanimatology]. 2014:(5). P. 4-10 [in Russian]
- Sin'kov S. V. Prognozirovanie razlichnyh form posleoperatsionnoy ostroy pecheonochnoy nedostatochnosti [The prediction of the various forms of postoperative acute liver failure] / S. V. Sin'kov, I. V. Jilin, I. B. Zabolotskych // Anesteziologiya i reanimatologiy [Anesthesiology and reanimatology] 2017; 62(1). P. 73-76 (in Russian).
- Ioffe I. V. Pechenochnaya nedostatochnost' u bol'nykh s mekhanicheskoy zheltukhoy neopukholevogo geneza [Liver insufficiency in patients with mechanical jaundice caused by choledocholithiasis] // I. V. Ioffe, V. P. Poteryakhin // Ukraїns'kij zhurnal klіnіchnoї ta laboratornoї medicini [Ukrainian Journal of Clinical and Laboratory Medicine]. 2009:4(3):130–2 [in Russian]
- Morozov A. S. Sorbenty dlya ekstrakorporal’nogo udaleniya toxicheskih veschestv i molecule c nejelatel’noy biologicheskoy aktivnost’yu (obzor) [Sorbents for extracorporeal removal of toxic substances and unwanted molecules with biological activity (review)] // A. S. Morozov, I. V. Bessonov, A. V. Nuzhdina // Obshchaya reanimatologiya [General reanimatology]. 2016:12(6):82–107 [in Russian]
- Birushev V. I. Optimizirovanny plasmafers v complexnom lechenii mekhanicheskoy zheltukhi [Optimized apheresis in the complex treatment of mechanical jaundice] / V. I. Birushev // Autoreferat dissertatsii na soiskaniye ucheonoy stepeni kandidata meditsinskyh nauk [Abstract of the thesis for the degree of candidate of medical Sciences]. 1992; P. 21-23.
- Kutepov D. E. Ispolʼzovaniye ekstrakorporal’nyh metodov lecheniya pecheonochnoy nedostatochnosti [Use of extracorporeal methods of treatment of liver failure] / D. E. Kutepov // Kazanskij medicinskij zhurnal [Kazan medical journal] 2014: 95(1) P. 75-79. [in Russian]
- Fomin A. M. Otcenka effektivnosty plasmosorbtsiyi (Liver Support) pri pecheonochnoy nedostatochnosti u bolʼnyh s mekhanicheskoy zjeltuchoy [Efficiency of plasma adsorption (liver support) in patients with mechanical jaundice complicated with liver failure] / A. M. Fomin, A. I. Lobakov, G. V. Titova and others // Almanac of Clinical Medicine [Almanac of clinical medicine]. 2015(40). P. 101-108. [in Russian]
