МОРФОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ЗАЖИВЛЕНИЯ ИШЕМИЗИРОВАННОЙ ЭКСПЕРИМЕНТАЛЬНОЙ РАНЫ НА 12 СУТКИ ПОСЛЕ ПРИМЕНЕНИЯ АУТО- И ГЕТЕРОФИБРОБЛАСТОВ И ДЕРМАЛЬНОГО ЭКВИВАЛЕНТА
Шаповалова Е.Ю.1, Бойко Т. А.2, Барановский Ю.Г.3, Харченко С.В.4, Юнси Г.А.5
1ORCID: 0000-0003-2544-7696, Доктор медицинских наук, профессор, 2ORCID: 0000-0002-9627-4051, Кандидат медицинских наук, доцент, 3ORCID: 0000-0002-7044-1122, Кандидат медицинских наук, доцент, 4ORCID: 0000-0002-9434-3789, Кандидат медицинских наук, доцент, 5ORCID: 0000-0003-2965-4975, Кандидат медицинских наук, доцент, ФГАОУ ВО «Крымский федеральный университет им. В.И. Вернадского»,г. Симферополь
МОРФОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ЗАЖИВЛЕНИЯ ИШЕМИЗИРОВАННОЙ ЭКСПЕРИМЕНТАЛЬНОЙ РАНЫ НА 12 СУТКИ ПОСЛЕ ПРИМЕНЕНИЯ АУТО- И ГЕТЕРОФИБРОБЛАСТОВ И ДЕРМАЛЬНОГО ЭКВИВАЛЕНТА
Аннонация
Исследование выполнено на 28 белых половозрелых мышах линии С57/В1 в возрасте до 1 года. Вокруг и в дно хирургической модельной кожной раны в лопаточной области вводили 0,4 мл взвеси фибробластов и дермальный эквивалент в ростовой среде DMEM F12 (Lonza) в количестве 1,33 млн клеток. Рубец заливали в парафин, окрашивали гематоксилином и эозином. На 12-й день эпидермис имеет большую толщину после введения аутофибробластов, но дифференцированнее после трансплантации дермального эквивалента с гетерофибробластами. Ангиогенез и коллагеногенез активнее стимулируется аутофибробластами. Регенераторный гистогенез сравнительно одинаково протекает на фоне присутствия аутофибробластов и дермального эквивалента с гетерофибробластами.
Ключевые слова: регенераторный гистогенез, дермальный эквивалент, фибробласт, рубцы, ангиогенез.
Shapovalova E.Yu.1, Boyko T.A.2, Baranovsky Yu.G.3, Kharchenko S.V.4, Yunsi G.A.5
1ORCID: 0000-0003-2544-7696, MD, Professor, 2ORCID: 0000-0002-9627-4051, MD, Associate Professor, 3ORCID: 0000-0002-7044-1122, MD, Associate Professor, 4ORCID: 0000-0002-9434-3789, MD, Associate Professor, 5ORCID: 0000-0003-2965-4975, MD, Associate Professor, FGAOU VO "Crimean Federal University named after V.I. Vernadsky ",Simferopol
MORPHOLOGICAL CHARACTERISTICS OF ISCHEMIZING EXPERIMENTAL WAIST HEALING ON THE 12TH DAY AFTER AUTO- AND HETEROFIBROBLASTS AND DERMAL EQUIVALENT USE
Abstract
The study was performed on 28 1-year-old white mature mice of the C57/B1 line. 0.4 ml of fibroblast suspension and dermal equivalent in the growth medium DMEM F12 (Lonza) in an amount of 1.33 million cells were injected into and around the bottom of the surgical model skin wound in the scapular region. The scar was poured into paraffin, stained with hematoxylin and eosin. On the 12th day the epidermis is thicker after administration of auto-fibroblasts but more differentiated after transplantation with dermal equivalent with heterofibroblasts. Angiogenesis and collagenogenesis are more actively stimulated by auto-fibroblasts. Regenerative histogenesis comparatively identical proceeds against the background of the presence of autofibroblasts and a dermal equivalent with heterobifroblasts.
Keywords: regenerative histogenesis, dermal equivalent, fibroblast, scars, angiogenesis.
Лечение длительно незаживающих дефектов кожного покрова остается нерешенной как медицинской, так и социально-экономической проблемой. К длительно незаживающим ранам относятся трофические язвы любой этиологии, пролежни, раны, развивающиеся на месте травмы или оперативного вмешательства, в результате отморожения, термического, химического поражения кожного покрова [1, С. 27]. Все эти процессы объединяются по клиническому течению и событиям, происходящим на клеточном и субклеточном уровнях [2, С. 8]. Большой процент рецидивов длительно незаживающих ран (например, трофических язв) свидетельствует об отсутствии эффективных подходов в лечении этого заболевания [3, С. 7]. Исследование в области клеточных технологий является одним из самых перспективных направлений в лечении такой патологии [4, С. 17], [5, С. 99], [6, С. 34].
Однако только экспериментальный подход с использованием лабораторных животных позволяет адекватно оценить клеточные взаимодействия, которые разворачиваются в разные сроки регенераторного гистогенеза после трансплантации ауто- и гетерофибробластов, а также тканевых конструкций на базе этих клеток. Сведения о тканевых перестройках после такой трансплантации в доступной литературе немногочисленны и кратки [7, С. 219], [8, С. 103], [9, С. 395].
Цель исследования. Изучить морфологическое строение, коллагенообразование и ангиогенез в биоптатах новообразованного эпидермиса и дермы на 12-е сутки их восстановления в модельной ишемизированной ране после введения ауто- и гетерофибробластов, а также после трансплантации дермального эквивалента с гетерофибробластами.
Материал и методы Исследование выполнено на 28 белых половозрелых мышах линии С57/В1 в возрасте до 1 года, которые содержались в виварии Медицинской академии имени С.И. Георгиевского. Животные были разделены на контрольную группу в составе 7 особей и три экспериментальные группы по 7 особей в каждой. Эксперименты проводили со следованием всем принципам гуманности, содержащихся в директиве Европейского Сообщества (86/609/ЕС), и в соответствии с «Правилами выполнения работ с привлечением экспериментальных животных». Во всех группах операцию по моделированию кожной раны в лопаточной области производили после внутрибрюшинного введения 2,5% раствора авертина 0,3-0,4 мл. Кожу однотипно иссекали в виде круга диаметром 12 мм, к краям раны кожно-фасциальными узловыми швами фиксировалось силиконовое кольцо с наружным диаметром 12 мм атравматичным шовным материалом «Полипропилен» 5-0 для исключения возможности эпителизации раны и закрытия её мобильной кожей области спины. Ишемизацию раны проводили путем наложения кисетного шва нитью «Полипропилен» 5-0 на расстоянии 1,0 см латеральнее наружного диаметра раны, что нарушает циркуляцию крови в системе около лопаточных артерий мыши. Артериальный анастомоз вокруг лопаток образован ветвью подмышечной артерии a. Circularis scapula и ветвью поперечной артерии шеи Ramus descendense, отходящей от подключичного Truncus thiriocervicales. Из иссеченной кожи мышей выделяли фибробласты в условиях стерильного бокса с ламинарным потоком воздуха. Кусочки кожи после ферментативного удаления эпидермиса помещали в среду DMEM F12 (Lonza) и измельчали сосудистыми ножницами до размера 1-2 мм. Затем к кусочкам ткани добавляли равные объемы растворов коллагеназы I типа (200 ед/мл, Sigma) и диспазы (30 ед/мл) (Gibco). Полученную смесь инкубировали в течение 1 часа при 370 С и постоянном перемешивании. После фильтрации суспензии через фильтр диаметром 0,40мкм и центрифугирования в течение 7 мин. при 1000 об/мин, фибробласты ресуспендировали и культивировали в среде DMEM F12 (Lonza) с добавлением 10% телячьей сыворотки (HyClone) и 50 ед./мл пенициллина - стрептомицина (ПанЭко) в чашках Петри в инкубаторе при 370 и концентрации СО2 – 5% до достижения 100% конфлюента. Для пересева клеток использовали 0,25% трипсин-0,02% ЭДТА.
В первой и второй экспериментальных группах интраоперационно в дно раны и вокруг нее вводили 0,4 мл взвеси фибробластов 1-го или 2-го пассажа в ростовой среде DMEM F12 (Lonza) в количестве 1,33 млн клеток. В первой экспериментальной группе вводили гетерофибробласты, во второй – аутофибробласты. В третьей экспериментальной группе в рану трансплантировали дермальный эквивалент с гетерофибробластами, приготовленный на основе коллагена первого типа из крысиных хвостов. Стерильный 0,34М раствор NaOH объединяли с концентрированной (х10) питательной средой 199 в соотношении 1:1. Полученную смесь соединяли с охлажденным раствором коллагена, после чего добавляли суспензию фибробластов в питательной среде DMEM F12, содержащей 10% эмбриональной сыворотки (HyClone). Полученную смесь инкубировали при 370 С в инкубаторе до полной полимеризации геля [7, С. 211].
На 12-й день после операции у мышей всех групп интраоперационно иссекали образовавшийся рубец и фиксировали 10% забуференным формалином для морфологического исследования. Материал заливали в парафин и окрашивали гематоксилином и эозином, а также по Вейгерту-Ван-Гизону для визуализации эластических и коллагеновых волокон. Морфологическое исследование гистологических препаратов проводили с помощью светооптического микроскопа OLIMPUS СХ-31 с цифровой камерой OLIMPUS З5050Z. Толщину эпидермиса, количество микрососудов в срезах, площадь коллагеновых волокон и микрососудов в дерме рубцов измеряли с помощью программы "ImageJ" при увеличении объектива 40 и окуляра 10 по 50 замеров в каждой группе. Полученные цифровые данные (выраженные в пикселях) были переведены в мкм при помощи деления пикселей на коэффициенты, специально для этого выведенные: объективы х10 – 6379251, х40 – 98911797. Статистическую обработку цифровых данных проводили с использованием лицензионного программного обеспечения Microsoft Office Excell и Statistica 10.0. Сравнения средней толщины эпидермиса, площади, занимаемой коллагеновыми волокнами и сосудами грануляционной ткани, в рубцах экспериментальных групп проводили в процентах по отношению к контрольной группе.
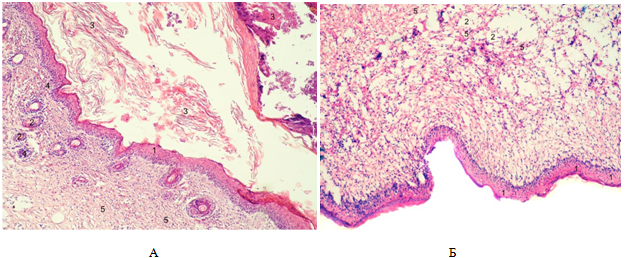
Рис. 1 – Рубцы кожи мыши. А – контрольная группа; Б –экспериментальная группа №1. 1 – эпидермис; 2 – кровеносный сосуд; 3 – струп; 4 – лейкоцитарная инфильтрация; 5 – коллагеновые волокна. Окраска гематоксилином и эозином. Увеличение: ок. 10 об. 10
Результаты исследования и их обсуждение. У мышей контрольной группы самопроизвольное отпадение силиконового кольца было зафиксировано в среднем на 12,4+0,10 сутки после операции по созданию модельной раны. Под толстыми остатками струпа обнаруживалась полная эпителизация раны. На срезах рубца эпидермис представлен не полностью сформированным многослойным эпителием толщиной 51,73+0,12мкм (таблица 1). Имеется базальный слой и несколько рядов шиповатых клеток. Роговой слой очень тонкий и находится на начальных стадиях дифференцировки клеток (рис. 1А). Над эпидермисом видны остатки струпа, в котором клеточные элементы уже отсутствуют. Дерма рубца не образует
сосочков вдающихся в эпидермис и граница между эпидермисом и дермой рыхлая и ровная. Под базальной мембраной заметен тонкий вал лейкоцитарной инфильтрации. Весь кожный дефект заполнен развивающейся грануляционной тканью, в которой встречаются клетки тканевого и гематогенного происхождения. Сосочковый и сетчатый слои дермы не разграничиваются и образованы равномерно локализованными коллагеновыми волокнами, между которыми присутствуют клетки, представленные, преимущественно, функционально активными фибробластами. Коллагеновые волокна занимают 29,70+0,16% от площади дермы. Эластические волокна отсутствуют. Немногочисленные кровеносные капилляры и венулы расширены и их площадь составляет 0,69+0,02мкм. Вокруг них просматривается слабая лейкоцитарная инфильтрация.
Таблица 1 – Количественные характеристики рубцов кожи мышей контрольной и экспериментальных групп
| Рубцы кожи | Толщина эпидермиса в мкм | Площадь дермы на срезах в мкм | Площадь сосудов в дерме в % | Площадь коллагеновых волокон в дерме в % |
| Рубцы кожи в контрольной группе | 51,73+0,12 | 46259,83+1,20 | 0,69+0,02 | 29,70+0,16 |
| Рубцы кожи в первой экспериментальной группе | 61,48+0,14 | 44692,70+1,05 | 0,82+0,02 | 33,43+0,15 |
| Рубцы кожи во второй экспериментальной группе | 106,49+0,17 | 34128,13+1,13 | 1,73+0,01 | 40,76+0,24 |
| Рубцы кожи в третьей экспериментальной группе | 91,67+0,14 | 47439,58+1,17 | 1,03+0,01 | 38,81+0,12 |
У мышей первой экспериментальной группы эпителизация раны и отпадение силиконового кольца зафиксировано на один день раньше, чем в контроле, а именно на 11,4+0,06 сутки после операции и введения взвеси гетерофибробластов на ростовой среде ДМЕМ F12. Струп полностью отделился от раневого дефекта. При этом толщина эпидермиса была на 15,86% больше, чем в группе контроля, и составляла 61,48+0,14мкм. В тоже время эпидермис не полностью сформирован и состоит из малодифференцированных трех слоев: базального, шиповатого и рогового. Роговой слой просматривается участками (рис. 2Б). Базальная мембрана ровная, лейкоцитарная инфильтрация отсутствует. Грануляционная ткань под эпидермисом представлена тонкими пучками неориентированных коллагеновых волокон, кровеносными сосудами и клеточными элементами. Коллагеновые волокна занимают, в среднем, 33,43+0,15% от площади дермы, что на 11,16% больше, чем в контрольной группе. Эластические волокна отсутствуют во всех участках дермы. Площадь кровеносных капилляров больше на 15,86% по сравнению с группой контроля.
У мышей второй экспериментальной группы на фоне введения взвеси аутофибробластов в ростовой среде ДМЕМ F12 эпителизация раны и отпадение силиконового кольца зафиксировано еще раньше, чем в контроле и первой экспериментальной группе – на 11,00+0,01 день после операции. Течение регенераторного гистогенеза произошло более благоприятно. С поверхности эпидермиса струп полностью отделился. Толщина эпидермиса была на 51,42% больше, чем в контрольной группе. Значительно более дифференцированными были слои эпидермиса. На поверхности заметен выраженный роговой слой (рис. 2А). Наметилось появление сосочкового слоя дермы в виде волнистой границы между базальной мембраной эпидермиса и подлежащей грануляционной тканью. Грануляционная ткань характеризуется во второй группе
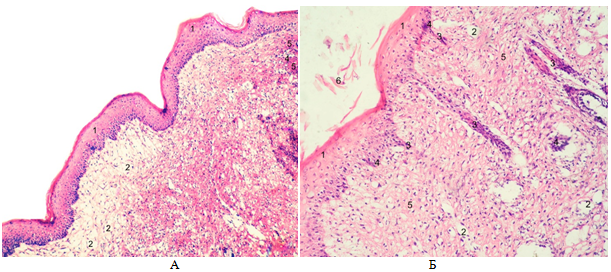
Рис. 2 – Рубцы кожи мыши. А –экспериментальная группа №2; Б –экспериментальная группа №3. 1 – эпидермис; 2 – кровеносный сосуд; 3 – волосяной фолликул; 4 – фибробласты; 5 – коллагеновые волокна; 6 - струп. Окраска гематоксилином и эозином. Увеличение рис.2А ок. 10 об. 10. Увеличение рис.2Б ок. 10 об. 20
усилением процессов ангиогенеза и коллагенообразования. Площадь, занятая коллагеновыми волокнами, увеличилась на 27,13% и составила 40,76+0,24 мкм, а сосудов – на 39,88% и составила 1,73+0,01мкм (см. табл. 1). Лейкоцитарная инфильтрация отсутствовала. Клеточные элементы фибробластического ряда были представлены крупными и вытянутыми отростчатыми клетками, что свидетельствовало об их функциональной активности. Эластические волокна отсутствовали во всех участках дермы.
У мышей третьей экспериментальной группы на 12,20+0,11 день после трансплантации дермального эквивалента с гетерофибробластами рана была покрыта тонким слоем бесструктурного струпа. Отпадение силиконового кольца фиксировалось на 12,20+0,11 день после операции. Однако эпидермис выглядел более дифференцированным, чем в предыдущих группах. Присутствовали и были развиты все слои эпидермиса, кроме блестящего и зернистого. Толщина эпидермиса составляла 91,67+0,14 мкм, что на 43,57% больше, чем в группе контроля. Эпидермис образовывал выросты в подлежащую грануляционную ткань, являющимися закладкой волос и сосочкового слоя дермы (рис. 2Б). Площадь, занятая коллагеновыми волокнами, увеличилась на 23,47% по сравнению с группой контроля и составила 38,81+0,12 мкм, а сосудов – на 33,00% и составила 1,03+0,01мкм (см. табл. 1). Тонкие неориентированные пучки коллагеновых волокон заполняли всю дерму рубца.
Выводы. 1. На 12-й день регенераторного гистогенеза эпидермис достигает наибольшей толщины после введения аутофибробластов, а наибольшей выраженности дифференцировки после трансплантации в рану дермального эквивалента с гетерофибробластами.
- Ангиогенез наиболее выражен в грануляционной ткани будущей дермы после введения аутофибробластов.
- Продукция коллагеновых волокон клетками фибробластического ряда грануляционной ткани наиболее активна на фоне трансплантации в рану аутофибробластов и дермального эквивалента с гетерофибробластами.
- Благоприятное воздействие дермального эквивалента с гетерофибробластами отличается от воздействия взвеси аутофибробластов всего на несколько процентов: площадь коллагеновых волокон – на 2%, площадь кровеносных сосудов – на 5%, что делает такие различия недостоверными.
Список литературы / References
- Гавриленко А.В. Опыт использования клеточных технологий в комплексном лечении венозных трофических язв / А.В. Гавриленко, О.В. Павлова, А.А. Иванов и др. // Хирургия. Журнал им. Н.И. Пирогова. – 2011. - № 1, Т. 27. – С. 27-31.
- Федоров Д.Н. Морфологическая и иммуногистохимическая характеристика репаративных процессов в длительно незаживающих ранах / Д.Н. Федоров, А.Н. Ивашкин, А.В. Васильев и др. // Арх патол. – 2002. - № 1. – С. 8-11.
- Хрупкин В.И. Дерматопластика раневых дефектов / В.И. Хрупкин, В.Ф. Зубрицкий, А.Н. Ивашкин и др. – М: ГЭОТАР-Медиа, 2009. – 102 с.
- Малахов С.Ф. Новые подходы к лечению тяжелых ожогов: трансплантация выращенных в культуре кератиноцитов / С.Ф. Малахов, Б.А. Парамонов, А.В. Емельянов и др. // Военно- мед журн. – 1997. - № 9,Т. CCCXVIII.– С. 16-19.
- Сергиенко Н.Ф. Лечение мочевых свищей с применением культуры аллогенных фибробластов / Н.Ф. Сергиенко, А.С. Девятов, Л.В. Шаплыгин и др. // Урология. – 1999. - № 1. – С. 99.
- Kolokol’tseva T.D. Prospects of use human fetal fibroblasts in the treatment of various etiology wounds / T.D. Kolokol’tseva, N.D. Iurcnenko, N.G. Kolosov and others. // Vestn Ross Akad Med Nauk. – 1998. – N3. – P. 32-35.
- Юдинцева Н.М. Дермальный эквивалент на основе фибрина и восстановление соединительной ткани в результате его трансплантации на раны экспериментальных животных / Н.М. Юдинцева, И.А. Самусенко, М.И. Блинова и др. // Аутологичные стволовые клетки: экспериментальные исследования и перспективы клинического применения / Под редакцией В.А. Ткачука. – М.: Литтерра, 2009. – С. 209-221.
- Шаповалова Е.Ю. Сравнительная характеристика волокнистого состава рубца после введения ауто- и гетерофибробластов в рану у мышей / Е.Ю. Шаповалова, М.Н. Морозова, Ю.Г. Барановский и др. // Здоровье и образование в XXI веке. – 2017. – Т. 19, №3. – С. 100-104.
- Винник Ю.С. Клеточные технологии и тканевая инженерия в лечении длительно не заживающих ран / Ю.С. Винник, А.Б. Салмина, А.И. Дробушевская и др. // Вестник экспериментальной и клинической хирургии. – 2011. - № 2, Т. IV. – С. 392-397.
Список литературы на английском языке / References in English
- Gavrilenko A.V. Opyt ispol'zovanija kletochnyh tehnologij v kompleksnom lechenii venoznyh troficheskih jazv [Experience in the use of cellular technologies in the complex treatment of venous trophic ulcers] / A.V. Gavrilenko, O.V. Pavlova, A.A. Ivanov and others // Hirurgija. Zhurnal im. N.I. Pirogova [Surgery. N.I. Pirogov journal]. – 2011. - № 1, T. 27. – P. 27-31. [in Russian]
- Fedorov D.N. Morfologicheskaja i immunogistohimicheskaja harakteristika reparativnyh processov v dlitel'no nezazhivajushhih ranah [Morphological and immunohistochemical characteristics of reparative processes in long-term non-healing wounds] / D.N. Fedorov, A.N. Ivashkin, A.V. Vasil'ev and others // Arh patol [Arh. pathol]. – 2002. - № 1. – P. 8-11. [in Russian]
- Hrupkin V.I. Dermatoplastika ranevyh defektov [Dermatoplastic of wound defects] / V.I. Hrupkin, V.F. Zubrickij, A.N. Ivashkin and others. – M: GJeOTAR-Media, 2009. – 102 p. [in Russian]
- Malahov S.F. Novye podhody k lecheniju tjazhelyh ozhogov: transplantacija vyrashhennyh v kul'ture keratinocitov [New approaches to the treatment of severe burns: transplantation of keratinocytes grown in culture] / S.F. Malahov, B.A. Paramonov, A.V. Emel'janov and others // Voenno- med zhurn [Military Medical Journal]. – 1997. - № 9,T. CCCXVIII. – P. 16-19. [in Russian]
- Sergienko N.F. Lechenie mochevyh svishhej s primeneniem kul'tury allogennyh fibroblastov [Treatment of urinary fistulas with the use of allogeneic fibroblasts culture] / N.F. Sergienko, A.S. Devjatov, L.V. Shaplygin and others // Urologija [Urology]. – 1999. - № 1. – P. 99. [in Russian]
- Kolokol’tseva T.D. Prospects of use human fetal fibroblasts in the treatment of various etiology wounds / T.D. Kolokol’tseva, N.D. Iurcnenko, N.G. Kolosov and others. // Vestn Ross Akad Med Nauk. – 1998. – N3. – P. 32-35.
- Judinceva N.M. Dermal'nyj jekvivalent na osnove fibrina i vosstanovlenie soedinitel'noj tkani v rezul'tate ego transplantacii na rany jeksperimental'nyh zhivotnyh [Dermal equivalent on the basis of fibrin and restoration of connective tissue as a result of its transplantation to the wounds of experimental animals] / N.M. Judinceva, I.A. Samusenko, M.I. Blinova and others. // Autologichnye stvolovye kletki: jeksperimental'nye issledovanija i perspektivy klinicheskogo primenenija [Autologous stem cells: experimental studies and clinical application perspectives] / Edited by V.A. Tkachuka. – M.: Litterra, 2009. – P. 209-221. [in Russian]
- Shapovalova E.Ju. Sravnitel'naja harakteristika voloknistogo sostava rubca posle vvedenija auto- i geterofibroblastov v ranu u myshej [Comparative characteristics of the fibrous composition of the hem after the introduction of auto- and heterofibroblasts into the wound in mice] / E.Ju. Shapovalova, M.N. Morozova, Ju.G. Baranovskij and others // Zdorov'e i obrazovanie v XXI veke [Health and education in the XXI century]. – 2017. – T. 19, №3. – P. 100-104. [in Russian]
- Vinnik Ju.S. Kletochnye tehnologii i tkanevaja inzhenerija v lechenii dlitel'no ne zazhivajushhih ran [Cellular technologies and tissue engineering in the treatment of long-term healing wounds] / Ju.S. Vinnik, A.B. Salmina, A.I. Drobushevskaja and others // Vestnik jeksperimental'noj i klinicheskoj hirurgii [Bulletin of Experimental and Clinical Surgery]. – 2011. - № 2, T. IV. – P. 392-397. [in Russian]
