К ВОПРОСУ О ЗАКОНОМЕРНОСТЯХ ЛИПИДНОГО ОБМЕНА У МУЖЧИН МОЛОДОГО И СРЕДНЕГО ВОЗРАСТА С ЛЕГОЧНОЙ ГИПЕРТЕНЗИЕЙ, РАЗВИВШЕЙСЯ ПРИ ИНФАРКТЕ МИОКАРДА
К ВОПРОСУ О ЗАКОНОМЕРНОСТЯХ ЛИПИДНОГО ОБМЕНА У МУЖЧИН МОЛОДОГО И СРЕДНЕГО ВОЗРАСТА С ЛЕГОЧНОЙ ГИПЕРТЕНЗИЕЙ, РАЗВИВШЕЙСЯ ПРИ ИНФАРКТЕ МИОКАРДА
Научная статья
Меньшикова А.Н.1, Епифанов С.Ю.2, Година З.Н.3, Сотников А.В.4, *, Гордиенко А.В.5, Носович Д.В.6, Гончаров С.А.7
1 ORCID: 0000-0001-9422-4969;
2 ORCID: 0000-0003-0269-2541;
3 ORCID: 0000-0001-9330-1977;
4 ORCID: 0000-0002-5913-9088;
5 ORCID: 0000-0002-6901-6436;
6 ORCID: 0000-0003-2891-4747;
7 ORCID: 0000-0001-7406-2616;
1 416 Военный госпиталь Министерства обороны Российской Федерации, Воронеж, Россия;
2 Клиническая больница" Управления делами Президента Российской Федерации, Москва, Россия;
3 Лечебно-реабилитационный клинический центр Министерства обороны Российской Федерации, Москва, Россия;
4, 5, 6, 7 Военно-медицинская академия имени С.М. Кирова Министерства обороны Российской Федерации, Санкт-Петербург, Россия
* Корреспондирующий автор (sotnikovav[at]inbox.ru)
АннотацияАктуальность. Закономерности и значения изменений липидного обмена при легочной гипертензии (ЛГ), сформировавшейся на фоне инфаркта миокарда, недостаточно изучены.Цель: оценить изменения липидного обмена и их значение у мужчин моложе 60 лет c ЛГ, развившейся в подостром периоде ИМ, для уточнения механизмов ее формирования и разработки мероприятий профилактики. Материалы и методы. В исследование включено 436 мужчин 32-60 лет с ИМ. Пациентам выполнялся стандартный диагностический и лечебный алгоритм, с обязательным выполнением липидограммы, в первые 48 часов (1) и в конце третьей недели заболевания (2) на фоне инициации терапии аторвастатином и розувастатином. Исследуемую группу составили 86 пациентов (средний возраст 51,1±6,9 лет) с ЛГ, возникшей в конце третьей недели заболевания при исходно нормальном уровне среднего давления в легочной артерии (СДЛА). В контрольную группу вошли 350 пациентов (51,4±6,1 лет, p=0,98) с нормальным уровнем СДЛА в обе фазы исследования или нормализацией этого показателя в конце подострого периода заболевания. Выполнен сравнительный анализ показателей липидного обмена в выделенных группах и их влияние на риск развития ЛГ в подостром периоде ИМ.
Результаты. В исследуемой группе наблюдали меньшие, чем в контрольной значения коэффициента атерогенности (КА) (4,5±2,0 и 5,6±2,3; р=0,006) и его индекса (общий холестерин (ОХ)/липопротеиды высокой плотности (ЛВП): 5,4±2,0 и 6,6±2,3; р=0,006). В отличие от контрольной группы, в которой уровни триглицеридов (ТГ) уменьшились на 28,4% (р=0,004), липопротеидов очень низкой (ЛОНП) плотности – увеличились на 172.2% (р=0,006), а соотношения липопротеинов низкой плотности (ЛНП)/ЛВП – на 46,8% (р=0,03)), в исследуемой группе значимой динамики за исключением снижения уровня общего холестерина (10,1%; р=0,03) между точками наблюдения не выявлено. Уровни ТГ, ЛОНП, ОХ/ЛВП, ЛНП/ЛВП первых часов ИМ, а также ЛНП, ЛНП/ЛВП, КА, ОХ/ЛВП второй точки наблюдения оказывали влияние на риск развития ЛГ в подостром периоде ИМ.
Выводы. У мужчин моложе 60 лет с ЛГ, развившейся при ИМ, отмечаются более низкие, чем в контроле, уровни КА и ОХ/ЛВП в подостром периоде ИМ, а также – отсутствие значимой динамики от первых часов к завершению подострого периода ИМ атерогенных фракций липидного обмена (ТГ, ЛОНП) и их соотношений (ЛНП/ЛВП). Значения ряда компонентов липидного обмена первых часов ИМ (ТГ, ЛОНП, ОХ/ЛВП, ЛНП/ЛВП) указывают на высокий риск развития ЛГ в подостром его периоде, что целесообразно использовать в прогностическом моделировании.
Ключевые слова: легочная гипертензия, прогнозирование, инфаркт миокарда, профилактика, среднее давление в легочной артерии, мужчины, молодой и средний возраст.
ON THE MATTER OF LIPID METABOLISM PATTERNS TYPICAL FOR THE YOUNG AND MIDDLE-AGED MEN HAVING PULMONARY HYPERTENSION FORMED IN THE SETTING OF MYOCARDIAL INFARCTION
Research article
Menshikova A.N.1, Epifanov S.Yu.2, Godina Z.N.3, Sotnikov A.V.4*,
Gordienko A.V.5, Nosovich D.V.6, Goncharov S.A.7
1 ORCID: 0000-0001-9422-4969;
2 ORCID: 0000-0003-0269-2541;
3 ORCID: 0000-0001-9330-1977;
4 ORCID: 0000-0002-5913-9088;
5 ORCID: 0000-0002-6901-6436;
6 ORCID: 0000-0003-2891-4747;
7 ORCID: 0000-0001-7406-2616;
1 416th Military hospital of the Russian Federation Ministry of Defence, Voronezh, Russia;
2 Clinical Hospital of the Presidential Administration of the Russian Federation, Moscow, Russia;
3 Treatment and rehabilitation clinical centre of the Russian Federation Ministry of Defence Moscow, Russia;
4, 5, 6, 7 S. M. Kirov Military Medical Academy of the Russian Federation Ministry of Defence, Saint Petersburg, Russia
* Corresponding author (sotnikovav[at]inbox.ru)
AbstractTopicality. The regularities and values of changes in lipid metabolism accompanying pulmonary hypertension (PH), formed in the setting of myocardial infarction (MI), are understudied.
The purpose. To evaluate the changes in lipid metabolism and their significance for the men less than 60 years having PH formed during the subacute period of MI to clarify its formation mechanisms and to develop preventive measures.
Materials and methods. The study included 436 men aged from 32 to 60 having MI. Patients underwent a standard diagnostic and therapeutic procedure, including the mandatory lipid profile, during the first 48 hours (1) and at the end of the third week of the disease (2) in the setting of initiated atorvastatin and rosuvastatin treatment. The study group consisted of 86 patients (average age 51.1±6.9 years) having PH, which developed at the end of the third week of the disease at the initially average level of mean pulmonary arterial pressure (mPAP). The control group included 350 patients (51.4±6.1 years of age, p=0.98) with normal mPAP levels during both phases of the study or normalization of this indicant at the end of the subacute period of the disease. A comparative analysis was performed of lipid metabolism indicants in the selected groups and their impact on the risk of PH development during the subacute period of MI.
Findings. The study group demonstrated lower than the control group values of the atherogenic index (4.5±2.0 and 5.6±2.3; p=0.006) and total cholesterol (TC)/high-density lipoproteins (HDL) index (5.4±2.0 and 6.6±2.3; p=0.006). Unlike the control group, in which triglyceride levels decreased by 28.4% (p=0.004), very low-density lipoproteins (vLDL) increased by 172.2% (p=0.006), and the ratio of low-density lipoproteins ((LDL)/HDL – by 46.8% (p=0.03)), the study group demonstrated no significant dynamics between the observation points except for a decrease in total cholesterol (10.1%; p=0.03). The levels of triglycerides, vLDL, TC/HDL, LDL/HDL during MI primary hours, and LDL, LDL/HDL, atherogenic index, TC/HDL of the second observation point had an impact on the risk of PH developing in the MI subacute period.
Conclusions. Men under 60 years of age having PH formed in the setting of MI, demonstrated lower levels of the atherogenic index and TC/HDL during the subacute period of MI, as well as the absence of significant dynamics from the first hours to the end of the subacute period of MI of atherogenic fractions of lipid metabolism (triglycerides, vLDL) and their ratios (LDL/HDL). Values of several lipid metabolism components of the MI first hours (triglycerides, vLDL, TC/HDL, LDL/HDL) indicate the high risk of PH developing during the subacute period, which is advisable to use in predictive modelling.
Keywords: pulmonary hypertension, prognosis, myocardial infarction, preventive measures, mean pulmonary arterial pressure, men, young and middle age.
ВведениеЛегочную гипертензию (ЛГ) при инфаркте миокарда (ИМ) в рамках сердечно-сосудистых заболеваний ряд исследователей относят к ведущей причине заболеваемости и смертности во всем мире, а в развитых странах – главным причинам смерти [1], [2]. Известно, что ЛГ – полиэтиологическое патологическое состояние, характеризующееся взаимодействием многих клеточных, молекулярных и генетических событий, которые приводят к чрезмерной пролиферации легочных клеток, включая гладкие мышцы и эндотелиоциты, развитию воспаления и ремоделирования внеклеточного матрикса [3]. Сложные молекулярные механизмы, вовлеченные в патобиологию ЛАГ, ограничивают разработку потенциальных терапевтических вмешательств при ЛАГ [4]. Известно, что компоненты липидного обмена способны оказывать влияние на состояние легких и патогенез ряда патологических процессов, включая легочный фиброз и ЛГ [5].
Цель исследования
Оценить изменения липидного обмена и их значение у мужчин моложе 60 лет c ЛГ, развившейся в подостром периоде ИМ, для уточнения механизмов ее формирования и разработки мероприятий профилактики.
Материал и методы исследования
Изучены данные обследования и лечения 436 мужчин 32-60 лет по поводу ИМ I типа (по IV универсальному определению, 2018) [6], [7]. В исследование включались пациенты со скоростью клубочковой фильтрации (CKD-EPI) 30 и более мл/мин/1,73 м2 [8]. Одобрение получено независимым этическим комитетом Федерального государственного бюджетного военного образовательного учреждения высшего образования «Военно-медицинская академия имени С. М. Кирова» Министерства обороны Российской Федерации 05.11.2018 г., протокол № 215. Терапия проводилась в соответствии со стандартами на момент лечения. Аторвастатин или розувастатин назначались всем пациентам в максимально переносимой дозе при поступлении в стационар и в той же дозе рекомендовались при выписке. Большинство из обследованных не принимали гиполипидемические препараты до развития ИМ. Пациентов разделили на две группы в зависимости от уровней среднего давления в легочной артерии (СДЛА), определяемого эхокардиографически (A. Kitabatake) [9]. Исследуемую группу сформировали из больных с ЛГ, впервые зарегистрированной в завершении третьей недели ИМ (СДЛА 25 и более мм рт. ст) и нормальным СДЛА в первые 48 часов ИМ – 86 мужчин (средний возраст 51,1±6,9 лет). В контрольную группу включены мужчины с нормальными значениями СДЛА в обе фазы исследования или нормализацией СДЛА (при повышении в первые часы ИМ) в завершении третьей его недели – 350 человек (51,4±6,1 лет, p=0,98).
Из параметров липидного обмена изучены концентрации в сыворотке крови общего холестерина (ОХ), триглицеридов (ТГ), липопротеидов высокой (ЛВП), низкой (ЛНП) и очень низкой (ЛОНП) плотности, коэффициент (КА=(ОХ-ЛВП)/ЛВП) и индексы атерогенности (ОХ/ЛВП и ЛНП/ЛВП)). Все параметры определяли дважды – в первые 48 часов (I) и в конце третьей недели ИМ (II).
Показатели в выделенных группах сравнивали на основе критериев Манна-Уитни, Вилкоксона. Влияние значений параметров на абсолютный и относительный риски развития ЛГ в подостром периоде ИМ оценивали путем многофакторного дисперсионного анализа (ANOVA). Уровень статистической значимости принят при вероятности ошибки менее 0,05.
Основные результаты
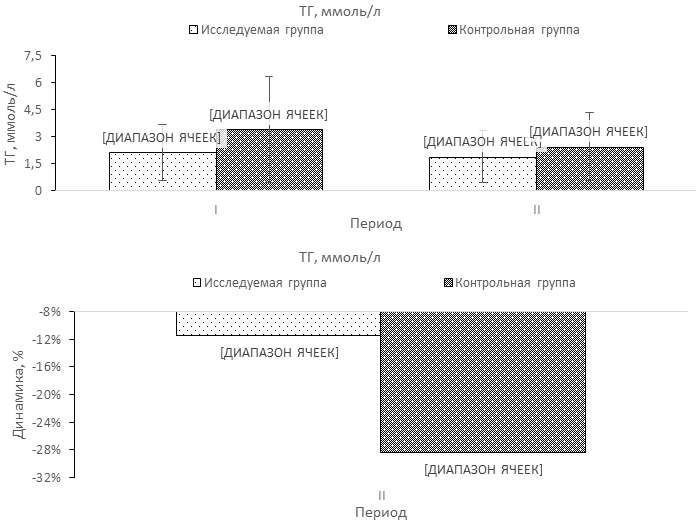
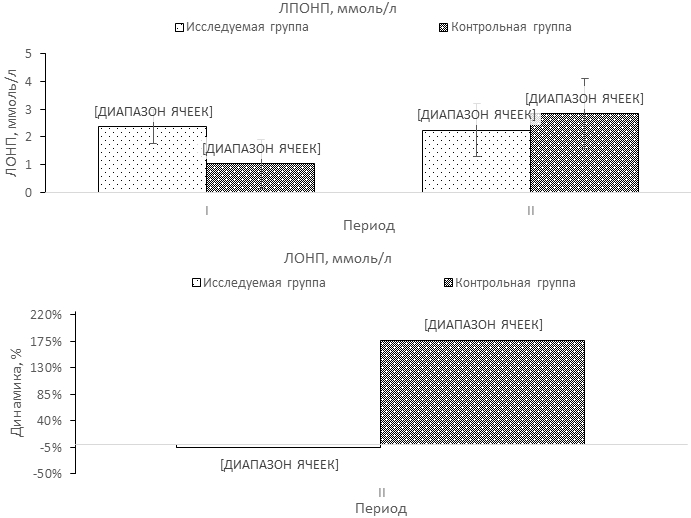
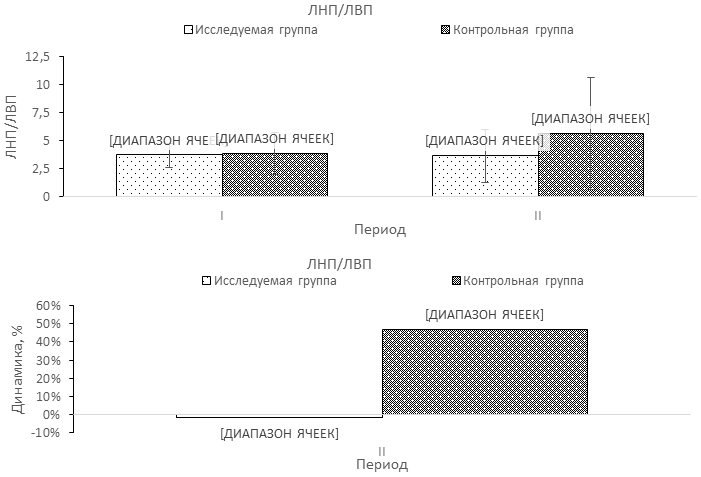
При сравнении показателей липидного обмена выявлено преобладание более высоких уровней КА и ОХ/ЛВП в контрольной группе над исследуемой в завершении третьей недели ИМ (табл. 1). При оценке динамики изменений показателей липидограммы между периодами наблюдения в исследуемой группе не отмечено значимых различий за исключением снижения уровня ОХ (на 10,1%) (табл.1., рис. 1-4). Напротив, в контрольной группе за этот период выявлено уменьшение уровней ТГ (на 28,4%) при одновременном повышении концентраций ЛОНП (на 177,2%), и соотношения ЛНП/ЛВП (46,8%) (табл.1., рис. 1-4).
Таблица 1 – Достоверные различия показателей липидного обмена у обследованных в первые 48 часов (I) и завершении третьей недели заболевания (II) [M±S; M min-M max; p – критерий достоверности]
| Показатели | Исследуемая группа | Контрольная группа | ||
| I, n=86 | II, n=40 | I, n=350 | II, n=192 | |
| 1 | 2 | 3 | 4 | 5 |
| ОХ | 5,59 ± 1,30 1,92-8,46 | 5,32 ± 1,42 2,62-8,20 | 5,68 ± 1,33 1,90-10,32 | 5,70 ± 1,42 2,79-10,0 |
| Р2-3=0,03 | ||||
| ТГ | 2,32 ± 1,49 0,57-6,80 | 2,34 ± 1,40 0,80-5,51 | 2,64 ± 1,99 1,99-13,18 | 2,32 ± 1,63 0,78-8,40 |
| Р4-5=0,004 | ||||
| ЛОНП | 0,97 ± 0,65 0,35-3,19 | 2,67 ± 1,02 0,95-4,00 | 0,81 ± 0,39 0,22-3,66 | 2,89 ± 1,27 0,95-5,42 |
| Р4-5=0,006 | ||||
| КА | 4,99 ± 2,28 0,70-11,40 | 4,45 ± 1,95 2,06-11,31 | 5,14 ± 2,00 0,38-12,60 | 5,58 ± 2,28 1,18-12,40 |
| Р3-5=0,006 | ||||
| ОХ/ЛВП | 6,31 ± 2,31 1,73-13,35 | 5,44 ± 1,95 3,06-12,31 | 6,31 ± 2,18 1,38-15,18 | 6,56 ± 2,32 1,22-13,40 |
| Р3-5=0,006 | ||||
| ЛНП/ЛВП | 4,33 ± 2,14 0,27 ± 11,38 | 4,83 ± 3,71 1,53-13,50 | 4,39 ± 2,04 0,75-12,38 | 6,86 ± 5,51 0,84-22,80 |
| Р4-5=0,03 | ||||
При изучении рисков развития ЛГ в подостром периоде ИМ с помощью ANOVA оказалось, что все перечисленные показатели, а также уровень ЛНПII оказывают значимое воздействие на это событие при диапазоне рисковых значений от 7,7% до 34,8% (табл. 2).
Рис. 1 – Достоверная динамика изменений общего холестерина (ОХ) в группах обследованных между точками наблюдения
Рис. 2 – Достоверная динамика изменений триглицеридов (ТГ) в группах обследованных между точками наблюдения
Рис. 3 – Достоверная динамика изменений липопротеидов очень низкой плотности (ЛОНП) в группах обследованных между точками наблюдения
Рис. 4 – Достоверная динамика изменений соотношения липопротеидов низкой (ЛНП) и высокой (ЛВП) плотности в группах обследованных между точками наблюдения
Наибольшее влияние с повышением риска от 31,7% до 34,8% имели такие показатели второй точки наблюдения как: КА, ОХ/ЛВП, ЛНП. Уровни ТГ, ЛОНП и индексов атерогенности (ОХ/ЛВП и ЛНП/ЛВП) первых 48 часов заболевания также оказались связанными с риском формирования ЛГ при ИМ (табл. 2). Их влияние оценено в диапазоне 7,7-34,5%, что необходимо использовать при прогностическом моделировании.
В целом, отсутствие динамики и меньшие уровни атерогенных липидных фракций в окончании подострого периода ИМ характерны для случаев формирования ЛГ (рис. 1-4).
Обсуждение
Взаимосвязи параметров липидного обмена и СДЛА при ИМ хорошо известны. Показано, что при уровнях ОХI и ОХII 6,8 ммоль/л, и более повышается риск развития ЛГ при ИМ у мужчин моложе 60 лет [9]. Согласно данным исследователей, эти связи реализуются через сложные механизмы, в том числе, посредством экзосом [4], через аполипопротеин Е/ЛНП- и аполипопротеин А1-зависимые пути [5], а также другие специфические регуляторы (белок, ассоциированный с трансформирующим фактором роста (TGF) -β, (TIMAP) [11], микро-РНК-193 [1], [4], окисленные липопротеиды, ферменты и регуляторы такого окисления [4], мелатонин [12]).
Таблица 2 – Влияние параметров липидного обмена на риск развития ЛГ в завершении третей недели ИМ (P – критерий достоверности)
| Параметры липидного обмена | Частота ЛГ, впервые развившейся после ИМ: (абсолютный риск, %) | Относительный риск (95% ДИ) | P |
| 1 | 2 | 3 | 4 |
| КАII < 5,0 | 31,7 | 4,57 (1,82; 11,47) | 0,0002 |
| ОХII/ЛВПII < 6,0 | 31,7 | 4,57 (1,82; 11,47) | 0,0002 |
| ЛНПII, ммоль/л < 2,4 | 34,8 | 2,78 (1,22; 6,37) | 0,02 |
| ТГI<1,3 ммоль/л | 29,6 | 1,75 (1,09; 2,80) | 0,02 |
| ЛНПII/ЛВПII < 3,2 | 28,9 | 2,61 (1,05; 6,43) | 0,03 |
| ЛОНПI≥1,2 ммоль/л | 34,5 | 2,01 (1,10; 3,67) | 0,03 |
| ОХI/ЛВПI < 6,2 | 24,8 | 1,72 (1,03; 2,88) | 0,03 |
| ЛНПI/ЛВПI < 2,4 | 7,7 | 0,35 (0,12; 1,08) | 0,04 |
Доказано также, что ВИЧ вызывает грубые нарушения липидного обмена и нормальной структуры сетей воспалительных цитокинов, которые принимают непосредственное участие в атерогенезе, прогрессирующем поражении сердечно-сосудистой и дыхательной систем, зачастую приводя к формированию ЛГ [13]. Обнаружено что, атерогенные дислипидемии являются общими факторами риска развития идиопатической венозной тромбоэмболии, атеросклероза и ЛГ [14]. Разработка новых лекарственных препаратов, воздействующих на перечисленные точки приложения, в настоящее время признана перспективной для пациентов с респираторными заболеваниями, которые не отвечают на существующие методы лечения [5], [10]. Однако эти данные противоречат результатам настоящей работы, где значимыми оказались более низкие уровни КА и ОХ/ЛВП, что объясняется различиями в дизайнах исследования. Низкие уровни атерогенных липидов в начальные периоды ИМ, полученные в настоящем исследовании, могут указывать на неблагоприятный прогноз заболевания [15].
ЗаключениеУ мужчин моложе 60 лет с ЛГ, развившейся при ИМ, отмечаются более низкие, чем в контрольной группе, уровни КА и ОХ/ЛВП в подостром периоде заболевания, а также отсутствие значимой динамики от первых часов к окончанию подострого периода ИМ атерогенных фракций липидного обмена (ТГ, ЛОНП) и их соотношений (ЛНП/ЛВП). Это свидетельствует в пользу их негативного прогностического влияния.
Значения ряда компонентов липидного обмена первых часов ИМ (ТГ, ЛОНП, ОХ/ЛВП, ЛНП/ЛВП) указывают на высокий риск развития ЛГ в подостром его периоде, что целесообразно использовать в прогностическом моделировании.
| Финансирование Исследование выполнено в соответствии с планом научной работы Военно-медицинской академии. | Funding The study was carried out in accordance with the plan of scientific work of the Military Medical Academy. |
| Конфликт интересов Не указан. | Conflict of Interest None declared |
Список литературы / References
- Johnson J. L. Elucidating the contributory role of microRNA to cardiovascular diseases (a review) / J. L. Johnson // Vascul. – 2019. Vol.114. – P. 31-48. DOI: 10.1016/j.vph.2018.10.010
- Shao C. Coronary Artery Disease: From Mechanism to Clinical Practice / C. Shao, J. Wang, J. Tian, Yi-da Tang // Adv. Exp. Med. – 2020. Vol.1177. P.1-36. DOI: 10.1007/978-981-15-2517-9_1
- Sharma S. Role of oxidized lipids in pulmonary arterial hypertension/ S. Sharma, G. Ruffenach, S. Umar, N. Motayagheni, S. T. Reddy, M. Eghbali and others // Pulm. – 2016. – Vol.6(3). P. 261-273. DOI: 10.1086/687293
- Xu J. Exosomes: A Rising Star in Falling Hearts / J. Xu, G. Chen, Y. Yang // Front. – 2017. – Vol.8. P.494. DOI: 10.3389/fphys.2017.00494
- Yao X. Emerging Roles of Apolipoprotein E and Apolipoprotein A-I in the Pathogenesis and Treatment of Lung Disease / X. Yao, E. M. Gordon, D. M. Figueroa and others // Am. J. Respir. Cell Mol. Biol. 2016. Vol.55, №2. P.159-169. DOI: 10.1165/rcmb.2016-0060TR
- Thygesen K. Task Force for the Universal Definition of Myocardial Infarction. Fourth Universal Definition of Myocardial Infarction (2018) / K. Thygesen, J. S. Alpert, A. S. Jaffe and others // J. Am. Cardiol. – 2018. – Vol.72, №18. – P. 2231-2264. DOI: 10.1016/j.jacc.2018.08.1038
- Белевитин А. Б. К вопросу о классификации инфарктов миокарда / А. Б. Белевитин, А. Э. Никитин, В. В. Тыренко, и др. // Вестник Российской Военно-медицинской академии. – 2009. – №2 (26). – С.7-10.
- Моисеев В. С. Сердечно-сосудистый риск и хроническая болезнь почек: стратегии кардионефропротекции. Национальные рекомендации / В. С. Моисеев, Н. А. Мухин, А. В. Смирнов, и др. // Терапия. – 2015. – №1. – С. 63-96.
- Kitabatake, A. Noninvasive evaluation of pulmonary hypertension by a pulsed Doppler technique / A. Kitabatake, M. Iuone, M. Asao // Circulation. – 1983. – Vol. 68, №2. – P. 302–309.
- Кудинова А. Н. Ранние маркеры легочной гипертензии у мужчин молодого и среднего возраста после перенесенного инфаркта миокарда / А. Н. Кудинова, А. В. Гордиенко, А. В. Сотников и др. // Вестник Российской военно-медицинской академии. – 2019. – №3 (67). – С. 30-33.
- Boratkó A. TIMAP, the versatile protein phosphatase 1 regulator in endothelial cells / A. Boratkó, C. Csortos // IUBMB Life. – 2017. – Vol.69(12). 918-928. DOI: 10.1002/iub.1695
- Sun H. Effects of melatonin on cardiovascular diseases: progress in the past year / H. Sun, A. M. Gusdon, S. Qu // Curr. Lipidol. – 2016. Vol.27(4). P. 408-413. DOI: 10.1097/MOL.0000000000000314
- Gibellini D. HIV-related mechanisms in atherosclerosis and cardiovascular diseases / D. Gibellini, M. Borderi, A. Clò and others // J Cardiovasc Med (Hagerstown). – 2013. – Vol.14(11). – P. 780-790. DOI: 10.2459/JCM.0b013e3283619331
- Mi Y. Venous thromboembolism has the same risk factors as atherosclerosis: A PRISMA-compliant systemic review and meta-analysis / Y. Mi, S. Yan, Y. Lu and others // Medicine (Baltimore). – 2016 – Vol. 95(32): e4495. DOI: 10.1097/MD.0000000000004495
- Литовский И. А. Достаточно ли обоснованы цели, к которым мы стремимся? / И. А. Литовский, А. В. Гордиенко, А. В. Сотников // Клиническая фармакология и терапия. 2019. Т. 28. № 4. С. 10-23. DOI: 10.32756/0869-5490-2019-4-10-23
Список литературы на английском языке / References in English
- Johnson J. L. Elucidating the contributory role of microRNA to cardiovascular diseases (a review) / J. L. Johnson // Vascul. – 2019. Vol.114. – P. 31-48. DOI: 10.1016/j.vph.2018.10.010
- Shao C. Coronary Artery Disease: From Mechanism to Clinical Practice / C. Shao, J. Wang, J. Tian, Yi-da Tang // Adv. Exp. Med. – 2020. Vol.1177. P.1-36. DOI: 10.1007/978-981-15-2517-9_1
- Sharma S. Role of oxidized lipids in pulmonary arterial hypertension/ S. Sharma, G. Ruffenach, S. Umar, N. Motayagheni, S. T. Reddy, M. Eghbali and others // Pulm. – 2016. – Vol.6(3). P. 261-273. DOI: 10.1086/687293
- Xu J., Chen G., Yang Y. Exosomes: A Rising Star in Falling Hearts / J. Xu, G. Chen, Y. Yang // Front. – 2017. – Vol.8. P.494. DOI: 10.3389/fphys.2017.00494
- Yao X. Emerging Roles of Apolipoprotein E and Apolipoprotein A-I in the Pathogenesis and Treatment of Lung Disease / X. Yao, E. M. Gordon, D. M. Figueroa and others // Am. J. Respir. Cell Mol. Biol. 2016. Vol.55, №2. P.159-169. DOI: 10.1165/rcmb.2016-0060TR
- Thygesen K. Task Force for the Universal Definition of Myocardial Infarction. Fourth Universal Definition of Myocardial Infarction (2018) / K. Thygesen, J. S. Alpert, A. S. Jaffe and others // J. Am. Cardiol. – 2018. – Vol.72, №18. – P. 2231-2264. DOI: 10.1016/j.jacc.2018.08.1038
- Belevitin A. B. K voprosu o klassifikacii infarktov miokarda [Тo the question of classification myocardial infarction] / A. B. Belevitin, A. E. Nikitin, V. V. Тyrenko and others // Vestnik Rossijskoj Voenno-medicinskoj akademii [Bulletin of the Russian Military Medical Academy]. – 2009. – №2(26). – P.7-10. [in Russian]
- Moiseev V. S. Serdechno-sosudistyj risk i hronicheskaya bolezn' pochek: strategii kardionefroprotekcii. Nacional'nye rekomendacii [Cardiovascular risk and chronic kidney disease: cardio-nephroprotection strategies. National guidelines] / V. S. Moiseev, N. A. Muhin, A V. Smirnov and others // Terapiya [Therapy]. – 2015. – №1. – P. 63-96. [in Russian]
- Kitabatake, A. Noninvasive evaluation of pulmonary hypertension by a pulsed Doppler technique / A. Kitabatake, M. Iuone, M. Asao // Circulation. – 1983. – Vol. 68, №2. – P. 302–309.
- Kudinova A.N. Early markers of pulmonary hypertension in young and middle-aged men after myocardial infarction / A. N. Kudinova, A. V. Gordienko, A. V. Sotnikov and others // Bulletin of the Russian Military Medical Academy. – 2019. – №3 (67). – P. 30-33. [in Russian]
- Boratkó A. TIMAP, the versatile protein phosphatase 1 regulator in endothelial cells / A. Boratkó, C. Csortos // IUBMB Life. – 2017. – Vol.69(12). 918-928.
- Sun H. Effects of melatonin on cardiovascular diseases: progress in the past year / H. Sun, A. M. Gusdon, S. Qu // Curr. Opin. Lipidol. – 2016. Vol.27(4). P. 408-413. DOI: 10.1097/MOL.0000000000000314
- Gibellini D. HIV-related mechanisms in atherosclerosis and cardiovascular diseases / D. Gibellini, M. Borderi, A. Clò and others // J Cardiovasc Med (Hagerstown). – 2013. – Vol.14(11). – P. 780-790. DOI: 10.2459/JCM.0b013e3283619331
- Mi Y. Venous thromboembolism has the same risk factors as atherosclerosis: A PRISMA-compliant systemic review and meta-analysis / Y. Mi, S. Yan, Y. Lu and others // Medicine (Baltimore). – 2016 – Vol. 95(32): e4495. DOI: 10.1097/MD.0000000000004495
- Litovskij I. A. Controversial issues of pathogenesis and lipid-lowering therapy of atherosclerosis / I. A. Litovskij, A. V. Gordienko, A.V. Sotnikov // Clin. Ther. – 2019. – Vol.28, №4. – P. 10-23. DOI: 10.32756/0869-5490-2019-4-10-23 [in Russian]