АНАЛИЗ ВЫЯВЛЕННЫХ БАКТЕРИЕМИЙ У ПАЦИЕНТОВ С ОНКОГЕМАТОЛОГИЧЕСКОЙ ПАТОЛОГИЕЙ В МНОГОПРОФИЛЬНОМ ДЕТСКОМ СТАЦИОНАРЕ КРАСНОДАРА
Татульян А.А.1, Кондратьева Е.И.2, Клещенко Е.И.3, Трембач А.В.4
1Аспирант, 2 Доктор медицинских наук, 3 Доктор медицинских наук, 4Аспирант, Кубанский государственный медицинский университет
АНАЛИЗ ВЫЯВЛЕННЫХ БАКТЕРИЕМИЙ У ПАЦИЕНТОВ С ОНКОГЕМАТОЛОГИЧЕСКОЙ ПАТОЛОГИЕЙ В МНОГОПРОФИЛЬНОМ ДЕТСКОМ СТАЦИОНАРЕ КРАСНОДАРА
Аннотация
В статье проведён анализ микробиологического спектра микрофлоры, выделенных из крови у детей с нейтропенической лихорадкой за 2012-2014гг в онкогематологическом отделении детской краевой клинической больницы г. Краснодар. Также проанализирован уровень резистентности возбудителей к антибиотикам для оптимизации назначения стартовой антибактериальной терапии.
Ключевые слова: нейтропения, дети, микрофлора, антибактериальная терапия.
Tatulyan A.A.1, Kondratieva E.I.2, Kleshchenko E.I.3, Trembach A.V.4
1 Postgraduate student , 2 PhD in Medicine, 3 PhD in Medicine, 4 Postgraduate student, Kuban madical state university
THE ANALYSIS OF BACTERIAEMIAS IN REGIONAL KRASNODAR CHILDREN'S HOSITAL PATIENTS WITH ONCOHAEMATOLOGIE DISEASES
Abstract
The article contains microbiological blood samples analysis. These samples were obtained from children with febrile neutropenia from 2012 to 2014 in Krasnodar children’s regional hospital. Also we analyzed the bacterial resistance to antibcterial drugs for start therapy optimization.
Key words: febrile neutropenia, children, bacterial flora, antibacterial therapy.
Обоснование. Одними из наиболее грозных осложнений у пациентов с гематологическими и онкогематологическими заболеваниями являются инфекции [1, 2, 3, 4]. Учитывая иммуносупрессивное состояние больных, особенно опасными для них могут быть нозокомиальные инфекции, которые протекают крайне тяжело и могут привести к летальному исходу [5].
Бактериологический пейзаж может различаться не только в регионах, но и между различными клиниками внутри одного города. Структура микрофлоры, вызывающих инфекции у больных с течением времени меняется. Например, в 70-х годах гемокультуры содержали преимущественно грамотрицательные микроорганизмы, в 90-х – грамположительные бактерии. На настоящий момент грамотрицательная микрофлора стала медленно, но верно отвоёвывать свои позиции. С той разницей, что стала несколько другой её таксономическая структура и резко возрос уровень резистентности к антимикробным препаратам. Поэтому мониторинг госпитальных бактериальных инфекций имеет большое значение для выбора эффективной антибактериальной терапии иммунокомпрометированных больных, особенно в состоянии нейтропении [6,7].
Цель исследования. Провести анализ микробиологического спектра микроорганизмов, выделенных из крови у больных гемобластозами и депрессиями кроветворения за 2012-2014г в онкогематологическом отделении детской краевой клинической больницы г. Краснодар, определить чувствительность возбудителей к антибиотикам для оптимизации терапии.
Методы. Объект исследования: истории болезни детей, получавших лечение в онкогематологическом отделении Государственного бюджетного учреждения здравоохранения министерства здравоохранения Краснодарского края детской краевой клинической больницы (ГБУЗ ДЗ КК ДККБ) в период 2012-2014 гг.
Проанализировано 2271 истории болезни: за 2012 г – 714 , за 2013 г – 782, за 2014 г – 775, посевов крови на стерильность 1188, из них за 2012 г – 361, за 2013 г – 275, за 2014 г - 552. Регистрировались истории болезни детей с положительными высевами в возрасте от 0 до 16 лет, находящихся в состоянии фебрильной нейтропении, всего 172 выделенных культур (14,5%). Одновременно проводился анализ антибактериальной терапии у пациентов с нейтропенической лихорадкой.
Посев крови проводили согласно приказу МЗ СССР № 535 «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений». Исследования проводили в бактериологической лаборатории ГБУЗ ДЗ ДККБ, лицензированной на деятельность, связанной с возбудителями инфекционных заболеваний человека III-IV группы патогенности. Исследования проводили с помощью системы BacT/ALERT 3D60 производства компании «bioMerieux» (Франция) с применением педиатрических флаконов для системы BacT/ALERT 3D60 производства компании «bioMerieux» (Франция) с питательной средой для выделения аэробов и факультативных анаэробных возбудителей. Идентификация возбудителей проводилась с помощью аппарата Vitec 2-compact (США). Для определения чувствительности и резистентности к антибиотикам у микроорганизмов применялся диско-диффузионный метод (по Keurby-Bauer). Использовались диски с антибиотиками производства НИЦФ (научно-исследовательский центр фармакотерапии) г. Санкт-Петербург, (Россия).
Результаты. Анализ 2271 историй болезни показал, что у 119 больных, находящихся в состоянии нейтропенической лихорадки была выявлена бактериемия в 147 положительных высевах. Из 147 положительных посевов в 67 (45,6%) посевах выделялась грамотрицательная флора, в 64 (43,5%) посевах – грамположительная флора, в 14 (9,5%) посевах – смешанная флора (грамположительная и грамотрицательная); из 2(1,4%) посевов были выделены грибы рода Candida non albicans. Всего было выделено 172 возбудителя, из них 82 (47,7%) грамположительных и 88 (51,2%) грамотрицательных.
В общей структуре микроорганизмов, представленных в таблице 1 доминировали MRSE (18,6%), Ps. aeruginosa (15,1%), Staphylococcus epidermidis (11,1%) , Acinetobacter spp. (10,5%), Kl. Рneumonia (8,7%).
Таблица 1. Общая структура возбудителей, выделенных из посевов крови на стерильность в 2012-2014 гг.
| MRSE | 32 (18,6%) |
| Ps. aeruginosa | 26 (15,1%) |
| Staphylococcus epidermidis | 19 (11,1%) |
| Acinetobacter spp. | 18 (10,5%) |
| Kl. pneumoniae | 15 (8,7%) |
| Enterobacter cloacae | 7 (4,1) |
| Streptococcus spp. | 6 (3,5%) |
| Enterococcus faecalis | 5 (2,9%) |
| Stenotrophomonas maltophilia | 5 (2,9%) |
| Micrococcus luteus | 5 (2,9%) |
| E. coli | 4 (2,3%) |
| Staphylococcus aureus | 4 (2,3%) |
| Staphylococcus hominis | 3 (1,7%) |
| Прочие | 23 (13,4%) |
| Итого | 172 (100%) |
Частота выделения грамположительных возбудителей составила 47,7% (n=82). Среди грамположительных бактерий доминировали стафилококк коагулазонегативный (39%), Staphylococcus epidermidis (23,2%; табл. 2). Отмечается тенденция к снижению числа положительных высевов MRSE с 15 (48,4%) в 2012 г до 7 (31,9%) в 2013г и 10 (34,5%) в 2014г.
Таблица 2. Структура грамположительных возбудителей, выделенных из посевов крови на стерильность в 2012-2014 гг.
| MRSE | 32 (39%) |
| Staphylococcus epidermidis | 19 (23,2%) |
| Streptococcus spp | 6 (7,3%) |
| Enterococcus faecalis | 5 (6,1%) |
| Micrococcus luteus | 5 (6,1%) |
| Staphylococcus aureus | 4 (4,9%) |
| Staphylococcus hominis | 3 (3,7%) |
| Другие | 8 (9,7%) |
Примечание: Nocardia asteroids, Kokuria kristinae, Pediococcus pentosaceus
Staphylococcus chromogenes, Paenbacillus polymyxa представлены единичными культурами. За 100% принято 82 положительных высева.
Частота выделения грамотрицательных возбудителей составила 51,2% (n=88). В этой группе микроорганизмов преобладали P.aeruginosa (29,5%), Acinetobacter spp. (20,5%), Kl. рneumoniae (17,1%), Enterobacter cloacae (7,9%), Stenotrophomonas maltophilia (5,7%) . Другие бактерии были представлены единичными штаммами разных видов (табл. 3).
Таблица 3. Структура грамотрицательных возбудителей, выделенных из посевов крови на стерильность в 2012-2014 гг.
| Ps. aeruginosa | 26 (29,5%) |
| Acinetobacter spp. | 18 (20,5%) |
| Kl. pneumoniae | 15 (17,1%) |
| Enterobacter cloacae | 7 (7,9%) |
| Stenotrophomonas maltophilia | 5 (5,7%) |
| E. coli | 4 (4,5%) |
| Другие | 13 (14,8%) |
Примечание: Raoultella ornithinolytica , Cronobacter sacazakii group, Chryseobacterium meningosepticum, Enterobacter aerogenes, Edwardsiella tarda, Proteus vulgaris, Serratia marcenscens представлены единичными культурами. За 100% принято 88 положительных высевов. Из 2 посевов были выделены культуры Candida non albicans.
Если сравнивать эти показатели с данными за 2009-2011гг в этом же отделении [8], то видно, что изменилось не только соотношение грамположительных и грамотрицательных возбудителей в пользу грамотрицательных микроорганизмов, но и структура внутри каждой из этих групп. Так, ранее выделялись коагулазонегативные стафилококки в 56,2% (n=55), в последнем же нашем исследовании количество их снизилось до 18,6% (n=32). Значительно реже стали выявляться Enterococcus faecalis: 14,3% (n=14) и 2,9% (n=5) соответственно. Enterococcus faecium за период 2012-2014гг из гемокультур не выделялся, в то время как в раннем исследовании он высевался в 3случаях, что составило 3,1%.
Что касается грамотрицательных возбудителей, то в этой группе в сравнении с 2009-2011гг. поменялись местами Kl. pneumoniae и Ps. aeruginosa. В настоящем исследовании лидирующую позицию заняла синегнойная палочка, а Kl. pneumoniae переместилась на третье место. Второе по частоте место сохранил за собой Acinetobacter spp.
Анализ чувствительности микрофлоры выявил следующие особенности: подавляющее большинство вышеперечисленных грамотрицательных микроорганизмов обладали полирезистентностью.
Как видно из таблицы №4 Ps.aeruginosa сохраняет высокий уровень резистентности практически ко всем антибиотикам, исключением является только колистин (26,9%). Для пиперациллина/тазобактама устойчивость зафиксирована в 34,6% случаев, что значительно меньше в сравнении с исследованием за 2009-2011гг (83,3%). К амикацину напротив, резистентность возрасла (с 37,5% до 65,4%). К остальным антибактериальным средствам резистентность составила от 57,7% и выше. Обращает на себя внимание очень высокий уровень устойчивости к антибактериальным средствам группы карбапенемов. Особо следует отметить, что 7 (27%) из 26 культур Ps.aeruginosa зарегистрированы, как панрезистентные.
Таблица 4. Чувствительность к антибиотикам (n,%) Ps. aeruginosa (n =26)
| Препараты | Чувствительный | Умеренно-резистентный | Резистентный |
| Амикацин | 6 (23,1%) | 3 (11,5%) | 17 (65,4,%) |
| Колистин | 19 (73,1%) | 0 (0%) | 7 (26,9%) |
| Имипенем/целастатин | 8 (30,8%) | 1 (3,8%) | 17 (65,4%) |
| Меропенем | 9 (34,6%) | 0 (0%) | 17 (65,4%) |
| Ципрофлоксацин | 5 (19,3%) | 3 (11,5%) | 18 (69,2%) |
| Цефоперазон/сульбактам | 9(34,6%) | 2 (7,7%) | 15 (57,7%) |
| Цефтазидим | 6 (23,1%) | 1 (3,8%) | 19 (73,1%) |
| Цефепим | 4 (15,4%) | 2 (7,7%) | 20 (76,9%) |
| Пиперациллин/тазобактам | 14 (53,9%) | 3 (11,5%) | 9 (34,6%) |
Для Kl. pneumoniae уровень резистентности менее выражен. Не выявлено ни одного штамма, резистентного к карбапенемам (таблица №5). Отмечается невысокий уровень устойчивости к цефоперазону/сульбактаму, амикацину, ципрофлоксацину (от 13,3 до 20%). Эти показатели в сравнении с исследованием 2009-2011гг несколько лучше: улучшилась чувствительность к аминогликозидам (амикацин 56%→73%; гентамицин 24%→53,3%).
Таблица 5. Чувствительность к антибиотикам (n,%) Klebsiella pneumoniae (n =15)
| Препараты | Чувствительный | Умеренно-резистентный | Резистентный |
| Амикацин | 11 (73,3%) | 1 (6,7%) | 3 (20%) |
| Цефтриаксон | 3 (20%) | 0 (0%) | 12 (80%) |
| Имипенем/целастатин | 15 (100%) | 0 (0%) | 0(0%) |
| Меропенем | 15(100%) | 0(0%) | 0(0%) |
| Ципрофлоксацин | 10(66,7%) | 2(13,3%) | 3(20%) |
| Цефоперазон/сульбактам | 13 (86,7%) | 0 (0%) | 2(13,3%) |
| Гентамицин | 8(53,3%) | 1(6,7%) | 6(40%) |
Примечание: продуценты БЛРС составили 80% выделенных культур Klebsiella pneumoniae.
Анализ резистентности к антибактериальным препаратам Acinetobacter spp выявил высокую чувствительность к тигециклину, цефоперазону/сульбактаму (табл. № 6). Остальные антибактериальные средства не могут быть препаратами выбора в связи с высоким уровнем резистентности. В исследовании 2009-2011г уровень резистентности к другим группам антибактериальных препаратов был значительно ниже: имипенем/целастатин 11,8%, меропенем 25%, цефепим 26,7%, к ципрофлоксацину резистентных штаммов выявлено не было.
Таблица 6. Чувствительность к антибиотикам (n,%) Acinetobacter spp.(n =18)
| Препараты | Чувствительный | Умеренно-резистентный | Резистентный |
| Амикацин | 8 (44,4%) | 5 (27,8%) | 5 (27,8%) |
| Тигециклин | 18 (100%) | 0 (0%) | 0 (0%) |
| Имипенем/целастатин | 8 (44,4%) | 4 (22,2%) | 6 (33,4%) |
| Меропенем | 8(44,4%) | 3 (16,7%) | 7 (38,9%) |
| Ципрофлоксацин | 9 (50%) | 2 (11,1%) | 7 (38,9%) |
| Цефоперазон/сульбактам | 16 (89%) | 1 (5,5%) | 1 (5,5%) |
| Колистин | 12 (66,6%) | 3 (16,7%) | 3 (16,7%) |
| Цефепим | 7 (38,9%) | 2 (11.1%) | 9 (50%) |
В структуре грамположительных бактерий преобладал коагулазонегативный стафилококк (MRSE), сохраняющий чувствительность только к ванкомицину и линезолиду в 100% случаев. Группа энтерококков представлена только Enterococcus faecalis. В ходе нашего исследования ванкомицинустойчивые штаммы не были обнаружены.
Обсуждение. Устойчивость бактериальной флоры к антибиотикам является основной причиной, ограничивающей эффективность антибактериальной терапии. В настоящее время антибиотикоустойчивость является очень серьёзной проблемой при лечении инфекций. При госпитальных инфекциях существует ряд патогенов, в отношении которых антибиотики практически неэффективны. Это метициллинрезистентные стафилококки, множественно-резистентные энтерококки, псевдомонады, ацинетобактерии и некоторые энтеробактерии [9,10,11,12].
Общеизвестно, что резистентность микроорганизмов к антибиотикам может быть природной и приобретенной [13]. Природная резистентность является постоянным видовым признаком микроорганизмов. Под приобретенной устойчивостью понимают свойство отдельных штаммов бактерий сохранять жизнеспособность при тех концентрациях антибиотиков, которые подавляют основную часть микробной популяции [14,15].
Развитие плазмидной резистентности нередко связано с использованием ампициллина, и цефалоспоринов III поколения (все цефалоспорины III поколения создают проблемы резистентности, даже если их назначают в небольших количествах) [16].
Клиническое значение неферментирующих грамотрицательных бактерий в этиологии нозокомиальных инфекций увеличилось в последние годы. Наиболее важными среди них с клинических позиций являются Ps. aeruginosa и Acinetobacter spp. Особенностью этих микроорганизмов является непредсказуемый фенотип устойчивости, поэтому наиболее надежный режим терапии может быть выбран на основании данных локального мониторинга антибиотикочувствительности возбудителей инфекций.
Природную активность против синегнойной палочки проявляют многие антибиотики, однако высокий уровень приобретенной резистентности госпитальных штаммов этого микроорганизма существенно ограничивает спектр потенциально эффективных препаратов. Чувствительность Ps. aeruginosa к антипсевдомонадным антибиотикам в каждом конкретном случае предсказать сложно. Надежные рекомендации по лечению псевдомонадных инфекций отсутствуют, так как отмечается достаточно большая вариабельность в уровне устойчивости Ps. aeruginosa в различных регионах. Кроме того, для Ps. aeruginosa характерно быстрое формирование устойчивости на фоне антибактериальной терапии, что наблюдается в 10–53% [17,18].
Ацинетобактерии являются маловирулентными микроорганизмами и, как правило, вызывают суперинфекции у ослабленных или иммунокомпрометированных больных, получающих длительную антибактериальную терапию. На фоне применения антибиотиков широкого спектра происходит элиминация чувствительных микроорганизмов и селекция устойчивых штаммов Acinetobacter, проявляющих устойчивость к большинству антибиотиков.
Антибиотикорезистентность среди грамотрицательных возбудителей нозокомиальных инфекций является в настоящее время глобальной проблемой, существенно лимитирующей эффективность стандартных режимов эмпирической терапии, прежде всего цефалоспоринов. Стратегия антимикробной терапии нозокомиальных инфекций, направленная на применение на первом этапе лечения максимально эффективных режимов, приводит к ограничению распространения резистентных штаммов в отделении, сдерживанию антибиотикорезистентности и повышению эффективности лечения [5,19].
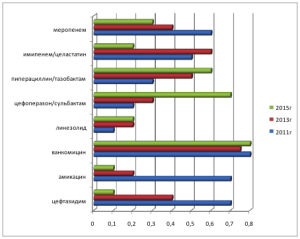
Проведенное нами исследование позволило внести коррективы в структуру назначений на 2015г, изменив сложившуюся модель антибиотической терапии госпитальной инфекции в гематологическом отделении (рис. 1).
Рис 1. - Структура антибактериальных препаратов для лечения инфекционных осложнений в гематологическом отделении и процент их применяемости в 2011-2015гг
Как видно из рисунка 1, в первом полугодии 2015г при назначении антибактериальной терапии у пациентов с фебрильной нейтропенией предпочтение отдаётся препаратам, защищённым ингибиторами β-лактамаз: пиперациллину/тазобактаму и цефоперазону/сульбактаму по сравнению с более ранними периодами, когда чаще назначались аминогликозиды и цефалоспорины III поколения.
Заключение. Таким образом, видно, что в течение последних пяти лет произошли изменения в структуре возбудителей нейтропенической лихорадки и уровне их резистентности. Грамотрицательные микроорганизмы в гемокультурах стали преобладать над грамположительными. Внутри группы грамотрицательных возбудителей также произошла изменения: в 2013г и02014г стали наиболее часто определяться неферментирующие грамотрицательные бактерии с традиционно высокой резистентностью к большинству классов антимикробных препаратов, включая карбапенемовый ряд. Заметно возросла резистентность у синегнойной палочки к амикацину. Это повлекло за собой смену приоритетов в назначении антибактериальных препаратов (рис.1).
В связи с сохраняющимся преобладанием MRSE, неизменно высокой остаётся частота применения ванкомицина, более активно стал использоваться линезолид, что чаще всего связано нарушением функции почек на фоне проведения ПХТ, а также особенностей фармакокинетики препарата.
Стали значительно реже назначаться в качестве стартовой антибактериальной терапии цефалоспорины III поколения и аминогликозиды.
Выросла потребность в применении пенициллинов, защищённых ингибиторами β-лактамаз (пиперациллин/тазобактам) и цефоперазона/сульбактама.
Уровень использования антимикробных препаратов карбапенемового ряда остаётся на высоком уровне, однако тенденция к снижению частоты использования данной группы прослеживается.
Литература
- Kollef M.H., Micek S.T. Methicillin-resistant Staphylococcus aureus: a new community-acquired pathogen // Curr. Opin. Infect. Dis. 2006. – № 19. – S. 161-168.
- Татульян А.А., Кондратьева Е.И., Клещенко Е.И., Шабаева Н.А., Лебедев В.В., Трембач А.В. Характеристика микроорганизмов, выделенных из гемокультур у детей с гематологическими и онкологическими заболеваниями, находящихся на лечении в Детской краевой клинической больнице. – Вопросы гематологии/онкологии и иммунопатологии в педиатрии. – 12 (3). – С. 23-28.
- Naiemi N.A., Duim B., Savelkoul P.H. et al. Widespread transfer of resistance genes between bacterial species in an intensive care unit: implications for hospital epidemiology // J. Clin. Microbiol. – №43. – S. 4862-4864.
- Клясова Г.А., Сперанская Л.Л., Миронова А.В. и др. Возбудители сепсиса у иммунокомпрометированных больных: структура и проблемы антибиотикорезистентности (результаты многоцентрового исследования). – Гематология и трансфузиология. – №1. – С. 11-19.
- БелобородовВ.Б. Современные подходы к совершенствованию антимикробной терапии тяжелых инфекций.// Клиническая фармакология и терапия. 2005. – 14( 2). – С. 10-15.
- Binkley S., Fishman N.O, Larosa L.A. Comparison of unit–specific and hospital–wide antibiograms: potential implications for selection of empirical antimicrobial therapy. // Infect Control Hosp Epidemiol 2006. – №27. – С. 682–687.
- ПоддубнаяИ.В., Ларионова В.Б., Бабичева Л.Г. Инфекции у больных гемобластозами. В кн. Инфекции, в онкологии. М, Практическая медицина. 2009.
- МенделееваЛ.Н., Митиш Н.Е., Клясова Г.А. Инфекционные осложнения после трансплантации аутологичных гемопоэтических клеток пригемобластозах.// Тер.Архив 2005. – 77 (7). – С. 33 – 39.
- КлясоваГ.А., Сперанская Л.П., Миронова А.В. и соавт. Возбудители сепсиса у иммунокомпрометированных больных: структура и проблемыантибиотикорезистентности (результаты многоцентрового исследования). Гематология и транфузиология. 2007. – №1. – С. 11-19.
- Micek S.T., Lloyd A.E., Ritchie D.J. et al. Pseudomonas aeruginosa bloodstream infection: importance of appropriate initial antimicrobial treatment // Antimicrob Agents Chemother. 2005. – № 49. – S. 1306-1311.
- Gaynes R., Edwards J.R.; National Nosocomial Infections Surveillance System. Overview of nosocomial infections caused by gram-negative bacilli // Clin. Infect. Dis. 2005. – № 41. – S. 848-854.
- Leung W.S., Chu C.M., Tsang K.Y. et al. Fulminant community-acquired Acinetobacter baumannii pneumonia as a distinct clinical syndrome // Chest. – №129. – S. 102-109.
- МитрохинС.Д. Современные методы оценкиантибиотикорезистентности микроорганизмов.// Сопроводительная терапия в онкологии. 2005. – № 4. – С. 34-40.
- СтрачунскийЛ.С. Бета-лактамазы расширенного спектра быстро растущая и плохо осознаваемая угроза.Клиническая микробиология и антимикробная химиотерапия. 2005. – №1. – С. 92-96
- Roberts J.A., Paratz J.D., Paratz E. et al. Continuous infusion of b–lactam antibiotics in severe infections—a review of its role. // Int J Antimicrob Agents 2007. – № 30. – С. 11–8.
- Zaoutis T.E., Goyal M., Chu J.H. et al. Risk factors for and outcomes of bloodstream infection caused by extended-spectrum beta-lactamase-producing Escherichia coli and Klebsiella species in children // Pediatrics. 2005. – №115. – S. 942-949.
- Kim A., Sutherland C.A., Kuti J.L., Nicolau D.P. Optimal dosing of piperacillin/tazobactam for the treatment of Pseudomonas aeruginosa infections: prolonged or continuous infusion? // Pharmacotherapy 2007. – №27. – S. 1490-1497.
- КотлуковаТ.В. Лечение синегнойной инфекции у взрослых и детей.//Фарматека. 2005. – №7. – С. 94-102.
- Micek S.T., Isakow W., Shannon W., Kollef M.H. Predictors of hospital mortality for patients with severe sepsis treated with Drotrecogin alfa (activated) // Pharmacotherapy. 2005. – №25. – S. 26-34.
References
- Kljasova G.A., Speranskaja L.P., Mironova A.V. i soavt. Vozbuditeli sepsisa u immunokomprometirovannyh bol'nyh: struktura i problemyantibiotikorezistentnosti (rezul'taty mnogocentrovogo issledovanija). Gematologija i tranfuziologija. 2007. – №1. – С. 11-19.
- Mendeleeva L.N., Mitish N.E., Kljasova G.A. Infekcionnye oslozhnenija posle transplantacii autologichnyh gemopojeticheskih kletok prigemoblastozah.// Ter.Arhiv 2005. – 77 (7). – S. 33 – 39.
- Poddubnaja I.V., Larionova V.B., Babicheva L.G. Infekcii u bol'nyh gemoblastozami. V kn. Infekcii, v onkologii. M, Prakticheskaja medicina. 2009.
- Beloborodov V.B. Sovremennye podhody k sovershenstvovaniju antimikrobnoj terapii tjazhelyh infekcij.// Klinicheskaja farmakologija i terapija. 2005. – 14 ( 2). – S. 10-15.
- Kljasova G.A., Speranskaja L.L., Mironova A.V. i dr. Vozbuditeli sepsisa u immunokomprometirovannyh bol'nyh: struktura i problemy antibiotikorezistentnosti (rezul'taty mnogocentrovogo issledovanija). – Gematologija i transfuziologija. 2007. – № 1. – S. 11-19.
- Tatul'jan A.A., Kondrat'eva E.I., Kleshhenko E.I., Shabaeva N.A., Lebedev V.V., Trembach A.V. Harakteristika mikroorganizmov, vydelennyh iz gemokul'tur u detej s gematologicheskimi i onkologicheskimi zabolevanijami, nahodjashhihsja na lechenii v Detskoj kraevoj klinicheskoj bol'nice. – Voprosy gematologii/onkologii i immunopatologii v pediatrii. 2013. – 12 (3). – S. 23-28.
- Mitrohin S.D. Sovremennye metody ocenki antibiotikorezistentnosti mikroorganizmov.// Soprovoditel'naja terapija v onkologii. 2005. – №4. – S. 34-40.
- Strachunskij L.S. Beta-laktamazy rasshirennogo spektra bystro rastushhaja i ploho osoznavaemaja ugroza. Klinicheskaja mikrobiologija i antimikrobnaja himioterapija. 2005. – №1. – S. 92-96
- Kotlukova T.V. Lechenie sinegnojnoj infekcii u vzroslyh i detej.//Farmateka. 2005. – № 7. – S. 94-102.