ОСОБЕННОСТИ ВАЛИДАЦИИ СИСТЕМЫ ВОДОПОДГОТОВКИ В ОПЫТНОМ ПРОИЗВОДСТВЕ
ОСОБЕННОСТИ ВАЛИДАЦИИ СИСТЕМЫ ВОДОПОДГОТОВКИ В ОПЫТНОМ ПРОИЗВОДСТВЕ
Научная статья
Научный центр противоинфекционных препаратов, Алматы, Казахстан
* Корреспондирующий автор (amirakan[at]mail.ru)
Приведены результаты валидации водоподготовки. Водоподготовка для фармацевтической промышленности играет важную роль в выпуске качественного продукта и воспроизведении должных процессов очистки. Процесс валидации является обязательным требованием при производстве лекарственных средств и проводится для определения критических точек в работе оборудования и технологических процессов [1]. В связи с отсутствием в настоящее время общепринятого стандарта, регламентирующего документооборот при проведении валидации систем водоподготовки, был составлен валидационный мастер ВМП-01 "Валидация системы подготовки и распределения воды очищенной в опытном производстве", на базе научного цента противоинфекционных препаратов. В данном валидационном мастер плане представлена схема отбора проб воды с 10 точек, контроль которых протекает согласно схеме по 3 этапам согласно требованиям международного стандарта GMP. Контроль воды очищенной проводится согласно требованиям ГФ РК [2], [3].
Ключевые слова: международный стандарт GMP, обратный осмос, система водоподготовки, вода очищенная, контроль качества лекарств.
FEATURES OF WATER TREATMENT SYSTEM VALIDATION IN EXPERIMENTAL PRODUCTION
Research article
Azembaev A.A.*
Scientific Center of Anti-Infective Preparations (SCAID) JSC, Almaty, Kazakhstan
* Corresponding author (amirakan[at]mail.ru)
AbstractThe results of water treatment validation are presented in the paper. Water treatment for the pharmaceutical industry plays an important role in the production of a quality product and the reproduction of proper cleaning processes. The validation process is a mandatory requirement in the manufacture of medicines and is carried out to determine critical points in the operation of equipment and technological processes [1]. Due to the lack of a generally accepted standard that regulates the document flow during the validation of water treatment systems, the validation master VMP-01 "Validation of a water treatment system and distribution of purified water in pilot production" was compiled on the basis of a scientific center of anti-infectious drugs. This validation master plan provides a water sampling scheme from 10 points, the monitoring of which proceeds according to the scheme in 3 stages according to the requirements of the international standard GMP. Control of purified water is carried out in accordance with the requirements of the GF RK [2,3].
Keywords: international GMP standard, reverse osmosis, water treatment system, purified water, quality control of medicines.
Особенностью проводимого нами исследования является то, что рассматриваемое производство на базе научного центра противоинфекционных препаратов на данном примере является опытным. Такого научного предприятия, занимающегося синтезом на основе химических изысканий новых лекарственных препаратов и имеющего в составе опытное производство, нет в Казахстане и ближнем зарубежье.
Прежде чем валидировать процесс водоподготовки нами были разработаны нормативные документы, валидационный мастер-план, отражающий все необходимые моменты, проводимые при валидации. При его составлении был принят во внимание целый комплекс гармонизированных методических материалов и данный валидационный мастер план можно рекомендовать, как образец для дальнейшей работы на аналогичных предприятиях.
Проведена квалификация оборудования использованного при валидации, квалифицированы помещения, где находится система водоподготовки. Квалификация – это первый этап валидации, который проводится для проверки и оценки проектной документации и условий производства на соответствие требованиям нормативной и технической документации.
Валидация требует детальной подготовки и планирования различных этапов и стадий. Кроме того, вся работа должна выполняться в определенной последовательности в соответствии с действующими нормативными и технической документами [4,5].
Целью валидационного мастер плана является получение документального подтверждения того, что система водоподготовки, применяемой в опытном производстве на базе научного центра противоинфекционных препаратов последовательны и воспроизводимы.
Валидационный мастер план включает в себя:
-цели и задачи валидации (политика предприятия в отношении проведения валидации);
-распределение ответственности за проведение валидации/квалификации, написание и утверждение валидационных протоколов, и др.;
- вид, стадии и этапы валидации/квалификации;
- место и время проведения работ;
-выполнение процесса;
-обработка результатов испытаний;
-критерии приемлемности процедуры;
- формы валидационных протоколов, отчетов, сводных таблиц и др.;
- калибровку, поверку средств измерений;
-перечень работ по валидации процессов и квалификация условий производства;
-подготовка акта о валидации процесса очистки.
Каждое предприятие должен определять свою методику проведения валидации, исходя из специфики производства. Валидационный мастер план должен корректироваться по результатам контроля за изменениями на действующем производстве [6].
Вода в фармацевтическом производстве является ключевым элементом обеспечивающим безопасность и качество выпускаемых лекарственных средств. Наиболее перспективным и качественным из современных способов получения является метод двухступенчатого обратного осмоса. По эффективности это система не имеет равных, удаляя 99,9% примесей. Поэтому, для гарантированного качества воды очищенной, опытное производство использует двухступенчатую системы обратного осмоса - это самый тонкий уровень фильтрации. Среди преимуществ обратного осмоса следует отметить простоту и независимость от солесодержания исходной воды, низкие энергетические затраты и значительно невысокие затраты на сервис и технический уход [7]. Система водоподготовки достаточно легко подвергается мойке, дезинфекции и очистке, не требует использования сильных химических реагентов и необходимости их нейтрализации.
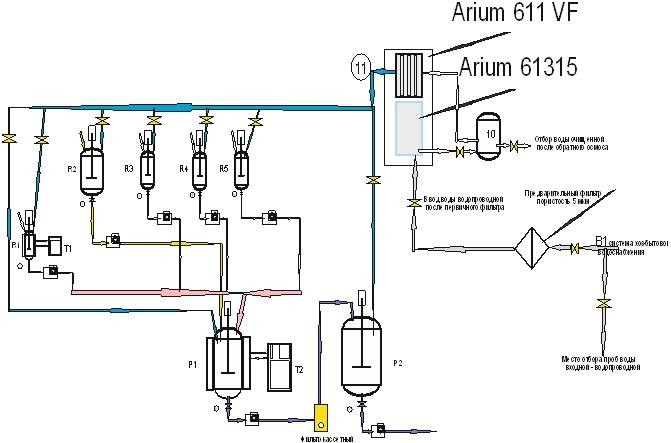
На рис. 1 приведена схема системы водоснабжения с точками отбора.
Рис. 1 – Общая схема водоснабжения с точками отбора
Этапы проведения валидации системы водоподготовки:
1 этап контроля - Точки отбора воды очищенной:
Точка № 1 - городская сеть - вода питьевая - ежедневно
выход из накопителя после Arium 61315 - ежедневно
выход из Arium 611VF после финального фильтра 0,22 мкм - ежедневно
Котлы Р-1; Р-2; R-1; R-2; R-3; R-4; R-5. - ежедневно
2 этап контроля - Точки отбора воды очищенной:
Точка № 1 - городская сеть - вода питьевая контроль на МБЧ - ежедневно
выход из накопителя после Arium 61315 контроль на МБЧ - ежедневно
выход из Arium 611VF после финального фильтра 0,22 мкм
контроль на МБЧ - ежедневно
Котлы Р-1; Р-2; R-1; R-2; R-3; R-4; R-5.
контроль по физико-химическим свойствам - ежедневно
3 этап контроля - Точки отбора воды очищенной:
Таблица 1 –План пробоотбора воды питьевой и очищенной в производстве в течении 11 месяцев (этап 3)
| № | Точка пробоотбора | М/биологические анализы | Ф/химические анализы |
| 1 | Вход из городской сети | 1 раз в неделю | 2 раза в месяц |
| 2 | Выход из накопителя после Arium 61315 | 1 раз в неделю | 1 раз в месяц |
| 3 | Выход из Arium 611VF после финального фильтра 0,22 мкм | 1 раз в неделю | 1 раз в месяц |
|
4 |
Котлы Р-1; Р-2; R-1; R-2; R-3; R-4; R-5. | 1 раз в неделю на выбор чередовать |
1 раз в месяц на выбор чередовать |
Процесс валидации системы водоподготовки занимает долгое время и протекает в течении года.
Система GMP требует четкого ведения документации, все производственные операции должны протоколироваться по мере их выполнения [8].
В ходе проведения валидации системы водоподготовки валидации по 1 и 2 этапу была использована следующая документация, разработанная и утвержденная в научном центре [9,10]:
СОП-КК "Порядок отбора проб на испытания и выдачи разрешений отдела контроля качества".
СП-с22 Спецификация на исходное сырье "Вода очищенная".
СП-с30 Спецификация на исходное сырье "Вода питьевая"
И-ПРО-13 "Эксплуатация системы предварительной очистки воды Arium 61315 с накопительным резервуаром и финальной очистки воды Arium 611VF"
SOP-PR-004 "Подготовка производственных помещений и оборудования".
В соответствии с требованиями ГФ и GMP воду очищенную хранят в закрытых емкостях, изготовленных из материалов, не изменяющих свойств воды и защищающих ее от инородных частиц и микробиологических загрязнений с исключительно гладкой поверхностью (менее 0,8 Ra) и защитой надежным фильтром от бактерий, пыли.
Входе проведения 1-го и 2-го этапа валидации системы водоподготовки в соответствии с валидационным мастер-планом ВМП-01 подготовлены и документально оформлены результаты контрольных анализов воды с городской сети и воды очищенной, которую используют в производстве в процессе технологии лекарственных средств.
Из результатов проведенных анализов можно сделать вывод, что процесс водоподготовки приводит к получению надежных и соответствующих нормам спецификации и потому считается валидированным.
Система водоподготовки признается устойчивой, так как при всех зарегистрированных изменениях качества исходной воды, питающей систему, качество полученной воды не выходило за требования спецификации на тип воды. Система водоподготовки признается достаточной, так как при всех вариациях объемов потребления, система водоподготовки удовлетворяла потребностям, и качество полученной воды не выходило за требования спецификации на тип воды.
Таким образом, валидация системы водоподготовки является одним из важных факторов в производстве, соответствующим требованиям GMP. Особенностью валидации системы водоподготовки, несмотря на множество точек отбора, нескольких этапов и продолжительностью во времени, является чистота и четкость проведенных процессов. Проведенная валидация системы водоподготовки гарантирует высокое качество производимых лекарственных средств.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Азембаев А.А. Особенности валидационных процессов в производстве лекарственных средств / А.А.Азембаев, А.Р. Курманалиева // Журнал вестник КазНМУ им С.Д. Асфендиярова. – 2013. – №2. – С. 333 – 335.
- Государственная фармакопея Республики Казахстан. - Алматы: Издательский дом «Жибек жолы». – – Т. 2. – С. 804.
- Приказ Министра Здравоохранения и социального развития Республики Казахстан от 27 мая 2015 года № 392, Об утверждении надлежащих фармацевтических практик.
- Азембаев А.А. Валидация технологических процессов на производстве по стандартам GMP – фактор гарантии качества лекарственных средств / А.А. Азембаев // Сборник научных трудов по материалам Международной научно-практической конференции: «Современные тенденции в науке, технике, образовании» в 3-х частях. Смоленск, 31 января – 2016. – С. 137-139.
- Азембаев А.А. Требования стандарта GMP – основной показатель качества производства лекарственных средств / А.А. Азембаев // Журнал вестник КазНМУ им С.Д. Асфендиярова. – 2013. – №1. – С. 159 – 160.
- Трапкова А.А. Сравнительный анализ требований надлежащей производственной практики Евросоюза и США с требованиями к системе менеджмента качества ИСО 9001 / А.А. Трапкова // Журнал: Менеджмент качества в сфере здравоохранения и социального развития. – 2011. – №3. – С. 4-15.
- Валевко С.А. Вода для фармацевтических целей / С.А. Валевко, Л.Ф. Соколова, В.В. Карчевская // Сборник докладов VII конференции АСИНКОМ. - М., – – С.139-143.
- Азембаев А.А. Система контроля качества на производстве лекарственных средств / А.А. Азембаев, А.Е. Кусниева, К.Б. Бекешева и др. // Сборник тезисов, докладов международной конференции «Поиск и разработка новых противоинфекционных лекарственных средств» 17-19 Сентября – – С. 42-44.
- Азембаев А.А. Ведение документации производства по стандартам GMP / А.А. Азембаев, Г.К. Адибаева, А.С. Калыкова // Вестник науки и образования, Москва. – – №3(15). – C. 53-55.
- Азембаев А.А. Системный Подход в разработке документации на производстве лекарственных средств в соответствии требованиям GMP / А.А. Азембаев, У.М. Датхаев, К.С. Жакипбеков // Вестник Алматинского технологического университета, – 2016. №1 (110). – С. 13-17.
Список литературы на английском языке / References in English
- Azembayev A.A. Osobennosti validatsionnyh prossesov v proizvodstve lekarstvennyh sredstv [Features of validation processes in the manufacture of medicines] / А.А. Azembayev, A.R. Kurmanalieva // Zhurnal vestnik KazNMU im S.D. Asfendiyarova [Journal Vestnik of KazNMU]. – №2. P. 333 - 335. [in Kazakhstan]
- Gosudarstvennaya farmakopeya Respubliki Kazakhstan [State Pharmacopoeia of the Republic of Kazakhstan]. – Almaty: Izdatel'skiy dom «Zhibek zholy» [Almaty: Publishing House "Zhibek Zholy"]. – V. 2. P. 804. [in Kazakhstan]
- Prikaz Ministra Zdravookhraneniya i sotsial'nogo razvitiya Respubliki Kazakhstan [Order of the Minister of Health and Social Development of the Republic of Kazakhstan] 27 May 2015 № 392. Ob utverzhdenii nadlezhashchikh farmatsevticheskikh praktik [On approval of appropriate pharmaceutical practices]. [in Kazakhstan]
- Azembayev A.А. Validatsiya tekhnologicheskikh protsessov na proizvodstve po standartam GMP – faktor garantii kachestva lekarstvennykh sredstv [Validation of technological processes in production according to GMP standards - a factor of quality assurance of medicines] / A.A. Azembayev // Sbornik nauchnykh trudov po materialam Mezhdunarodnoy nauchno-prakticheskoy konferentsii: «Sovremennyye tendentsii v nauke, tekhnike, obrazovanii» v 3-kh chastyakh. [Collected scientific papers on the materials of the International Scientific and Practical Conference: "Modern Trends in Science, Engineering, Education" in 3 parts]. Smolensk, January 31 – P. 137-139. [in Russian]
- Azembayev A.A. Trebovaniya standarta GMP – osnovnoy pokazatel' kachestva proizvodstva lekarstvennykh sredstv [Requirements of the GMP standard - the main indicator of the quality of production of medicines] / А.А. Azembayev // Zhurnal vestnik KazNMU im S.D. Asfendiyarova [Journal Vestnik of KazNMU]. – №1. P.159-160. [in Kazakhstan]
- Trapkova A.A. Sravnitel'nyy analiz trebovaniy nadlezhashchey proizvodstvennoy praktiki Yevrosoyuza i SSHA s trebovaniyami k sisteme menedzhmenta kachestva ISO 9001 [Comparative analysis of the requirements of good manufacturing practices of the European Union and the United States with the requirements for the quality management system ISO 9001] / A.A. Trapkova // Zhurnal: Menedzhment kachestva v sfere zdravookhraneniya i sotsial'nogo razvitiya [Journal: Quality management in the field of health and social development]. – №3. P. 4-15. [in Russian]
- Valevko S.A. Voda dlya farmatsevticheskikh tseley [Water for pharmaceutical purposes] / S.A Valevko, L.F. Sokolova, V.V. Karchevskaya // Sbornik dokladov VII konferentsii ASINKOM [Proceedings of the VII ASINCOM Conference] - M., – P. 139-143. [in Russian]
- Azembayev A.А. Sistema kontrolya kachestva na proizvodstve lekarstvennykh sredstv [Quality control system in the production of medicines] / A.А. Azembayev, A.E. Kusnievа, K.B. Bekesheva and others // Sbornik tezisov, dokladov mezhdunarodnoy konferentsii «Poisk i razrabotka novykh protivoinfektsionnykh lekarstvennykh sredstv» [The collection of abstracts, reports of the international conference "Search and development of new anti-infectious drugs"] September 17-19 Almaty, – Р. 42-44. [in Kazakhstan]
- Azembayev A.A. Vedeniye dokumentatsii proizvodstva po standartam GMP [Maintenance of production documentation according to GMP] / A.A. Azembayev, G.K. Adibaeva, A.S. Kalykova // Vestnik nauki i obrazovaniya [Bulletin of Science and Education], Moscow. – №3 (15). P. 53-55. [in Russian]
- Azembayev A.A. Sistemnyy Podkhod v razrabotke dokumentatsii na proizvodstve lekarstvennykh sredstv v sootvetstvii trebovaniyam GMP [System Approach in the development of documentation for the manufacture of medicinal products in accordance with the requirements] / GMP Azembayev, U.M. Datkhaev, K.S. Zhakibbekov // Vestnik Almatinskogo tekhnologicheskogo universiteta [Bulletin of Almaty Technological University]. – 2016. №1 (110). P. 13-17. [in Kazakhstan]