Structural and functional characteristics of rat liver in diet-induced obesity and its pharmacocorrection by a new compound with dihydropyridine framework
Structural and functional characteristics of rat liver in diet-induced obesity and its pharmacocorrection by a new compound with dihydropyridine framework
Abstract
The morphofunctional state of the liver of patients in modern realities attracts the attention of specialists. Polypragmasia, irrational nutrition and toxic environmental factors leave an imprint on the work of the liver. Today, one of the topical directions is the search for new effective and safe means possessing hepatoprotective activity.
Objective of the study. To examine the reactive, adaptive and reparative capabilities of the liver in diet-induced obesity and its pharmacocorrection by a new compound with dihydropyridine framework.
Materials and Methods. The study was carried out on 32 sexually mature rats of Wistar line. Intact group – rats received standard daily diet, control group – animals in addition to daily diet received excessive amount of palm oil (30 g/kg of weight for 8 weeks), then they were intraperitoneally administered dexamethasone 0.125 mg/kg for 13 days, comparison group – animals after formation of metabolic disorders were orally administered metformin at the rate of 300 mg/kg of body weight for 14 days. The experimental group included animals that received a compound with the code AZ-383 (1 mg/kg body weight for a fortnight) after the formation of metabolic disorders.
Results and their discussion. It was found that animals on a high-fat diet and course administration of dexamethasone led to a significant increase in absolute (by 29.67%) and relative (by 20%) liver weight in comparison with similar indices in intact rats. Administration of a new derivative of 1,4-dihydropyridine with the code AZ-383 promoted normalization of absolute and, to a greater extent, relative mass of the studied detoxification organ. Administration of the original heterocyclic compound with the code AZ-383 reduced the degree of structural and functional changes in the liver. The substance promoted partial restoration of liver histoarchitectonics. The favourable effect on the functional state of the liver and integrity of hepatocytes of the studied compound AZ-383 is confirmed by the indices of total bilirubin and aminotransferases in the biochemical blood analysis of rats, which have statistically no differences with the values in rats of the intact group.
Conclusion. The 1,4-dihydropyridine derivative synthesized by us is able to prevent the changes in liver structure and function occurring during high-fat diet and dexamethasone administration, which is of interest for further research.
1. Введение
Информация ВОЗ за последнее десятилетие свидетельствует о том, что проблема избыточного веса и ожирения среди населения различных возрастных групп чрезвычайно актуальна, поскольку нарастание частоты встречаемости этого предиктора многих сердечно-сосудистых, эндокринных и терапевических заболеваний носит характер эпидемии . Помимо того, что ожирение само по себе вызывает серьезные метаболические нарушения, оно также в большинстве случаев предрасполагает к развитию тяжелых заболеваний, таких как атеросклероз, ишемическая болезнь сердца, инсулиннезависимый сахарный диабет, заболевания печени, эндокринной системы и другие , , и , , .
При ожирении страдают практически все системы организма, при этом уникальным органом, где перекрещиваются практически все метаболические пути, осуществляются ключевые обменные процессы, является печень. Многообразие выполняемых в организме человека и млекопитающих функций печени, ее непосредственное влияние на углеводный, белковый и липидный обмен создает предпосылки для детального изучения морфофункционального состояния этого органа в условиях различных экзогенных воздействий. С позиций анализа этапов фармакокинетики лекарственных средств важно отметить главенствующую роль печени, как важнейшего органа детоксикации в живом организме , , .
В современной медицинской практике среди токсических поражений печени наиболее важное значение имеют медикаментозные гепатиты , . Лекарственные вещества могут оказывать негативное влияние на печень при передозировке, а иногда и в условиях применения терапевтических доз. Установлено, что смертность от медикаментозных поражений печени составляет 5-10% от всех случаев лекарственных гепатитов , . Проблема лекарственного поражения печени остается актуальной проблемой здравоохранения отчасти потому, что еще недостаточно ясны механизмы, лежащие в основе неблагоприятных реакций . Медикаментозные повреждения печени могут быть наиболее распространённой причиной острой печёночной недостаточности и являются причиной трансплантации печени, а также того, что лекарственные препараты, которые разрабатываются, не попадают в производство. Кроме того, медикаментозные поражения печени также является одной из частых причин прекращения разработки новых препаратов, отзыва уже действующих препаратов с фармацевтического рынка и введения ограничения на их использование. Лекарственные поражения печени являются наиболее частой причиной снятия препаратов с продажи. Группы лекарственных поражений печени подразделяются на предсказуемые (дозозависимые) и непредсказуемые. Многим лекарственным препаратам свойственно токсическое действие на печень, а увеличение дозы этих препаратов приводит к повышению риска возникновения гепатотоксичности , , . В настоящее время насчитывается более 1200 агентов, способных вызвать повреждения структуры печени. Среди них есть лекарственные препараты, которые выпускаются по рецепту и без него .
Данные исследований свидетельствуют о том, что лекарственные средства являются непосредственной причиной 40% клинических случаев возникновения гепатита и около 25% диагностированных случаев фульминантной печёночной недостаточности . При этом лекарственные поражения печени чаще возникают при энтеральном применении, что обусловлено особенностями кровоснабжения печени и ее структурно-функциональными особенностями, в отличие от почек, на которые оказывают влияние лекарственные средства независимо от пути их введения , , .
Глюкокортикоиды назначаются пациентам при широком спектре заболеваний, при этом наибольшей популярностью в лечении многих воспалительных, аутоиммунных заболеваний и аллергических реакций пользуется фторированный синтетический препарат этой группы – дексаметазон. Препараты из этой фармакологической группы регулируют многочисленные физиологические и метаболические процессы с помощью геномных и негеномных механизмов, опосредованных их связыванием с цитозольными глюкокортикоидными рецепторами. Последние принадлежат к суперсемейству ядерных рецепторов, регулируемых лигандами, которые широко экспрессируются в организме и имеют гены-мишени передач сигналов в различных тканях и типах клеток, включая печень и адипоциты , , . Несмотря на важнейшие для фармакотерапии ряда нозологий фармакодинамические эффекты дексаметазона, внушительный ряд неблагоприятных действий вследствие длительного курса лечения заставляет врачей различных специальностей сталкиваться с подобного плана рисками.
По данным отдельных авторов, диеты с высоким содержанием жиров, способствующие их накоплению в виде диацилглицерина, триацилглицерина и церамидов, напрямую связаны с инсулинорезистентностью. В последние десятилетия возросло использование и, следовательно, потребление продуктов, содержащих пищевое пальмовое масло (сгущённое молоко, майонез, маргарин, детские молочные смеси и кондитерские изделия) . В рационе людей прослеживается уменьшение количества свежих пищевых продуктов и увеличение доли пальмового масла. Его использование связано с физико-химическими свойствами (остаётся в твёрдом и полутвердом состоянии при комнатной температуре, в отличие от большинства масел растительного происхождения), высоким уровнем рентабельности производства продуктов, а также с длительным сроком хранения и оптимальным товарным видом продуктов .
В связи с важностью проблемы фармакотерапии ожирения, профилактики его осложнений разработка новых эффективных гепатопротекторных препаратов с высоким профилем безопасности при высокожировой диете (ВД) является актуальной с учетом масштаба полипрагмазии в современном мире. В ранее проведенных нами исследованиях оценивалась масса тела животных, находящихся на ВД с применением дексаметазоновой нагрузки и фармакологической коррекции. Установлено, что внутрижелудочное введение новых производных альфа-цианотиоацетамида с лабораторными шифрами AZ-383, AZ-257, AZ-020 приводило к более сглаженному и менее интенсивному набору массы тела после отмены дексаметазона. Лечение метаболических нарушений метформином, как и вилдаглиптином приводило к постепенному набору массы тела животных. Масса крыс, принимавших новые соединения в течение 14 дней, была меньше веса грызунов, получающих в течение 2-х недель метформин и вилдаглиптин, на 10%. Данная тенденция демонстрирует благоприятное влияние изучаемых новых производных альфа-цианотиоацетамида на массу тела .
Новые гетероциклические органические соединения из ряда производных тиенопиридинов и 1,4-дигидропиридинов дериватов цианотиоацетамида представляют интерес в медицинской химии благодаря их разнообразной биологической активности, включая антибактериальные, противовирусные, противоопухолевые, противовоспалительные и антиоксидантные свойства , , . Цианотиоацетамид используется в синтезе важнейших азотсодержащих тиенопиридиновых структур с различным типом аннелирования и производных дигидропиридина, которые могут быть использованы для оценки их возможной гепатопротекторной активности в экспериментах на лабораторных животных , , .
На базе научно-исследовательской лаборатории «ХимЭкс» Луганского государственного университета им. Владимира Даля, нами были синтезированы 380 новых гетероциклических соединений дериватов цианотиоацетамида . Оригинальные вещества были подвергнуты биоскринингу с помощью онлайн-сервиса Swiss Target Prediction, разработанного в Swiss Institute of Bioinformatics и сервиса Pass Online на Way2drug Predictive Service , . Это позволило выделить производное альфа-цианотиоацетамида с лабораторными шифрами AZ-383 (рис. 1), обладающее потенциальным сродством к орексиновым рецепторам типа 1, 2; рецепторам желчных кислот, связанным с G-белком 1; киназе-3 гликогенсинтазе, никотинамидфосфорибозилтрансферазе, аденозиновым рецепторам A1, A2a, A2b.
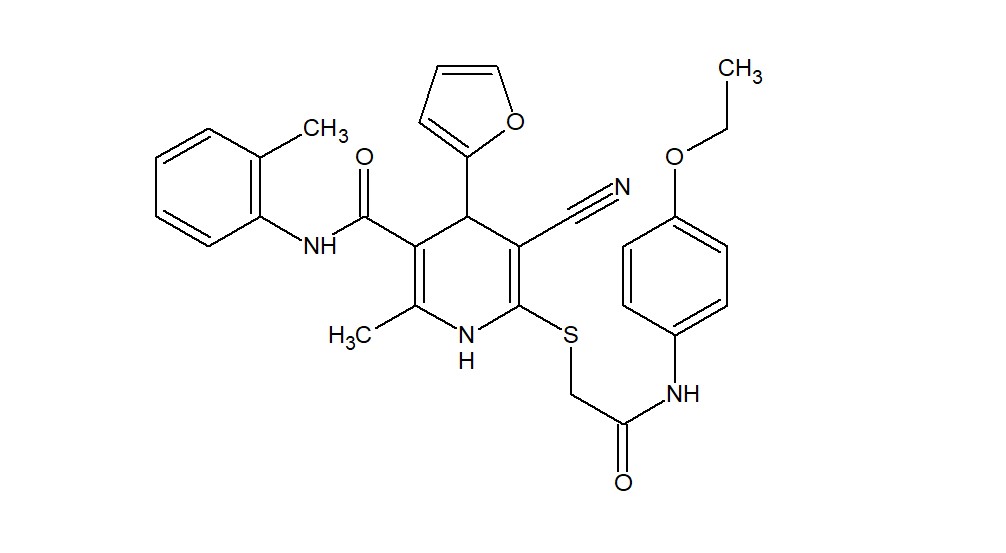
Рисунок 1 - Химическая формула соединения с лабораторным шифром AZ-383
Целью исследования было изучение реактивных, адаптационных и репаративных возможностей печени при диет-индуцированном ожирении и его фармакокоррекции новым соединением с дигидропиридиновым каркасом.
2. Методы и принципы исследования
Эксперимент выполнен на 32 половозрелых крысах-cамцах линии Wistar, поступивших из питомника филиал «Столбовая» ФГБУН НЦБМТ ФМБА России, в НИИ экспериментальной биологии и медицины ФГБОУ ВО «ВГМУ им. Н.Н. Бурденко» МЗ РФ. В течение всего эксперимента животные находились под наблюдением, содержались в одинаковых условиях и получали корм и воду в свободном доступе. Все манипуляции с лабораторными животными осуществляли в соответствии с ГОСТ №33216-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами», ГОСТ 33215-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур», ГОСТ 33044-2014 «Принципы надлежащей лабораторной практики». Дизайн эксперимента был рассмотрен и одобрен на заседании Этического комитета ФГБОУ ВО «ВГМУ имени Н.Н. Бурденко» Министерства здравоохранения РФ, протокол №5 от 18.10.2022 г.
Исследования выполняли по следующему дизайну проводимого нами рандомизированного контролируемого исследования (табл. 1).
Таблица 1 - Дизайн проводимого рандомизированного контролируемого исследования
Экспериментальная группа | Моделирование |
Интактная (8 крыс) | Стандартный суточный рацион и вода в свободном доступе. |
Контрольная – ВД + Д (8 крыс) | Животные в дополнение к суточному рациону получали избыточное количество пальмового масла из расчета 30 г/кг веса в течение 8 недель (высокожировая диета – ВД), затем внутрибрюшинно вводили дексаметазон (Д) 0,125 мг/кг на протяжении 13 дней. |
Сравнения – ВД + Д + М (8 крыс) | Животным после формирования метаболических нарушений путем высокожирового питания и стероидной нагрузки (ВД + Д) перорально вводили метформин (М) из расчета 300 мг/кг массы тела на протяжении 14 дней. |
Опытная – ВД + Д + AZ-383 | Высокожировая нагрузка в течение 8 недель и введение дексаметазона на протяжении 13 дней (ВД + Д). В качестве фармакологической коррекции вводили соединение с лабораторным шифром AZ-383 в дозировке 1 мг/кг массы тела в течение двух недель. |
В эксперимент не включались животные, с различием в массе более, чем на 50 г, а также особи женского пола. Из эксперимента исключались животные с агрессивным поведением и травмированные. Рандомизация проводилась методом «конвертов». Наблюдение за лабораторными животными осуществлялось ежедневно в течение всего периода моделирования метаболических нарушений и этапа фармакологической коррекции. Все крысы получали корм и воду в свободном доступе. Чистота клеток, комфортные условия животным обеспечивались регулярно.
Методами исследования были: оценка массы тела животных и печени. Массу крыс измеряли еженедельно. По окончанию эксперимента фиксировали массу животных всех экспериментальных групп, а также массу печени (абсолютную и относительную) крыс всех экспериментальных групп.
Биохимические методы исследования включали определение концентрации общего билирубина, активности аланинаминотрансферазы и аспартатаминотрансферазы энзиматическим колориметрическим методом при выводе животных из эксперимента в крови из бедренной вены.
После выведения животных из эксперимента для морфологического исследования атравматично забирали печень. Для морфологического исследования фиксировали части правой доли печени в 10% формалине в фосфатном буфере, затем проводили заливку тканей в парафин и готовили гистологические срезы толщиной 5 мкм, используя гистопроцессор МТР-120 и Tissue-Tec-5 (Sakura).
Срезы печени крыс окрашивали гематоксилином Джилла и эозином. Срезы печени (на каждом не менее 40 полей зрения) исследовали на аппаратно-программном комплексе для биологических исследований с системой документирования на основе прямого исследовательского микроскопа ZEISS Axio Imager.А2 для достижения репрезентативности выборки. Также изучали способность клеток печени к накоплению гликогена путем проведения ШИК-реакции по Мак-Манусу (McManus), представляющей выявление гликогена методом Шифф-йодная кислота. Реакция основана на способности йодной кислоты окислять спиртовые группы, что при условии взаимодействия с реактивом Шиффа (фуксин-сернистая кислота) приводит к образованию кислото-стойкого красителя красно-фиолетового цвета. ШИК-положительные вещества окрашиваются в различные оттенки красного цвета. Нейтральные мукополисахариды, содержащие гексозу, – пурпурно-красные, гликоген – темно-красный.
При проведении статистической обработки полученных результатов эксперимента осуществляли проверку полученных данных на нормальность распределения по критерию Шапиро-Уилка (в онлайн-ресурсе Shapiro-Wilk Test Calculator), так как в каждом случае количество замеров n < 50. Установлено, что почти все данные по группам имеют нормальное распределение (значение p > α). Поэтому обработка данных производилась методами параметрической статистики с определением среднего значения xср, медианы Ме, стандартного отклонения σ (S) в указанном онлайн-ресурсе. Различия сравниваемых величин считали статистически значимыми при p<0,05.
3. Основные результаты
В проведенном эксперименте зафиксировано, что масса тела крыс контрольной группы после двухмесячного приема в пищу дополнительно к суточному рациону пальмового масла была достоверно больше показателей у крыс интактной группы. К концу восьмой недели эксперимента масса тела животных, находившихся на ВД, возросла на 18-20% в сравнении с массой тела крыс интактной группы. Инъекции дексаметазона способствовали уменьшению массы тела на 10% от значений, зарегистрированных до начала применения дексаметазона, но они не достигли показателей, зафиксированных у крыс интактной группы (табл. 2).
Таблица 2 - Показатели массы тела и массы печени животных экспериментальных групп
Группа | Масса печени абсолютная, г | Масса печени относительная, % | Масса животных, г |
Интактная | 9,1±0,3 | 2,5±0,1 | 366±13 |
Контрольная (ВД+Д) | 11,8±0,7* | 3,0±0,1* | 386,8±12 |
Сравнения (ВД+Д+М) | 11,2±0,5* | 2,7±0,2 | 419±14* |
Опытная (ВД+Д+AZ-383) | 9,8±0,4 | 2,6±0,1 | 378±12 |
Примечание: * – р<0,05 в сравнении с показателями интактной группы
Как видно из полученных данных, масса тела крыс группы сравнения была достоверно (на 14,48%) выше таковой у интактных крыс (табл. 2). Лабораторные животные опытной группы, получавшие на протяжении двух недель производное 1,4-дигидропиридина с шифром AZ-383, не имели статистически значимых различий с аналогичным показателем интактных крыс.
Органометрические показатели печени, изучаемые нами в эксперименте, абсолютная и относительная массы, также представлены в табл. 2. Животные контрольной группы после длительного потребления пальмового масла и курсового введения дексаметазона характеризовались достоверным (р<0,05) увеличением абсолютной (на 29,67%) и относительной (на 20%) массы печени в сравнении с интактными крысами. Использование на протяжении двух недель метформина с целью фармакокоррекции метаболических расстройств в условиях проводимого нами эксперимента способствовало увеличению (на 23,07%) абсолютной массы печени животных при сопоставлении с показателями интактных животных. Однако относительная масса изучаемого органа крыс группы сравнения существенных изменений не претерпела.
Введение на протяжении двух недель внутригастрально один раз в сутки с целью фармакологической коррекции комплекса моделируемых у подопытных животных метаболических нарушений нового производного 1,4-дигидропиридина с лабораторным шифром AZ-383 в дозировке 1 мг/кг массы тела способствовало нормализации абсолютной и, в большей степени, относительной массы изучаемого органа детоксикации.
Для оценки функционального состояния печени крыс-самцов линии Вистар были изучены следующие биохимические показатели крови животных всех экспериментальных групп (табл. 3).
Таблица 3 - Биохимические показатели периферической крови животных экспериментальных групп
Группа животных | АЛТ, Ед/л | АСТ, Ед/л | Общий билирубин, мкМоль/л |
Интактная группа | p = 0,75 Нормальность распределения - Да xср = 59,5 Ме = 59,6 σ (S) = 8,23 V, % = 13,8 | p = 0,37 Нормальность распределения - Да xср = 146,5 Ме = 147,7 σ (S) = 16,83 V, % = 11,5 | p = 0,89 Нормальность распределения - Да xср = 10,9 Ме = 10,9 σ (S) = 6,44 V, % = 59,1 |
Контроль-ная группа (пальмовое масло + дексамета-зон) | p = 0,09 Нормальность распределения - Да xср = 105,3* Ме = 108,9 σ (S) = 9,91 V, % = 9,40 | p = 0,65 Нормальность распределения - Да xср = 192,6* Ме = 190,5 σ (S) = 8,97 V, % = 4,60 | p = 0,86 Нормальность распределения - Да xср = 23,7* Ме = 23,6 σ (S) = 3,46 V, % = 13,6 |
Группа сравнения (Метформин) | p = 0,43 Нормальность распределения - Да xср = 57,5 Ме = 55,9 σ (S) = 6,61 V, % = 11,5 | p = 0,34 Нормальность распределения - Да xср = 181,7* Ме = 180,0 σ (S) = 10,9 V, % = 6,0 | p = 0,43 Нормальность распределения - Да xср = 10,7 Ме = 10,7 σ (S) = 1,12 V, % = 10,5 |
Опытная группа (AZ-383) | p = 0,15 Нормальность распределения - Да xср = 56,8 Ме = 54,0 σ (S) = 6,56 V, % = 11,5 | p = 0,61 Нормальность распределения - Да xср = 155,9 Ме = 157,8 σ (S) = 14,5 V, % = 9,30 | p = 0,38 Нормальность распределения - Да xср = 11,9 Ме = 11,8 σ (S) = 0,69 V, % = 5,80 |
Примечание: нормальность распределения при уровне значимости α = 0,05 и условии p > α; xср – среднее значение; Ме – медиана; σ (S) – стандартное отклонение; V – коэффициент вариации; * – достоверно значимые различия в сравнении с группой интактных животных
У крыс группы ВД+В концентрация общего билирубина в крови была выше в 2,17 раза чем в группе интактных крыс. При этом использование в качестве фармакокорректора метформина привело к нормализации уровня общего билирубина в крови крыс группы сравнения. Также крысы опытной группы, получавшие на фоне метаболических расстройств, вызванных избытком жиров в рационе и дексаметазоновой нагрузкой, имели нормальные значения общего билирубина.
При анализе биохимических показателей крови крыс референтной и опытной группы, как видно из табл. 3, достоверных отличий по показателям общего билирубина и аланинаминотрансферазы и аспартатаминотрансферазы не зафиксировано. При этом выявлено повышение активности аланинаминотрансферазы в крови животных контрольной группы в 1,8 раза по сравнению с показателями в интактной группе. Это может свидетельствовать о синдроме цитолиза гепатоцитов, развивающемся вследствие воздействия сочетанных экзогенных факторов.
У крыс группы ВД+Д при макроскопическом исследовании было обнаружено существенное увеличение размеров печени. Она имела дряблую консистенцию, тургор паренхимы был снижен. Поверхность печени была гладкой и имела различные оттенки желтого цвета (от желто-беловатого до ярко-желтого). У большинства крыс такая окраска была диффузной и распространялась на всю поверхность печени, а у некоторых она чередовалась с участками печени, имеющими нормальную (красно-бурую) окраску. У крыс интактной, группы сравнения (референтной) и опытной групп визуальных отличий при органолептическом исследовании печени нами не было выявлено.
Гистологическое исследование печени крыс интактной группы показало, что общая архитектоника органа была не нарушена, синусоиды не расширены, отмечалось их радиальное расположение (рис. 2). В вершинах долек были расположены портальные тракты, которые представлены междольковой артерией, междольковой веной и междольковым желчным протоком. Это, так называемая «триада», компоненты которой окружены междольковой соединительной тканью. В центре долек располагается умеренно наполненная центральная вена. При окраске гематоксилином Джилла и эозином цитоплазма гепатоцитов печени крыс имела однородную окраску, вакуолей не наблюдалось. Гепатоциты были богаты гликогеном (рис. 2), имели полигональную форму, центрально расположенное ядро. Изредка в поле зрения микроскопа встречались двуядерные клетки печеночной паренхимы.
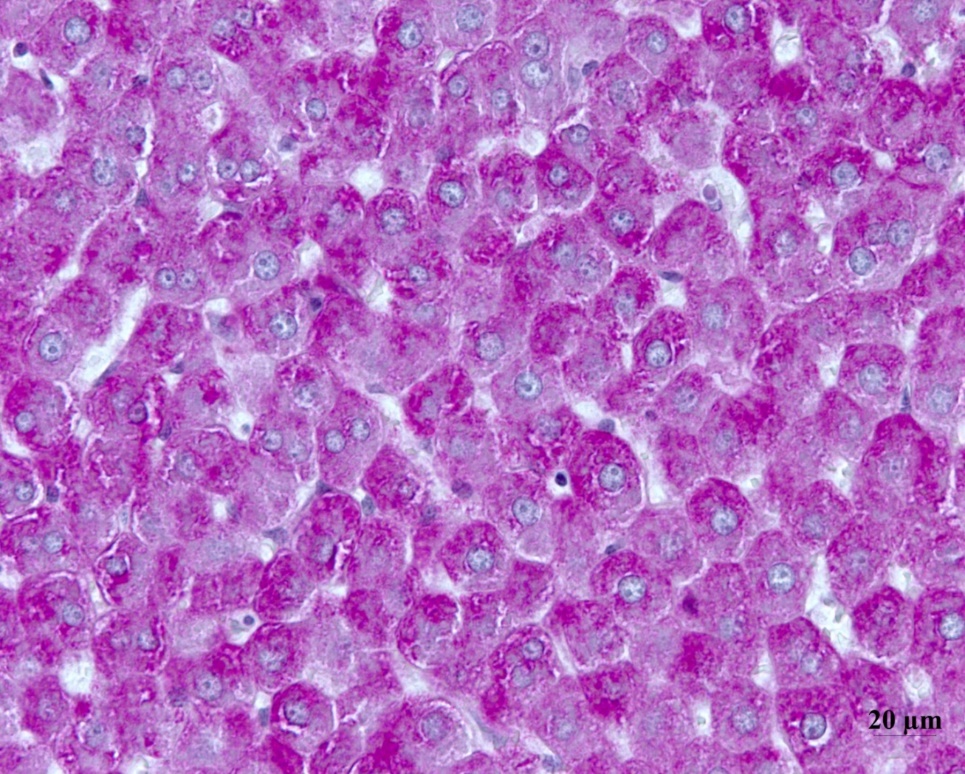
Рисунок 2 - Участок печени крысы интактной группы
Примечание: ШИК реакция
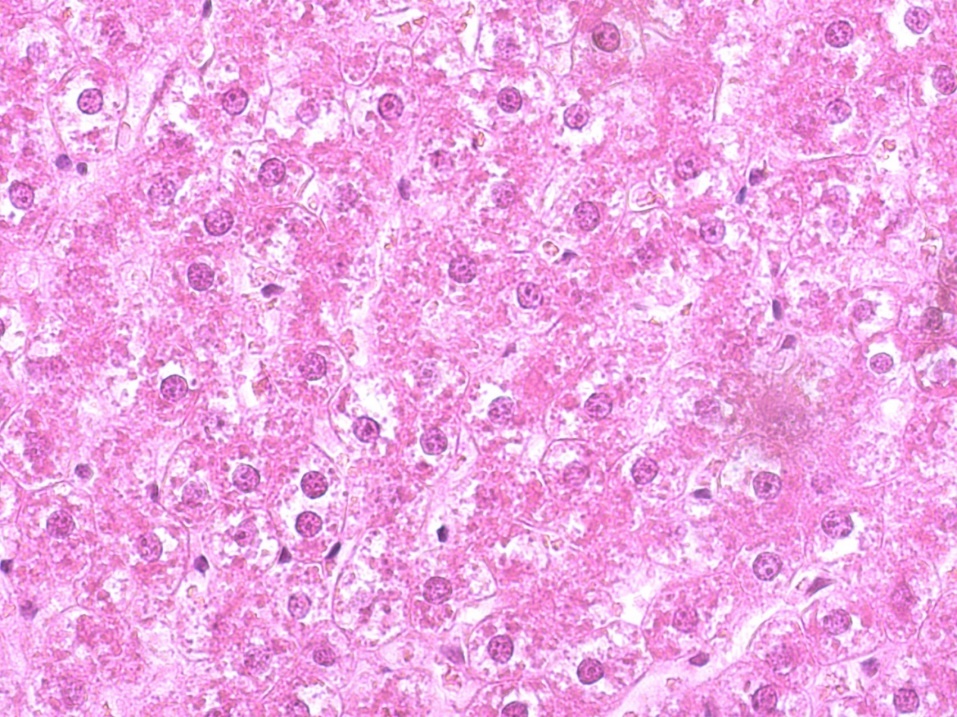
Рисунок 3 - Печень крысы контрольной группы после жировой и дексаметазоновой нагрузки
Примечание: увеличение х400, окраска гематоксилином Джилла-эозином
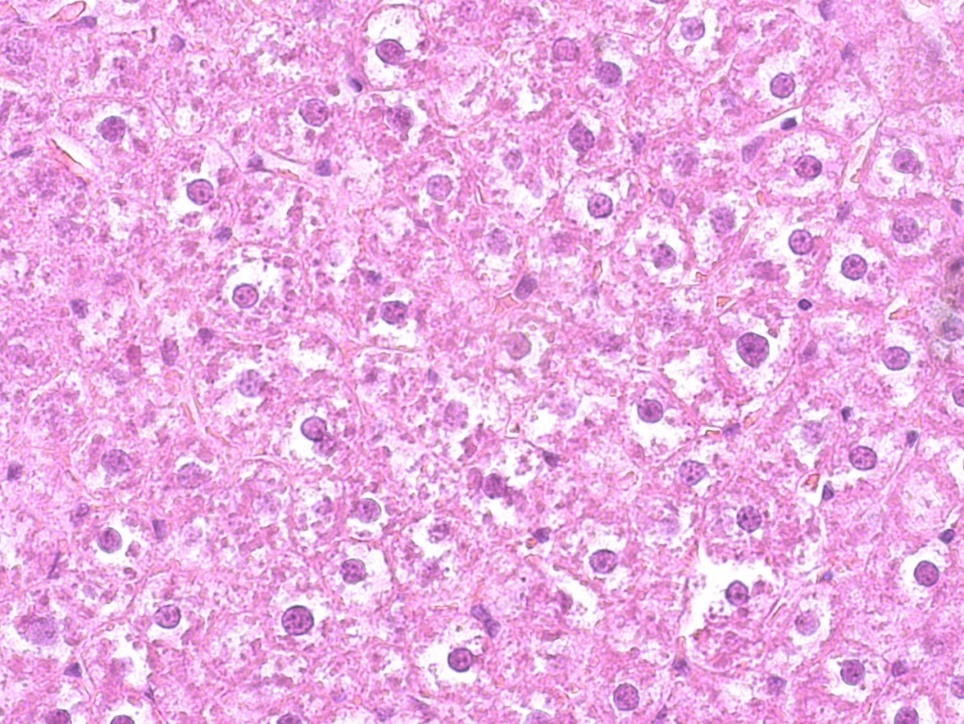
Рисунок 4 - Печень крысы контрольной группы после жировой и дексаметазоновой нагрузки
Примечание: увеличение х400, окраска гематоксилином Джилла-эозином
Важно отметить, что в печеночных дольках экспериментальных животных (контрольной группы) наблюдалось неравномерное распределение гликогена в гепатоцитах, тогда как в печени крыс интактной группы оно было равномерным, как видно на рис. 2. При этом содержание гликогена было снижено по сравнению с интактными животными.
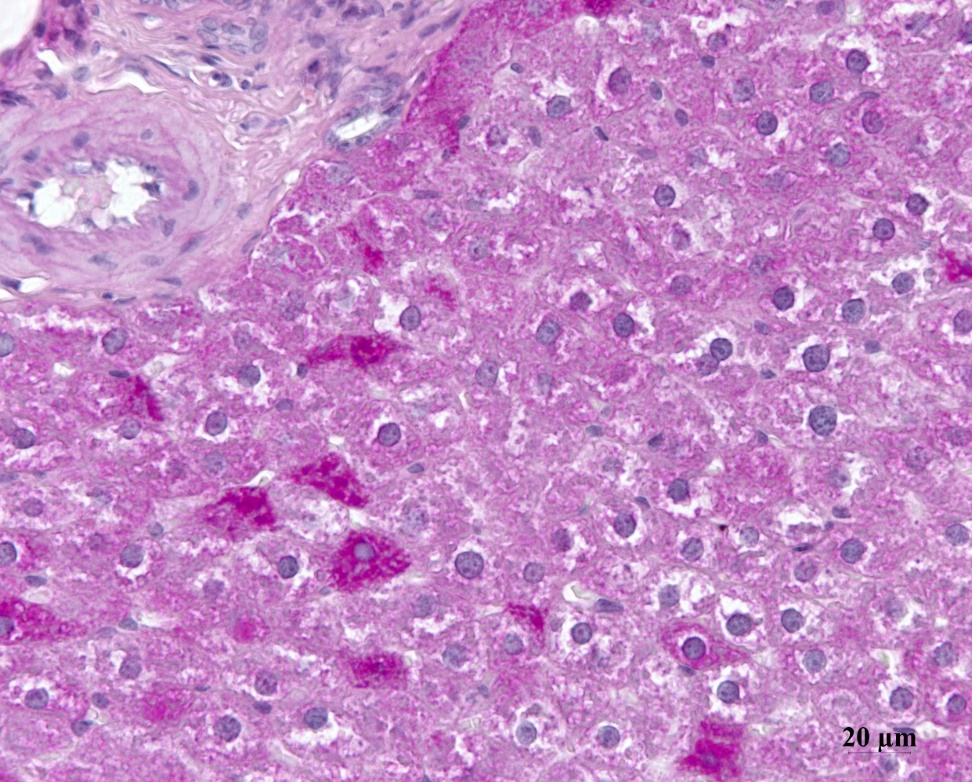
Рисунок 5 - Печень крысы контрольной группы после ВД и дексаметазоновой нагрузки
Примечание: ШИК-реакция
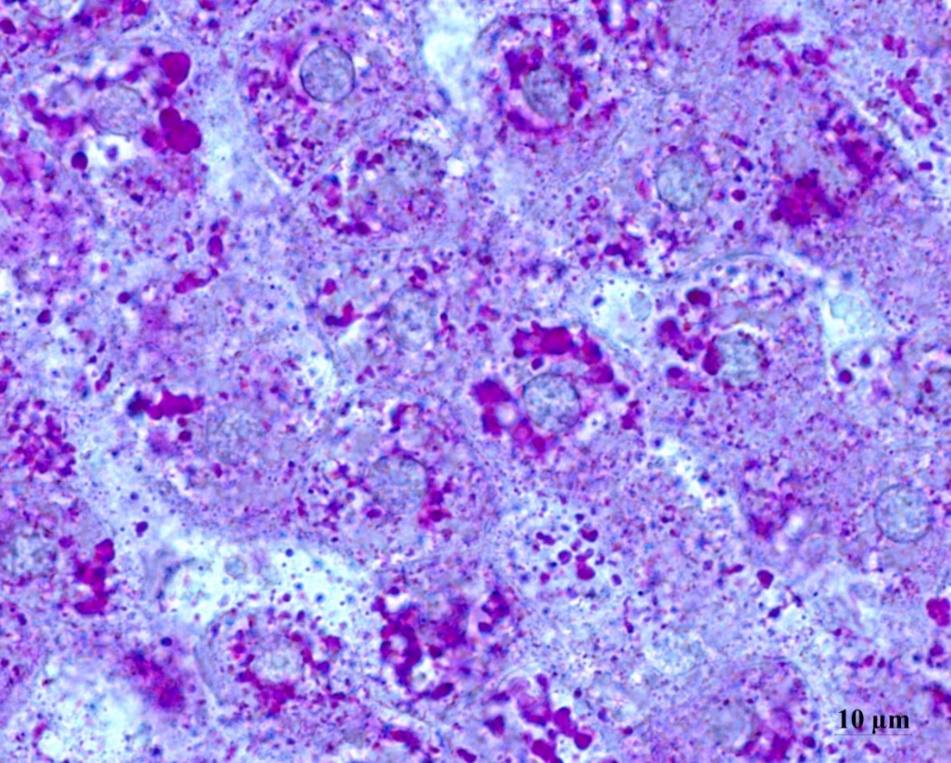
Рисунок 6 - Печень крысы контрольной группы после ВД и дексаметазоновой нагрузки
Примечание: ШИК-реакция
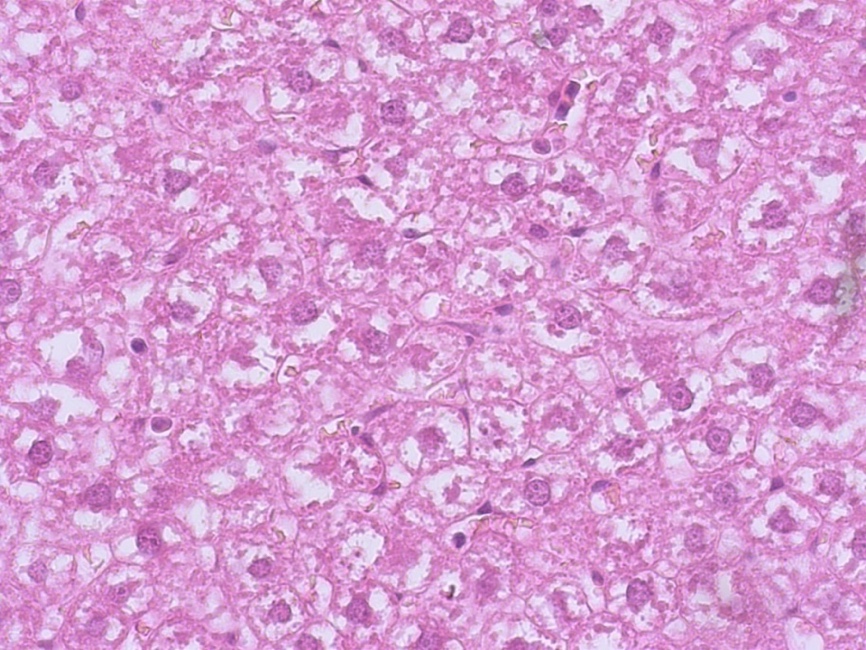
Рисунок 7 - Печень крысы группы сравнения, получавшей ВД, дексаметазон и фармакокрррекцию метформином
Примечание: увеличение х400, окраска гематоксилином Джилла-эозином
Макроскопическое исследование печени крыс с ВД и дексаметазоновой нагрузкой и последующей фармакокоррекцией соединением с шифром AZ-383 показало, что, как и в группе интактных, поверхность печени животных гладкая, однородной темно-красной окраски, капсула тонкая, прозрачная, печень на разрезе полнокровная, умеренно плотная.
У опытной группы (ВД + Д + AZ-383) структура печени и балочное строение долек сохранились (рис. 8). Синусоидные капилляры были не расширены. В центролобулярных отделах гепатоциты были без изменений, а в периферических отделах долек обнаруживалась слабо выраженная гиалиново-капельная дистрофия гепатоцитов.
Анизоцитоз ядер гепатоцитов встречался в единичных случаях, зоны некроза и кровоизлияния по периферии долек выявлялись значительно реже. Количество участков гидропической и зернистой дистрофии уменьшалось, в цитоплазме отмечалось накопление гликогена. Ядра гепатоцитов округлой или овальной формы с двумя и более ядрышками были расположены ближе к центру клеток, имели хорошо окрашенную ядерную оболочку.
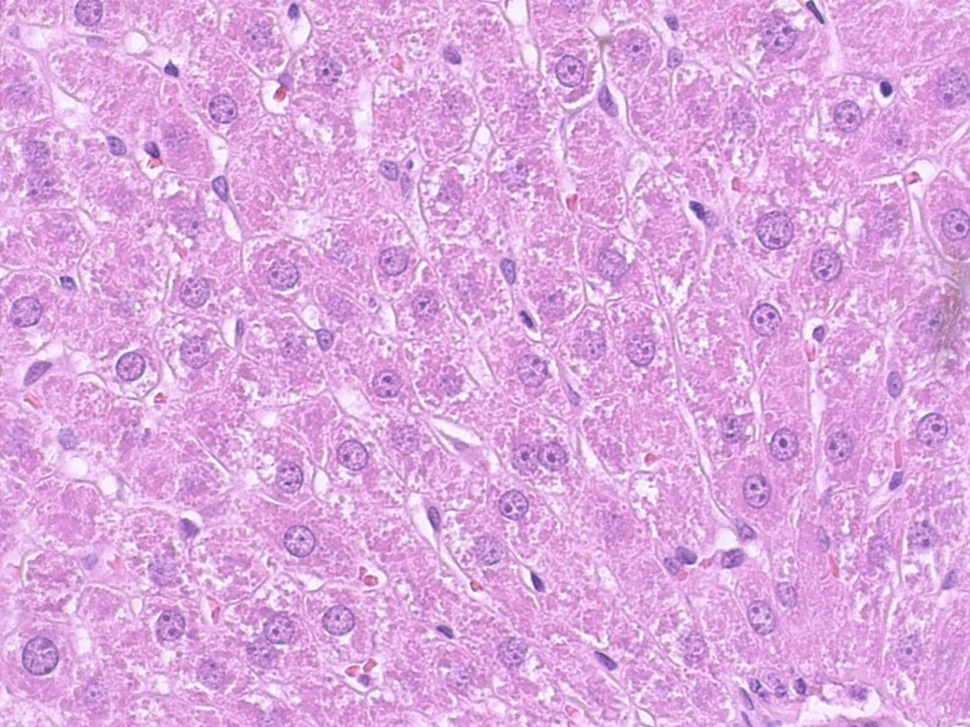
Рисунок 8 - Печень крысы опытной группы, получавшей новое производное цианотиоацетамида с шифром AZ-383
Примечание: увеличение х400, окраска гематоксилином Джилла-эозином
Динамика изменения содержания многоядерных гепатоцитов в печеночных дольках печени крыс опытной группы свидетельствует о том, что доля двуядерных гепатоцитов увеличилась по сравнению с контрольными значениями, что говорит о повышении активности регенерационных процессов в печеночных дольках.
4. Обсуждение
Таким образом, алиментарное ожирение, с одной стороны, приводит к развитию в паренхиме органа жировой дистрофии, а с другой стороны – стимулирует функциональную активность гепатоцитов, что можно расценивать как компенсаторную реакцию (адаптивную перестройку) в ответ на повышенное потребление жиров. Структурные изменения в паренхиматозных клетках сопровождаются функциональным напряжением капиллярно-соединительнотканных структур, нарушением кровообращения и лимфотока в печени.
Проведенное исследование свидетельствует о возможности оригинального производного дигидропиридина с лабораторным шифром AZ-383 восстанавливать морфофункциональное состояние печени крыс после диет-индуцированного ожирения. Об этом свидетельствуют изменения биохимических показателей периферической крови – снижение повышенного общего билирубина, активности аланинаминотрансферазы, аспартатаминотрансферазы. Также на фоне введения нового производного 1,4-дигидропиридина с шифром AZ-383 крысам с ожирением выявлены морфологические изменения, свидетельствующие об активации регенеративной способности печени.
Существенным фактом, выявленным в наших экспериментах, является наличие многочисленных двуядерных гепатоцитов, что свидетельствует об активном процессе регенерации паренхимы печени.
Увеличение сохранности гранул гликогена на срезах печени крыс, получавших соединение с шифром AZ-383 для фармакокоррекции ВД и стероидного препарата, по нашему мнению, препятствовало развитию ишемических изменений в органе и значительно уменьшает риск возможного поражения печени вследствие гипоксии. Морфологическими признаками регенерации органа могут служить двуядерные гепатоциты.
Полученные данные могут быть обусловлены результатами проведённого ранее виртуального биоскрининга. Согласно последнего предполагаемыми биомишенями для нового гетероциклического соединения с лабораторным шифром AZ-383 являются орексиновые рецепторы типа 1, 2 – участвуют в регуляции углеводного обмена и аппетита; рецепторы желчных кислот, связанные с G-белком 1 – их стимулирование повышает выработку инсулина β-клетками поджелудочной железы, способствует снижению инсулинорезистентности периферических тканей, уменьшению массы тела, нормализации липидного обмена; киназа-3 гликогенсинтазы – угнетение фермента приводит к повышению синтеза гликогена и вызывает пролиферацию β-клеток поджелудочной железы; никотинамидфосфорибозилтрансфераза – фермент обладает антидиабетической активностью; аденозиновые рецепторы A1, A2a, A2b – стимулирование рецепторов повышает уровень антиоксидантной защиты, способствует цитопротекторному действию.
5. Заключение
Установлено, что пребывание животных на ВД и курсовое введение дексаметазона приводят к достоверному увеличению абсолютной (на 29,67%) и относительной (на 20%) массы печени в сравнении с аналогичными показателями у интактных крыс. Введение на протяжении двух недель внутригастрально один раз в сутки с целью фармакологической коррекции комплекса моделируемых у подопытных животных метаболических нарушений нового производного 1,4-дигидропиридина с лабораторным шифром AZ-383 в дозировке 1 мг/кг массы тела способствовало нормализации абсолютной, и, в большей степени, относительной массы изучаемого органа детоксикации.
Введение на протяжении двух недель оригинального гетероциклического соединения с шифром AZ-383 (5-cyano-6-({2-[(4-ethoxyphenyl)amino]-2-oxoethyl}thio)-4-(2-furyl)-2-methyl-N-(2-methylphenyl)-1,4-dihydropyridine-3-carboxamide) в дозе 1 мг/кг в сутки животным после ВД и дексаметазоновой нагрузки значительно уменьшало степень структурно-функциональных изменений в печени. Это вещество способствовало частичному восстановлению гистоархитектоники печени.
Подтверждением благоприятного влияния на функциональное состояние печени и целостность гепатоцитов изучаемого производного 1,4-дигидропиридина после ВД и введения дексаметазона служат показатели общего билирубина и аминотрансфераз в биохимическом анализе крови крыс, статистически не имеющие различий со значениями у крыс интактной группы.
Дальнейшей перспективой исследований является более детальное изучение влияния новых производных альфа-цианотиоацетамида на печень, поджелудочную железу и биохимические показатели крови в условиях этого эксперимента на животных.
