ВЫДЕЛЕНИЕ, ХАРАКТЕРИСТИКА И ПРИМЕНЕНИЕ МЕМБРАННОЙ ФРАКЦИИ БАКТЕРИЙ GLUCONOBACTER OXYDANS
Кузнецова Е.А.
Магистрант кафедры приборостроения, бакалавр химических наук,
Тульский Государственный Университет, г. Тула,
ВЫДЕЛЕНИЕ, ХАРАКТЕРИСТИКА И ПРИМЕНЕНИЕ МЕМБРАННОЙ ФРАКЦИИ БАКТЕРИЙ GLUCONOBACTER OXYDANS
Аннотация
Разработана методика получения мембранных фракций бактерий Gluconobacter oxydans для использования их в биосенсорах и биотопливных элементах. Спектрофотометрическим методом определена активность ферментного препарата с использованием хинониминового красителя 2,6-дихлорфенолиндофенола (2,6-ДХФИФ). Установлено, что повышение центробежного ускорения до 101000g позволяет более полно осадить мембранные фракции бактерий Gluconobacter oxydans, при этом полученный ферментный препарат обладает наибольшей активностью в отношении потребления кислорода, что делает его более эффективным биокатализатором.
Ключевые слова: мембранная фракция бактерий Gluconobacter oxydans, 2,6-дихлорфенолиндофенол, дегидрогеназная активность, биосенсор.
Kuznetsova E.A.1
1Master’s degree student, Department of Instrument Engineering, Bachelor of Chemistry,
Tula State University, Tula,
FRACTIONATION, CHARACTERISTICS AND USE OF MEMBRANE FRACTION OF GLUCONOBACTER OXYDANS BACTERIA
Abstract
The paper presents the method for obtaining membrane fractions of Gluconobacter oxydans bacteria for the use in biosensors and biofuel elements. The activity of the enzyme preparation with the use of the quinoneimine dye of 2,6-dichlorophenolindophenol (2,6-DXFIH) is determined by a spectrophotometric method. It is established that the increase in the centrifugal acceleration up to 101000g enables a more complete deposistion of membrane fractions of the Gluconobacter oxydans bacteria, and the obtained enzyme preparation has the greatest activity in relation to the oxygen consumption, which makes it a more effective biocatalyst.
Keywords: membrane fraction of Gluconobacter oxydans bacteria, 2,6-dichlorophenolindophenol, dehydrogenase activity, biosensor.
Введение
Биосенсоры – это аналитические устройства нового поколения, которые совмещают в себе идеи как физических, так и химических методов анализа, электронных инноваций, а также достижения современной биотехнологии [1, С. 5]. Биосенсоры находят широкое применение в медицине, различных областях биотехнологии, промышленности и экологическом мониторинге. Поэтому перед учеными стоит ряд задач, связанных с разработкой экономически выгодных, простых в эксплуатации, высокочувствительных приборов для обнаружения требуемых компонентов в образце [2, С. 3].
В настоящее время в качестве биокатализаторов для использования в биосенсорах применяют индивидуальные ферменты и целые клетки микроорганизмов [3, С. 5]. Известно, что ферменты обладают значительно более высокой каталитической активностью в сравнении с целыми клетками. Однако процесс получения индивидуальных ферментов может заметно увеличить конечную стоимость используемого биокатализатора. Дешевой альтернативой ферментам служат мембранные фракции (МФ) бактерий Gluconobacter oxydans, т.к. процесс получения мембранной фракции оказывается менее затратным, по сравнению с выделением ферментов, а также ферменты остаются связанными с дыхательной цепью. В мембранной фракции ферменты оказываются более доступными для медиаторов и для субстратов, в отличие от целых клеток [4, С. 159].
Выделение мембранной фракции бактериальных клеток Gluconobacter oxydans сопряжено с разрушением клеток ультразвуком и дифференциальным центрифугированием полученного биоматериала. Представлялось возможным разработать методику получения мембранных фракций бактерий, охарактеризовать полученный биоматериал и сравнить его активность в отношении потребления кислорода с использованием электрохимического кислородного электрода.
Целью данной работы является выделение и характеристика мембранных фракций бактерий G. oxydans и оценка их активности в отношении потребления кислорода.
Материалы и методы
Культивирование клеток бактерий Gluconobacter oxydans. В работе были использованы бактерии Gluconobacter oxydans subsp. industrius (ВКМ B-1280) из Всероссийской коллекции микроорганизмов РАН. Клетки бактерий выращивали при pH 5,2–5,5 на среде, содержащей: D-сорбит – 200 г/л; дрожжевой экстракт – 20 г/л, дистиллированная вода – 100 мл. Культивирование проводили в колбах объемом 500 мл при температуре 28оС в течение 18 ч. Клетки подвергали центрифугированию при 2800g в течение 15 мин, промывали дважды 20 мМ натрий-фосфатным буферным раствором (рН 6,0) и центрифугировали 15 мин при 2800g [5, С. 255]. Полученные бактериальные клетки подсушивали при температуре 20-23°С и замораживали для длительного хранения при температуре –15°С.
Получение МФ бактерий Gluconobacter oxydans. Клетки бактерий разрушали ультразвуковым диспергатором УЗД11-0,1/22 в натрий-фосфатном буфере (рН 6,0). Время воздействия ультразвуком насчитывало 2 минуты при входной мощности 100 Вт и рабочей частоте 22 кГц. Далее проводили дифференциальное центрифугирование полученного клеточного лизата при трех различных центробежных ускорениях. На первом этапе лизат центрифугировали при 3000g. После первого центрифугирования оседает, в основном, крупный клеточный дебрис, содержание дегидрогеназ в нем минимально. Мембранные дегидрогеназы содержались в надосадочной жидкости. На втором этапе по первой методике проводилось центрифугирование при 12300g, по второй методике при 48400g, а по третьей при 101000g, что приводило к осаждению мембранных фракций бактерий. Центробежное ускорение, развиваемое центрифугой, для третьей методики было выбрано на основании работы [6, C. 104]. В данном эксперименте при ускорении 100000g полностью осадили МФ бактерий G. oxydans.
Полученные осадки, являющиеся мембранными фракциями, в микропробирках подсушивали при температуре 20-23°С. В качестве биокатализатора в биосенсорном измерении использовали новую дозу ферментного препарата для каждого последующего эксперимента.
Измерение содержания белка. Для количественного определения белка в ферментном препарате использовали метод Лоури. Измерения проводили на спектрофотометре СФ 104 («Аквилон», Россия) при длине волны 700 нм.
Измерение дегидрогеназной активности. Для измерения дегидрогеназной активности ферментного препарата применяли хинониминовый краситель 2,6-дихлорфенолиндофенол (2,6-ДХФИФ) с концентрацией в кювете 0,6мМ [7, С. 1505]. Измерения осуществляли в кинетическом режиме на спектрофотометре СФ 104 при длине волны 600 нм.
Исследование кинетики потребления кислорода МФ бактерий с использованием кислородного электрода. В основе работы ферментных электродов лежит ферментативная реакция окисления глюкозы, катализируемая ферментом глюкоздегидрогеназой, входящим в состав мембранной фракции. В околоэлектродном пространстве уменьшается содержание кислорода, что регистрируется кислородным электродом [8, С. 83].
Преобразователем служил прибор рН-метр-иономер-БПК-термооксиметр Эксперт-001-4.0.1 («Эконикс-эксперт», Москва) в режиме «термооксиметр», что давало возможность регистрировать непрерывный сигнал.
Результаты и обсуждение
Измерение содержания белка. В таблице 1 представлены результаты количественного определения белка по методу Лоури на втором этапе получения МФ бактерий G. oxydans.
Таблица 1 – Содержание белка в мембранных фракциях бактерий
| II центрифугирование | ||
| Осадок (мембранная фракция) | ||
| Методика 1 | Масса белка в 1 г фракции, мг | 99±8 |
| Методика 2 | 118±9 | |
| Методика 3 | 130±10 | |
Определение дегидрогеназной активности. Для оценки дегидрогеназной активности мембранной фракции был использован краситель 2,6-дихлорфенолиндофенол, который эффективно взаимодействует с PQQ-зависимыми дегидрогеназами G. oxydans, а его способность изменять цвет при окислении и восстановлении используется для фотометрического определения дегидрогеназной активности.Полученная по третьей методике, мембранная фракция содержит на 31±2мг белка больше, чем мембранная фракция, полученная по первой методике. Таким образом, увеличение центробежного ускорения, развиваемого центрифугой, с 12300g до 101000g привело к наиболее полному осаждению белка из надосадочной жидкости, полученному при первом центрифугировании.
Определение основано на следующих реакциях (рис.1):
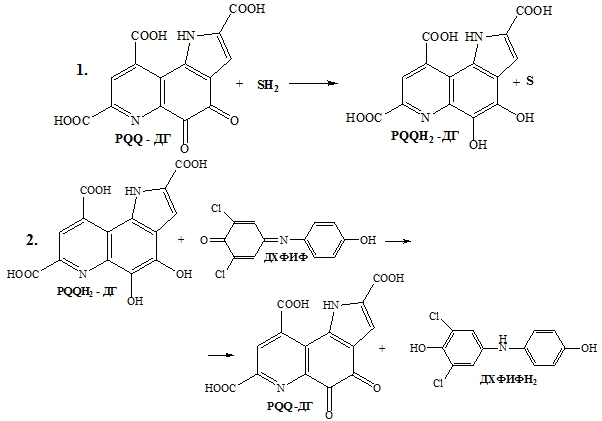
Рис.1 – Этапы взаимодействия 2,6-ДХФИФ с PQQ-зависимыми дегидрогеназами G. oxydans
1. Перенос заряда с субстрата на активный центр фермента. 2. Перенос заряда с фермента на медиатор.
Примечание: SH2 – восстановленная форма субстрата (глюкоза), S – окисленная форма субстрата (глюконо-1,5-лактон).Рис.1 – Этапы взаимодействия 2,6-ДХФИФ с PQQ-зависимыми дегидрогеназами G. oxydans
На данном этапе исследования были измерены тангенсы угла наклона линейного участка зависимости оптической плотности от времени, которые являются константами скорости восстановления редокс-красителя (2,6-ДХФИФ) для МФ, полученных по трем методикам. Полученные данные использовались для расчета удельной дегидрогеназной активности ферментного препарата (табл.2).
Удельной активностью фермента называют число единиц ферментативной активности в расчете на 1 мг белка.
![]() , где
, где
![]() – удельная активность (мкмоль/мг мин)
– удельная активность (мкмоль/мг мин)
![]() – константа скорости восстановления редокс-красителя (с-1);
– константа скорости восстановления редокс-красителя (с-1);
![]() – объем раствора в кювете (л);
– объем раствора в кювете (л);
![]() =21300 – коэффициент молярного поглощения 2,6-ДХФИФ (л/(моль см);
=21300 – коэффициент молярного поглощения 2,6-ДХФИФ (л/(моль см);
![]() = 1– толщина поглощающего слоя (см);
= 1– толщина поглощающего слоя (см);
![]() – количество белка (г).
– количество белка (г).
Таблица 2 – Дегидрогеназная активность мембранных фракций
| Методика 1 (12300g) | Методика 2 (48400g) | Методика 3 (101000g) | |
| Мембранная фракция | |||
| Удельная активность, мкмоль/мг мин | 0,32±0,05 | 0,48±0,05 | 0,54±0,06 |
Удельная дегидрогеназная активность мембранной фракции, полученной по третьей методике, оказалась более чем в 1,6 раза выше, чем удельная активность мембранной фракции, полученной по первой методике. Следовательно, увеличение центробежного ускорения приводит к увеличению дегидрогеназной активности осадка из-за наиболее полного осаждения МФ из надосадочной жидкости, полученной при первом центрифугировании.
По литературным данным активность фермента глюкозодегидрогеназы, полученного из бактериальных клеток G. oxydans на 2 порядка превышает активность полученной мембранной фракции [9]. На это может влиять высокая степень очистки фермента и оптимальные условия проведения реакции.
Исследование кинетики потребления кислорода МФ бактерий G. oxydans при помощи кислородного электрода. В биосенсорных измерениях использовали МФ бактерий G. oxydans, полученную по третьей методике, которую разбавили 30 мМ натрий-фосфатным буфером с рН 6,0 в соотношении 1:3 (мг сырого веса/мкл). В кювету добавляли 50 мкл суспензии и 100 мкл 1М раствора глюкозы. Содержание мембранной фракции в кювете 0,0017 г/мл.
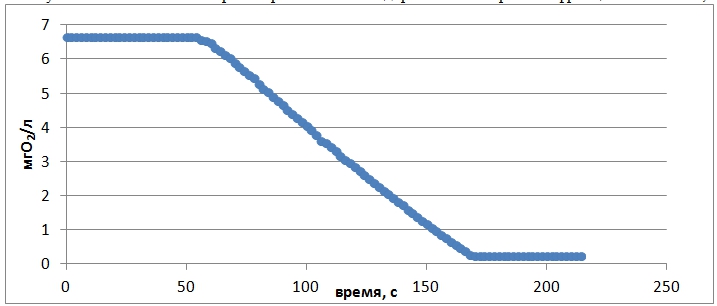
Рис.2 – Скорость потребление кислорода мембранной фракцией бактерий (представлен 1 из 3 графиков).
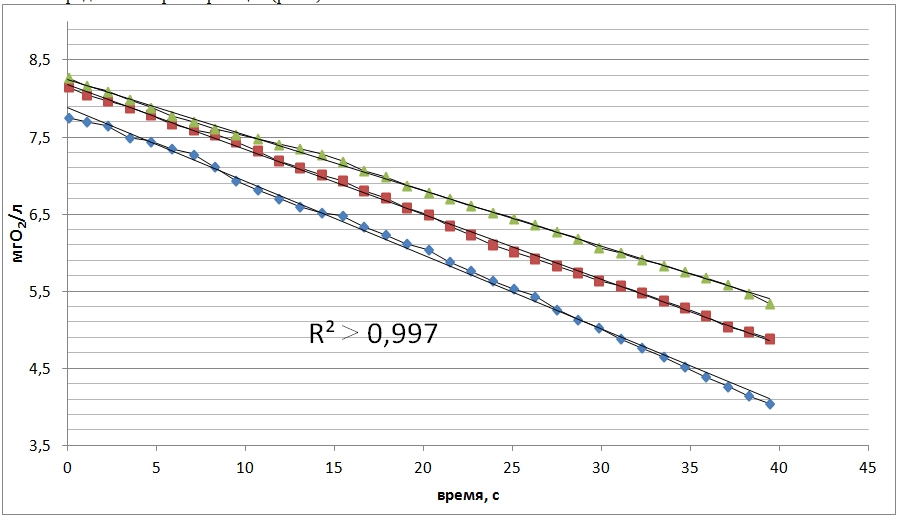
Аппроксимация экспериментальных зависимостей падения уровня кислорода уравнением линейной регрессии позволяет определить скорость реакции (рис.3).
Рис.3 – Линейный участок зависимости падения уровня кислорода от времени.
Скорость потребления кислорода мембранной фракцией, полученной по третьей методике составила 0,08±0,01 мгО2/л·с.
Значение скорости восстановления кислорода, нормированное на единицу массы мембранной фракции, полученной по третьей методике, в объеме раствора составило 0,73 мкмоль/с·г. Ранее при помощи кислородного сенсора была измерена скорость реакции потребления кислорода клетками бактерий G. oxydans, которая составила 0,38 мкмоль/с·г [10, С. 249].
Заключение
В ходе работы для получения МФ бактерий Gluconobacter oxydans были реализованы три методики. Различия, в которых заключались в скорости центрифугирования клеточного лизата. Было установлено, что повышение центробежного ускорения, развиваемого центрифугой, до 101000g позволяет более полно осадить МФ бактерий G. oxydans. При этом полученный препарат имеет наибольшую активность в отношении потребления кислорода, что позволяет использовать его в биосенсорах и биотопливных элементах, как эффективный биокатализатор.
Список литературы / References
- Бабкина Е. Е. Кинетические закономерности функционирования медиаторных биосенсоров на основе бактерий Gluconobacter oxydans : дис. ... канд. хим. наук : 02.00.04, 03.00.23 / Бабкина Елена Евгеньевна. – Тула, 2006. – 129 с.
- Решетилов А. Н. Электрохимические биосенсоры на основе микробных клеток, ферментов и антител : автореф. дис. … д-ра хим. наук : 03.00.23. / Решетилов Анатолий Николаевич. – Москва, 1998. – 43 с.
- Инджгия Е. Ю. Электрокаталитическое окисление этанола ферментными системами бактерий Gluconobacter oxydans в присутствии медиаторов ферроценового ряда : дис. ... канд. хим. наук : 03.01.06 / Инджгия Екатерина Юрьевна. – Москва, 2010. – 131 с.
- Sievers M. The genus Acetobacteraceae / M. Sievers, J. Swings // Bergey's Manual of Systematic Bacteriology. – 2005. – 2nd Edition. – New York. – P. 147–171.
- Нгуен Т. Кинетика восстановления 2,6-дихлорфенолиндофенола в присутствии этанола в биотопливном элементе на основе клеток Gluconobacter oxydans и их мембранной фракции / Нгуен Винь Тиен, В. А. Алферов, С. В. Алферов, и др. // Известия ТулГУ. Естественные науки. – 2012. – №1-1. – С. 254-264.
- Sainz F. Determination of dehydrogenase activities involved in D-Glucose oxidation in Gluconobacter and Acetobacter Strains / F. Sainz, M. J. Torija, M. Matsutani and others // Front. Microbiol. – 2016. – P. 102–108. doi: 10.3389/fmicb.2016.01358
- Понаморева О. Н. Эффективность биоэлектрокаталитического окисления этанола целыми клетками и мембранной фракцией бактерий Gluconobacter oxydans в присутствии медиаторов ферроценового ряда / О. Н. Понаморева, Е. Ю. Инджгия, В. А. Алферов и др. // Электрохимия. – 2010. – Т. 46. – № 12. – С. 1503-1508.
- Арляпов В. А. Применение низкоселективных биосенсоров для определения биохимического потребления кислорода и анализа многокомпонентных смесей : дис. ... канд. хим. наук : 03.00.23 / Арляпов Вячеслав Алексеевич. – Москва, 2009. – 189 с.
- Information on EC 1.1.5.2 - glucose 1-dehydrogenase (PQQ, quinone) [Электронный ресурс]. – Режим доступа: https://www.brenda-enzymes.org/enzyme.php?ecno=1.1.5.2 (дата обращения: 05.11.2017).
- Алферов С. В. Особенности конкуренции между кислородом и 2,6-дихлорфенолиндофенолом в условиях работы микробного топливного элемента / С. В. Алферов, С. В. Возчикова, В. А. Арляпов и др. // Прикладная биохимия и микробиология. – 2017. – № 2. – С. 244–250.
Список литературы на английском языке / References in English
- Babkina E. E. Kineticheskie zakonomernosti funkcionirovanija mediatornyh biosensorov na osnove bakterij Gluconobacter oxydans [Kinetic regularities of the functioning of the mediator of the biosensor based on the bacteria Gluconobacter oxydans] : dis. ... of PhD in Chemistry : 02.00.04, 03.00.23 / Babkina Elena Evgen'evna. – Tula, 2006. – 129 p. [in Russian]
- Reshetilov A. N. Jelektrohimicheskie biosensory na osnove mikrobnyh kletok, fermentov i antitel [Electrochemical biosensors based on microbial cells, enzymes and antibodies] : Abstract of thesis of PhD in Chemistry : 03.00.23. / Reshetilov Anatolij Nikolaevich. – Moskva, 1998. – 43 p. [in Russian]
- Indzhgija E. Ju. Jelektrokataliticheskoe okislenie jetanola fermentnymi sistemami bakterij Gluconobacter oxydans v prisutstvii mediatorov ferrocenovogo rjada [Electrocatalytic oxidation of ethanol by enzyme systems of bacteria Gluconobacter oxydans in the presence of mediators of ferrocene series] : dis. ... of PhD in Chemistry : 03.01.06 / Indzhgija Ekaterina Jur'evna. – Moskva, 2010. – 131 p. [in Russian]
- Sievers M. The genus Acetobacteraceae / M. Sievers, J. Swings // Bergey's Manual of Systematic Bacteriology. – 2005. – 2nd Edition. – New York. – P. 147–171.
- Nguen T. Kinetika vosstanovlenija 2,6-dihlorfenolindofenola v prisutstvii jetanola v biotoplivnom jelemente na osnove kletok Gluconobacter oxydans i ih membrannoj frakcii [Kinetics of recovery of 2,6-dichlorophenolindophenol in the presence of ethanol in biofuel cells based on cells of Gluconobacter oxydans and their membrane fraction] / Nguen Vin' Tien, V. A. Alferov, S. V. Alferov and others // Izvestija TulGU. Estestvennye nauki [Proceedings of Tula State University. Natural Sciences]. – 2012. – № 1–1.– P.254–264. [in Russian]
- Sainz F. Determination of dehydrogenase activities involved in D-Glucose oxidation in Gluconobacter and Acetobacter Strains / F. Sainz, M. J. Torija, M. Matsutani and others // Front. Microbiol. – 2016. – P. 102–108. doi: 10.3389/fmicb.2016.01358
- Ponamoreva O. N. Jeffektivnost' biojelektrokataliticheskogo okislenija jetanola celymi kletkami i membrannoj frakciej bakterij Gluconobacter oxydans v prisutstvii mediatorov ferrocenovogo rjada [Efficiency of bioelectrocatalytic oxidation of ethanol by whole cells and membrane fractions of Gluconobacter oxydans bacteria in the presence of mediators of ferrocene series] / O. N. Ponamoreva, E. Ju. Indzhgija, V. A. Alferov and others // Jelektrohimija [Russian Journal of Electrochemistry]. – 2010. – V. 46. – № 12. – P. 1503–1508. [in Russian]
- Arljapov V. A. Primenenie nizkoselektivnyh biosensorov dlja opredelenija biohimicheskogo potreblenija kisloroda i analiza mnogokomponentnyh smesej [The use of low-selective biosensors for the determination of biochemical oxygen consumption and analysis of multicomponent mixtures] : dis. ... of PhD in Chemistry : 03.00.23 / Arljapov Vjacheslav Alekseevich. – Moskva, 2009. – 189 p. [in Russian]
- Information on EC 1.1.5.2 - glucose 1-dehydrogenase (PQQ, quinone) [Electronic resource]. – URL: https://www.brenda-enzymes.org/enzyme.php?ecno=1.1.5.2 (accessed: 05.11.2017).
- Alferov S. V. Osobennosti konkurencii mezhdu kislorodom i 2,6-dihlorfenolindofenolom v uslovijah raboty mikrobnogo toplivnogo jelementa [Peculiarities of competition between oxygen and 2,6-dichlorophenolinophenol in conditions of work of microbial fuel element] / S. V. Alferov, S. V. Vozchikova, V. A. Arlyapov and others // Prikladnaja biohimija i mikrobiologija [Applied Biochemistry and Microbiology]. – 2017. – № 2. – P. 244–250. [in Russian]