ИСПОЛЬЗОВАНИЕ МЕТОДА ТВЕРДОФАЗНОЙ ЭКСТРАКЦИИ ДЛЯ ОЧИСТКИ 16-α-[18F]ФТОР-17β-ЭСТРАДИОЛА, РАДИОТРЕЙСЕРА ДЛЯ ПЭТ ДИАГНОСТИКИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
ИСПОЛЬЗОВАНИЕ МЕТОДА ТВЕРДОФАЗНОЙ ЭКСТРАКЦИИ ДЛЯ ОЧИСТКИ 16-α-[18F]ФТОР-17β-ЭСТРАДИОЛА, РАДИОТРЕЙСЕРА ДЛЯ ПЭТ ДИАГНОСТИКИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
Научная статья
Федорова О.С.1, Николаева В.C. 2, Красикова Р.Н.3, *
1 ORCID: 0000-0002-9122-9622;
2 ORCID: 0000-0003-2206-2343,
1,2 Санкт-Петербургский государственный университет, Санкт-Петербург, Россия;
3 ORCID: 0000-0002-4201-7949,
1,3 Федеральное государственное бюджетное учреждение науки Институт мозга человека им. Н.П. Бехтеревой Российской академии наук (ИМЧ РАН), Санкт-Петербург, Россия
* Корреспондирующий автор (raisa[at]ihb.spb.ru)
АннотацияПредложен новый метод твердофазной экстракции (ТФЭ) для очистки 16α-[18F]фтор-17β-эстрадиола ([18F]ФЭС), радиофармпрепарата (РФП) для ПЭТ диагностики эстроген-позитивного (ER+) рака молочной железы. [18F]ФЭС получен методом нуклеофильного радиофторирования циклического сульфанильного предшественника MMSE c последующим снятием защиты гидролизом в кислой среде. Для выделения [18F]ФЭС из реакционной смеси методом ТФЭ исследованы одноразовые картриджи на основе различных сорбентов. Было показано, что использование картриджа OASIS WAX 3cc является наиболее эффективным и позволяет получить [18F]ФЭС c радиохимической чистотой >99 % и остаточным содержанием MMSE и химических примесей 2-5 мкг/мл, что позволяет использовать данный РФП в доклинических и клинических исследованиях. Содержание этанола в инъекционной форме препарата составляет 5%, что отвечает требованиям, предъявляемым Государственной Фармакопеей. Преимуществом нового метода очистки является простота, быстрота (40 мин) и возможность автоматизации в современных модулях синтеза. Использование на стадии очистки одноразовых ТФЭ картриджей удовлетворяет современным требованиям GMP.
Ключевые слова: фтор-18, 16α-[18F]фтор-17β-эстрадиол, [18F]ФЭС, твердофазная экстракция, позитронная эмиссионная томография, ПЭТ, радиофармпрепараты, ER+ рак молочной железы.
USAGE OF SOLID-PHASE EXTRACTION METHOD FOR PURIFICATION OF 16-α[18F]FLUORINE-17β-ESTRADIOL, A RADIOTRACER FOR PET DIAGNOSTICS OF BREAST CANCER
Research article
Fedorova O.S.1, Nikolaeva V.S.2, Krasikova R.N.3, *
1 ORCID: 0000-0002-9122-9622;
2 ORCID: 0000-0003-2206-2343,
1,2 St. Petersburg State University, Saint Petersburg, Russia;
3 ORCID: 0000-0002-4201-7949,
1,3 Federal State Budgetary Institute of Science, The Institute of the Human Brain named after N.P. Bekhtereva, Russian Academy of Sciences (IHB of RAS), St. Petersburg, Russia
* Corresponding author (raisa[at]ihb.spb.ru)
AbstractA new method of solid-phase extraction (SPE) for the purification of 16α-[18F]fluorine-17β-estradiol ([18F]FES), radiopharmaceutical (RPC) for PET diagnostics of estrogen-positive (ER +) breast cancer is proposed. [18F]FES was obtained by nucleophilic radiofluorination of the cyclic sulfanyl precursor MMSE with subsequent deprotection by hydrolysis in an acidic medium. In order to separate [18F]FES from the reaction mixture by SPE method, disposable cartridges based on various sorbents have been studied. It was shown that the use of the OASIS WAX 3cc cartridge is the most effective and allows to obtain [18F]FES with radiochemical purity > 99% and the residual content of MMSE and chemical impurities of 2-5 μg/ml, which allows using this RPC in preclinical and clinical studies. The content of ethanol in the injection form of the drug is 5%, which meets the requirements of the State Pharmacopoeia. The advantage of the new cleaning method is simplicity, speed (40 min) and the possibility of automation in modern synthesis modules. The use of disposable SPE cartridges at the purification stage meets modern GMP requirements.
Keywords: fluorine-18, 16α-[18F]fluorine-17β-estradiol, [18F]FES, solid-phase extraction, positron emission tomography, PET, radiopharmaceuticals, ER+ breast cancer.
Позитронная эмиссионная томографии (ПЭТ) - наиболее информативный метод медицинской визуализации, входящий в группу методов ядерной медицины (радионуклидной диагностики). Основная область клинического применения ПЭТ - онкодиагностика. Внедрение этой в буквальном смысле революционной технологии в клиническую практику в 90-е годы открыло новые возможности для in-vivo дифференциации злокачественных и доброкачественных новообразований, определения распространенности опухолевого процесса (уточнения стадии роста опухоли), выявления рецидивов и метастазов после проведенного лечения, областей некроза, планирования и оценки эффективности противоопухолевой терапии [1]. В качестве радиофармпрепаратов (РФП) в ПЭТ используют биологически активные соединения, меченные короткоживущими радионуклидами с позитронным типом распада, из которых наибольшее применение получил 18F (Т1/2 109.7 мин). В ПЭТ диагностике опухолей молочной железы (МЖ) широко применяется 16α-[18F]фтор-17β-эстрадиол ([18F]ФЭС) [2], накопление которого отражает распределение рецепторов к эстрогенам (ER+). Более 75% опухолей МЖ являются гормонально зависимыми, экспрессирующими ER+ рецепторы [3], при этом крайне важно, что опухоли с высоким содержанием ER+, как правило, высоко дифференцированные и хорошо реагируют на гормональную терапию.
Наиболее распространенным методом синтеза [18F]ФЭС, предложенным Лим и его коллегами [4], является стереоселективное 18F-фторирование циклического предшественника, 3-O-метоксиметил-16,17-O-сульфурил-16-эпиестриол (MMSE), с последующим кислотным гидролизом. Методики, используемые в различных ПЭТ центрах, отличаются типом межфазного катализатора (криптофикс К2.2.2 или тетрабутиламмоний карбонат) на стадии радиофторирования и составом реагентов на стадии гидролиза/снятия защиты (HCl или HCl/ ацетонитрил), а также временем протекания каждой стадии. Метод [4] был взят за основу и в настоящей работе, схема синтеза и условия реакций приведены на Рис. 1.
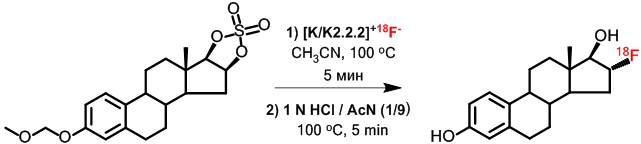
Рис. 1 – Синтез [18F]ФЭС методом прямого нуклеофильного радиофторирования со стереоселективным раскрытием цикла предшественника MMSE
Конечной стадией синтеза любого РФП является очистка и получение инъекционной формы препарата в буфере, разрешенном для клинического применения. Традиционно [18F]ФЭС выделяют из реакционной смеси методом полупрепаративной ВЭЖХ [5-8]. Этот метод обеспечивает высокую чистоту продукта, однако, является длительным, а сама система ВЭЖХ (насос, инжектор, детекторы) требует дополнительного пространства внутри защитного свинцового бокса и технического обслуживания. В связи с этим тенденцией последних лет является использование на стадии очистки РФП более простых и быстрых методов твердофазной экстракции (ТФЭ), хорошо поддающихся автоматизации. В ТФЭ применяют специальные патроны (картриджи), где внутри инертной полиэтиленовой или полипропиленовой оболочки помещается сорбент (45-150 мг), плотно упакованный между двумя пористыми перегородками. Картриджи являются одноразовыми, они легко устанавливаются в линии переноса реагентов в автоматизированные модули синтеза, как это показано на рис. 2., а набор имеющихся сорбентов позволяет решать самые разные задачи.
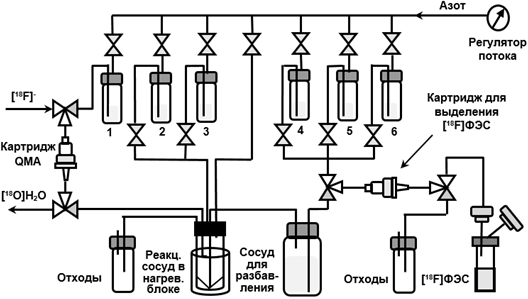
Рис. 2 – Блок схема дистанционно-управляемого модуля синтеза [18F]ФЭС с ТФЭ очисткой
Впервые метод ТФЭ для очистки [18F]ФЭС был применен в 2011 г. [9]. Методика была достаточно сложной: реакционную смесь пропускали через три последовательно соединенных картриджа с различными сорбентами (С18 Sep-Pak, OASIS WAX 3 cc и OASIS HLB 3cc), которые затем промывали 40% этанолом для удаления примесей. [18F]ФЭС элюировали с картриджей 5 мл 95% этанола, после чего проводили дополнительную очистку продукта на картридже Alumina N. Радиохимический выход (РХВ) [18F]ФЭС составлял (20 ± 5)% при времени синтеза 75 минут [9]. Основным недостатком метода является необходимость использования большого объема этанола (5 мл) на стадии элюирования. Поскольку вводимая пациенту концентрация этанола не должна превышать 10% (а по нормам Российской Фармакопеи 5%), элюат, содержащий [18F]ФЭС, приходилось переносить обратно в реактор и упаривать этанол при 90оС. Эта процедура не может быть реализована в большинстве автоматических модулей синтеза. Кроме того, по длительности синтеза предложенный метод мало отличается от классического с очисткой методом полупрепаративной ВЭЖХ.
Целью настоящей работы является разработка нового метода очистки [18F]ФЭС с использованием одного картриджа, без промежуточной стадии упаривания этанола, и сокращение времени синтеза. Последнее является особенно важным с учетом периода полураспада фтора-18 (110 мин).
Радионуклид фтор-18 получали по ядерной реакции 18O(p,n)18F, реализуемой при облучении протонами мишени циклотрона, заполненной водой, обогащенной кислородом-18 ([18O]H2O). Полученный радионуклид стабилизируется в химической форме 18F-фторид-иона, который выделяют из облученной воды сорбцией на анионообменной смоле (картридж QMA, рис. 2) с последующим элюированием раствором, содержащим комплекс криптанда К2.2.2 с и карбоната калия в смеси MeCN/H2O 96/4, согласно ранее разработанной методике. После удаления растворителей в токе азота при 130оС радионуклид в составе активированного комплекса [К 2.2.2]К+18F-, использовали в реакции нуклеофильного радиофторирования. На этой стадии (Рис. 1) использовали 2 мг предшественника MMSE (Huayi Isotopes, Китай) и безводный ацетонитрил (Криохром, Россия) в качестве растворителя. На второй стадии (гидролиз и снятие защиты) использовали смесь 1 N HCl/MeCN в соотношении 1/9.
Контроль протекания каждой стадии, а также эффективность выделения продукта при ТФЭ очистке контролировали методом радиоТСХ (ТСХ сканнер МиниГита фирмы raytest, Германия; пластины силикагель 60 с УФ 254 нм). Анализ радиохимической и химической чистоты проводили методом радиоВЭЖХ (хроматограф Дионекс, США, с детектором УФ и детектором по радиоактивности, CarrolRamsay Assоciates, США). Условия радиоВЭЖХ: колонка X-Bridge C18, 150 х 4,6 мм (Waters), градиентный режим CH3CN + H2O, скорость потока 2,0 мл/мин, УФ 280 нм: 0 - 1,0 мин 20% CH3CN; 1,0 - 9,0 мин. 20 - 90% CH3CN линейное увеличение; 9,0 - 9,2 мин 90 - 20% CH3CN линейное снижение; 9,2 - 15,0 мин. 20% CH3CN - изократический режим; значения Rt для ФЭС и MMSE составляли, соответственно, 5,3 и 8,7 мин.
В результате оптимизации время каждой синтеза было сокращено вдвое, по сравнению с данными других авторов [4-9] и составляло 5 мин. Кроме того, были исключены длительные процедуры упаривания растворителя и промежуточной очистки, что существенно упрощает автоматизацию и сокращает время синтеза.
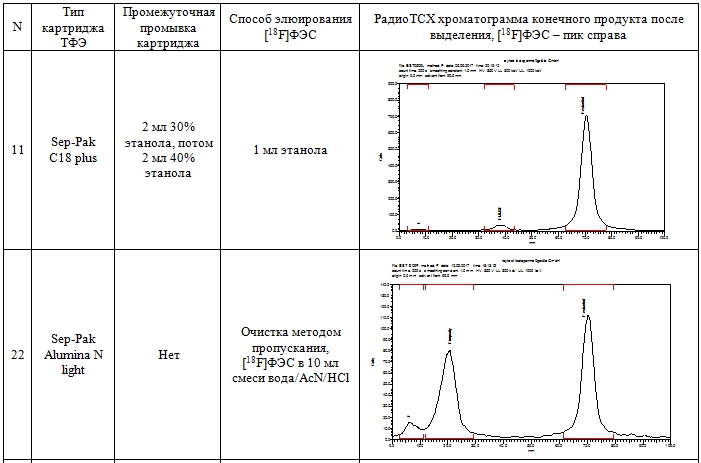
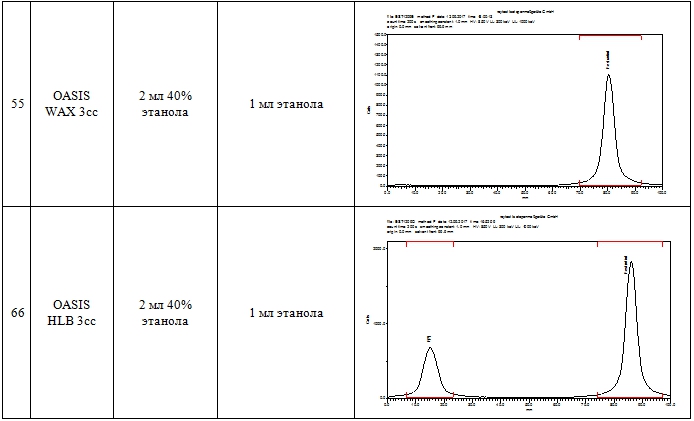
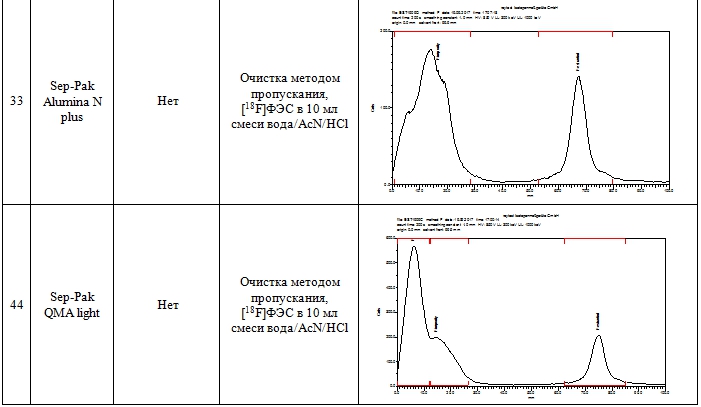
Для очистки методом ТФЭ реакционную смесь, полученную после гидролиза, передавливали током азота в сосуд для разбавления 1, смешивали с 10 мл воды при барботировании газообразным азотом и пропускали через одноразовый картридж. Были протестированы следующие картриджи: Oasis WAX, Oasis HLB, SepPak C18 plus, SepPak QMA light, SepPak Alumina N light и SepPak Alumina N plus. Затем картридж промывали 2 мл 40% водного этанола (за исключением картриджей на основе Alumina и Sep-Pak QMA light), промывной раствор отбрасывали. Промывка картриджа 40% этанолом позволяет удалить сорбированный (непрореагировавший на первой стадии синтеза) [18F]фторид, а также нерадиоактивные примеси с низкой липофильностью. Продукт [18F]ФЭС элюировали с картриджа 1 мл 95% этанола, элюат собирали в стерильный пенициллиновый флакон, содержащий 19 мл 0.9% раствора NaCl. Таким образом [18F]ФЭС получали в виде изотонического раствора (объем 20 мл) с содержанием этанола 5 %, разрешенного к применению. Результаты ТФЭ очистки [18F]ФЭС с использованием различных типов картриджей приведены в табл. 1.
Таблица 1 – Результаты очистки [18F]ФЭС методом ТФЭ
Как видно из данных таблицы 1, наиболее эффективным для ТФЭ очистки является картридж OASIS WAX 3 cc (строка 5 табл. 1), где на радиоТСХ хроматограмме элюата обнаруживается практически единственный пик, соответствующий [18F]ФЭС. При использовании данной методики около 45% активности, сорбированной на картридже, элюируется в виде целевого продукта. Эта активность может быть увеличена за счет использования большего объема этанола, однако при этом трудно будет удовлетворять условиям минимального (5%) содержания этанола в инъекционном растворе. Время синтеза составляет всего 45 мин.
Следует отметить, что при разработке метода ТФЭ очистки достаточно просто подобрать условия, обеспечивающую высокую радиохимическую чистоту продукта, однако, гораздо сложнее достичь высокой химической чистоты. Так, при использовании «классического» обращенно-фазового картриджа Sep-Pak C18 plus (строка 1, табл. 1) радиохимическая чистота также была высокой (более 95%, достаточной для использования в ПЭТ). Однако ВЭЖХ анализ продукта показал присутствие химических примесей (предшественника MMSE и других химических примесей, детектируемых в УФ-области) в количестве 20-40 мкг/мл, тогда как в случае OASIS WAX 3 cc содержание этих примесей составляло 2-5 мкг/мл. Согласно рекомендациям FDA [10] максимальное количество не идентифицированных химических примесей не должно превышать 120 мкг во вводимой дозе при применении препарата в течение 14 суток. [18F]ФЭС, полученный в результате очистки на картридже OASIS WAX 3 cc, вполне удовлетворяет этим требованиям, принимая во внимание тот факт, что РФП пациенту вводят однократно болюсом объемом не более 5 мл. В этом случае максимальное содержание примесей составит 100 мкг в 20 мл.
В заключение, разработанный простой и удобный метод ТФЭ очистки [18F]ФЭС с использованием картриджа OASIS WAX 3 cc позволяет получить данный РФП с высокой химической и радиохимической чистотой за 45 мин. Новый метод очистки легко адаптируется в современные автоматизированные модули синтеза и соответствует требованиям GMP.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Wood K. A. Positron Emission Tomography in Oncology: A Review / K. A. Wood, P. J. Hoskin, M. L. Saunder // Clinical Oncology. – 2007. – Vol. 19. – P. 237-255.
- Van Kruchten M. PET imaging of oestrogen receptors in patients with breast cancer / M. van Kruchten, E. G. de Vries, M. Brown and others // Lancet Oncology. – 2013. – Vol. 14. - P. e465 – e475.
- Liao G. L. [18F]Fluoroestradiol PET: Current Status and Potential Future Clinical Applications / G. L. Liao, A. S. Clark, E. K. Schubert and others // J. Nucl. Med. – 2016. – V. 57. – P. 1269-1275.
- Sundararajan L. 18F-Fluoroestradiol / L. Sundararajan, H. M. Linden, J. M. Link and others // Semin. Nucl. Med. – 2007. – Vol. 37. – P. 470-476.
- Lim, J. L. The use of 3-methoxymethyl-16-beta, 17-beta-epiestriol-O-cyclic sulfone as the precursor in the synthesis of [18F]-16α-fluoroestradiol / J. L. Lim, L. Zheng, M. Berridge and others // Nucl. Med. Biol. – 1996. – Vol. 23. – P. 911-915.
- Romer J. Automated Production of 16α-[18F]fluoroestradiol for Breast Cancer Imaging / J. Romer, F. Fuchtner, J. Steinbach // Nucl. Med. Biol. – 1999 – Vol. 26. – P. 473-479.
- Dixit M. Synthesis of Clinical-Grade [18F]Fluoroestradiol as a Surrogate PET Biomarker for the Evaluation of Estrogen Receptor-Targeting Therapeutic Drug // M. Dixit, J. Shi, L. Wei and others // Int. J. Mol. Imaging. 2003. Research article ID 278607.
- Mori T. Automatic synthesis of 16α-[18F]fluoro-17β-estradiol using a cassette-type [18F]fluorodeoxyglucose synthesizer / T. Mori, S. Kasamatsu, C. Mosdzianowski // Nucl. Med. Biol. – 2006. – Vol. 33. – P. 281-286.
- Oh S. J. The automatic production of 16α-[18F]fluoroestradiol using a conventional [18F]FDG module with a disposable cassette system / S. J. Oh, D. Y. Chi, C. Mosdzianowski and others // Appl. Rad. Isot. – 2007. – Vol. 65. – P. 676-681.
- Knott K. E. Simplified and automatic one-pot synthesis of 16α-[18F]fluoroestradiol without high-performance liquid chromatography purification / K. E. Knott, D. Gratz, S. Hubner and others // J. Label. Compd. Radiopharm. – 2011. – V. 54. - 749-753.
- Guidance for Industry. Genotoxic and Carcinogenic Impurities in Drug Substances and Products: Recommended Approaches. U.S. Department of Health and Human Services Food and Drug Administration. Center for Drug Evaluation and Research (CDER). December 2008.