ВЛИЯНИЕ ВОДЫ, ОБОГАЩЕННОЙ МОЛЕКУЛЯРНЫМ ВОДОРОДОМ, НА ПОВЕДЕНИЕ САМОК CHINCHILLA LANIGERA
ВЛИЯНИЕ ВОДЫ, ОБОГАЩЕННОЙ МОЛЕКУЛЯРНЫМ ВОДОРОДОМ, НА ПОВЕДЕНИЕ САМОК CHINCHILLA LANIGERA
Научная статья
Петров Д.В.1, *, Иванов А.А.2, Панина Е.В.3, Пантелева Н.В.4
1 ORCID: 0000-0002-4281-055X;
3 ORCID: 0000-0001-6711-2873;
1, 2, 3, 4 Российский государственный аграрный университет - МСХА имени К.А. Тимирязева, Москва, Россия
* Корреспондирующий автор (petrov1983dmitriy[at]gmail.com)
АннотацияУстановлено, что включение в рацион животных воды, обогащенной молекулярным водородом, увеличивало общую долю активного поведения. Было выявлено, что животные контрольной группы на неактивные формы поведения (сон, дремота, отдых) затрачивали на сон и отдых больше времени в течение суток, чем в опытной группе. По активным формам поведения (прием корма, автокопрофагия, груминг, прием воды, перемещение по клетке, погрызание деревянного бруска, погрызание сетки клетки, погрызание деревянной полки, прием болюса, потягивание, почесывание, общение с шиншиллами соседней клетки) наибольшие различия были обнаружены по перемещению клетке. Самки опытной группы затрачивали на передвижение в клетке больше времени, чем самки контрольной группы. На груминг у самок опытной группы затрачивалось больше времени в дневной и ночной период в отличие от контрольной группы. По пищевому поведению (прием корма, прием воды и автокопрофагия) выявлено, что в опытной группе на потребление корма шиншиллы расходовали больше времени, чем в контрольной.
Ключевые слова: Chinchilla lanigera; молекулярный водород; антиоксидант; этология; формы поведения.
INFLUENCE OF WATER ENRICHED WITH MOLECULAR HYDROGEN ON THE BEHAVIOR OF CHINCHILLA LANIGERA FEMALES
Research article
Petrov D.V.1, *, Ivanov A.A.2, Panina E.V.3, Panteleva N.V.4
1 ORCID: 0000-0002-4281-055X;
3 ORCID: 0000-0001-6711-2873;
1, 2, 3, 4 Russian State Agrarian University - Moscow Timiryazev Agricultural Academy, Moscow, Russia
* Corresponding author (petrov1983dmitriy[at]gmail.com)
AbstractThe current article establishes that the inclusion of water enriched with molecular hydrogen in the diet of animals increases the total share of their active behavior. It was found that the animals from the control group spent more time on sleep and rest during the day for inactive behaviors (sleep, drowsiness, rest) than the animals from the experimental group. According to the active forms of behavior (consumption, autocoprophagy, grooming, taking water, moving around the cage, gnawing a wooden bar, gnawing the mesh of the cage, gnawing a wooden shelf, bolus feeding, stretching, scratching, communicating with the chinchillas of the neighboring cage), the greatest differences were found in moving around the cage. The females of the experimental group spent more time moving in the cage than the females of the control group. In contrast to the control group, the females of the experimental group spent more time on grooming during the day and night period. Based on the eating behavior (feed intake, water intake and autocoprophagia), it was established that in the experimental group, chinchillas spent more time on feed consumption than in the control group.
Keywords: Chinchilla lanigera; molecular hydrogen; antioxidant; ethology; forms of behavior.
Введение
Малая длиннохвостая шиншилла (Chinchilla lanigera) – грызун, обитающий в Южной Америке. В дикой природе они почти полностью исчезли, а их небольшие колонии сохранились только в чилийских заповедниках [1]. Во всем мире шиншилл выращивают на фермах для получения меха, содержат в качестве лабораторных и домашних животных. Для шиншилл характерен сумеречный образ жизни, поскольку наибольшую активность они проявляют в ночное время суток [2]. В настоящее время для повышения продуктивности и поддержания здоровья животных все чаще в корма вводят антиоксиданты – природные ингибиторы свободнорадикального окисления. К таким веществам относится и молекулярный водород [3], [4], [5].
Молекулярный водород является антиоксидантом с благоприятными для организма физико-химическими свойствами, электрически нейтрален и имеет меньшую молекулярную массу в сравнении с кислородом [6]. Молекулярный водород может легко проникать в клеточные мембраны, ядро и митохондрии. Кроме того, молекулярный водород не оказывает негативного воздействия на физиологические процессы, происходящие как внутри клетки, так и на показатели организма в целом (температуру, кровяное давление, pH).
Молекулярный водород можно вводить различными способами: вдыханием H2; с водой, обогащенной молекулярным водородом; приемом молекулярно-водородных ванн; использованием глазных капель с молекулярным водородом [7]. Обогащение организма H2 увеличивает концентрацию водородного антиоксиданта в крови. Иногда прием воды, обогащенной молекулярным водородом (HRW) может оказывать более эффективный результат, чем вдыхание H2, хотя концентрация молекулярного водорода в воде меньше, чем при ингаляциях [8]. Насыщение HRW молекулярным водородом достигает пика концентрации через 5-15 минут и возвращается к базовым значениям по истечению 45-90 мин после приема [9]. Избыток молекулярного водорода выводится из организма через легкие [10].
В этологическом аспекте влияние HRW не изучено, поэтому целью нашей работы стало выявление влияния HRW на поведенческую адаптацию самок малой длиннохвостой шиншиллы в условиях клеточного содержания.
Методы и принципы исследованияДля проведения этологического исследования были отобраны десять пар клинически здоровых самок Chinchilla lanigera двухмесячного возраста средней массой 268 грамм. Животных содержали в отдельных клетках при постоянной температуре (19 ± 2˚С) с 12-часовыми циклами день/ночь и свободным доступом к корму и воде. Кормление осуществлялось вволю гранулированным комбикормом для шиншилл.
В каждую клетку помещались деревянные бруски для стачивания резцов. Поение обеих групп животных осуществлялось системой автоматического поения с одной лишь разницей, что к системе автоматического поения опытной группы был подключен аппарат для генерации HRW «Lourdes HS-81». Концентрация молекулярного водорода на выходе из ниппельных поилок опытной группы составляла 0,1-1,1 ppm в зависимости от режима работы аппарата. Аппарат для генерации H2 включали два раза в сутки (режим генерации H2) утром и вечером по 30 минут, до отключения таймера, все остальное время он работал в режиме ожидания.
По истечении 10 месяцев содержания в условиях эксперимента проводили этологическое исследование методом дистанционного наблюдения в течение 24 часов с использованием видеосистемы с четырьмя инфракрасными камерами, что позволило в течение суток вести удаленное наблюдение за поведением животных, включая дневное и ночное время и исключая фактор присутствия наблюдателя. При наблюдении за шиншиллами применяли приложение «Мультитаймер» версии 2.6.1.217. Цифровой материал обрабатывали методом вариационной статистики с использованием программы MsExcel. Для выявления статистически значимых различий использовали критерий Стьюдента-Фишера.
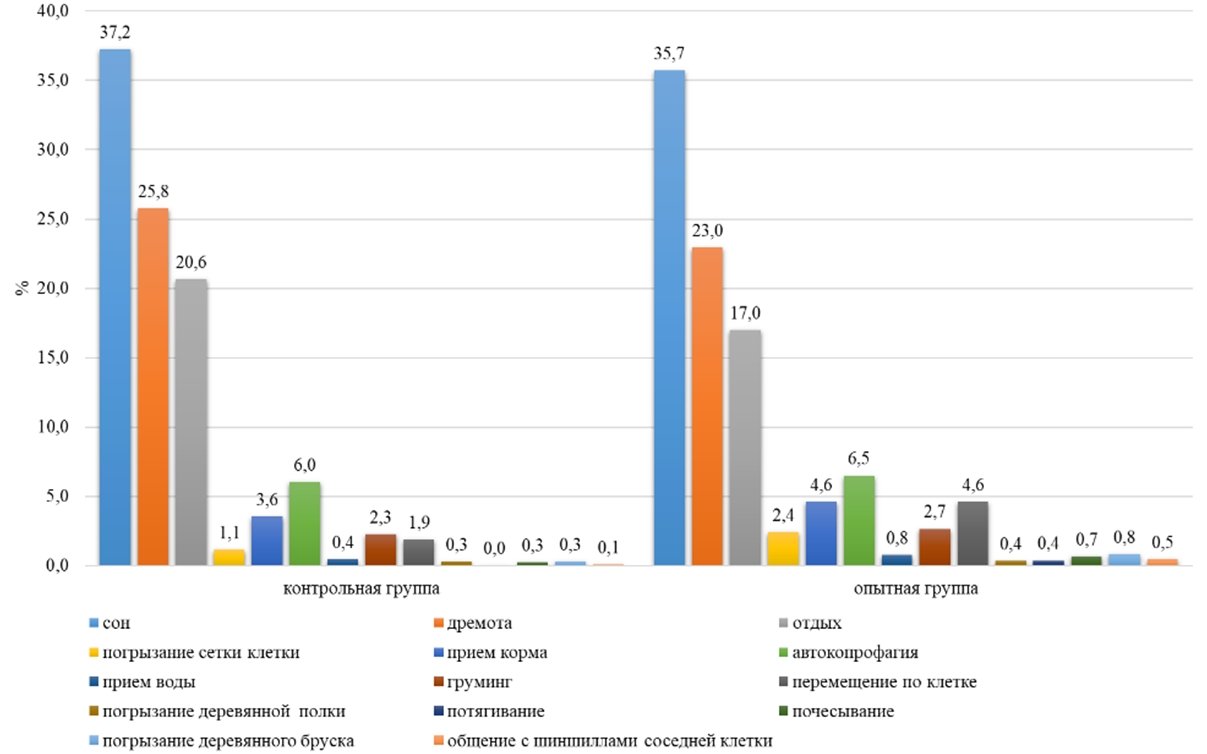
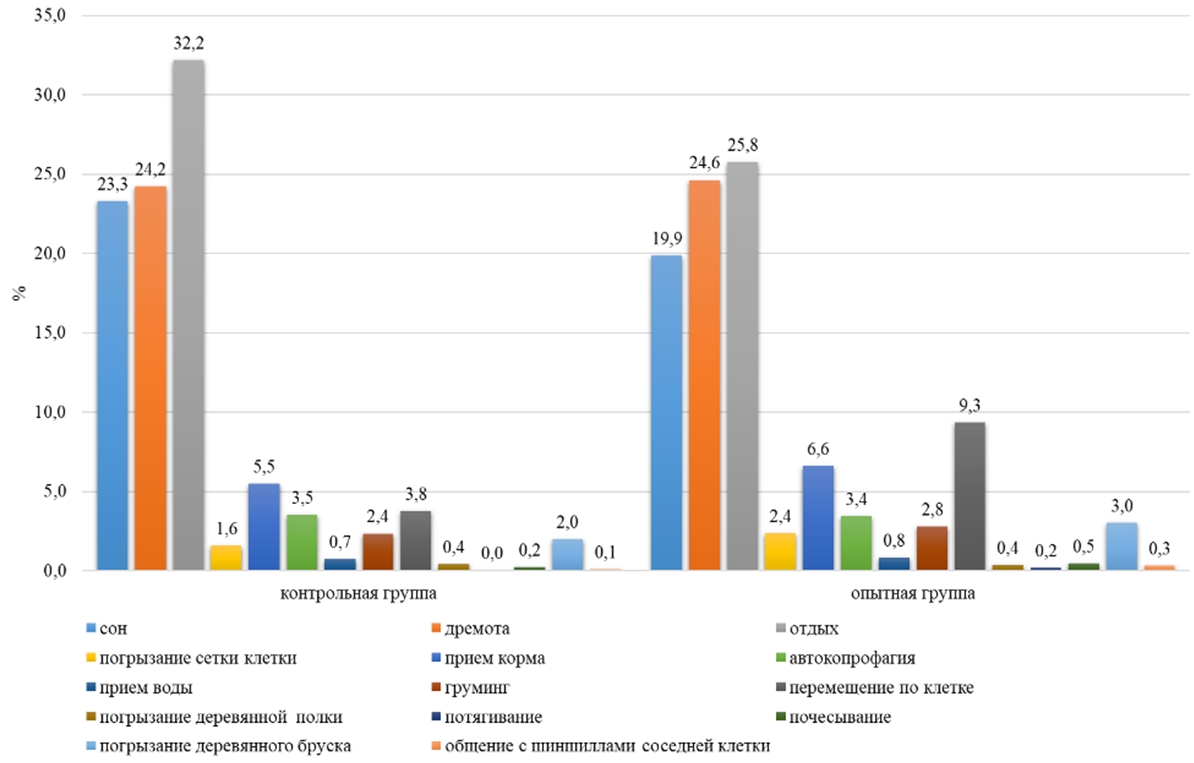
Основные результатыИсследования показали, что включение воды, обогащенной молекулярным водородом с концентрацией водорода 0,1-1,1 ppm в рацион малой длиннохвостой шиншиллы в условиях клеточного содержания, оказало влияние в течение суток на различные формы поведения животных. По неактивным формам поведения, таким как сон, дремота отдых, было выявлено, что самки контрольной группы в ночное время на сон затрачивали в среднем 57 минут времени за один паттерн, а в опытной группе на 40% меньше (23 минуты за один паттерн) (см. таблицу 1) У самок опытной группы по продолжительности сна пик был зафиксирован в 13 часов и составил 41 минуту, а в контрольной группе у самок максимальная продолжительность сна приходилась на 16 часов (40 минут). На сон самки контрольной группы затрачивали 6 часов суточного времени, а в опытной группе на 16% меньше (см. таблицу 1). На дремоту в обеих группах животные в дневное и ночное время суток затрачивали в среднем по 159 минут (см. таблицу1). В суточной динамике пик этого показателя в обеих группах приходился на ночное время (20:00) и составил у самок в контрольной и опытной группе по 43 минуты. В суточном балансе на дремоту в обеих группах у самок приходилось 24% суточного времени (см. рисунок 5). Самки контрольной группы в течении суток затрачивали на отдых 8 часов, а в опытной группе – на 21% меньше (см. таблицу 1).
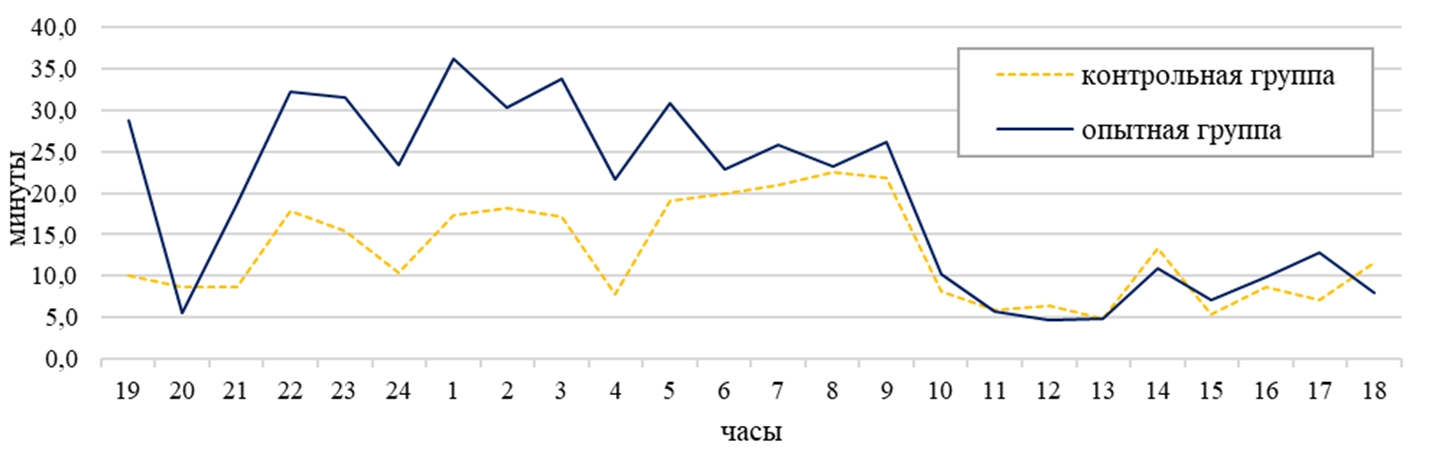
По активным формам поведения (прием корма, автокопрофагия, груминг, прием воды, перемещение по клетке, погрызание деревянного бруска, погрызание сетки клетки, погрызание деревянной полки, прием болюса, потягивание, почесывание, общение с шиншиллами соседней клетки) у самок контрольной группы приходилось 20%, а в опытной группе 30% суточного времени (см. рисунок 5). У самок на активное поведение расходовалось в контрольной группе 298 минут суточного времени, а в опытной на 33% больше (р˂0,05) (см. таблицу 1). В суточной динамике период активности животных в обеих группах наблюдался с 22:00 до 09:00, в контрольной группе 17 минут за один паттерн, а в опытной – 28 минут за один паттерн. Пик активности у опытной группы был зафиксирован в 01:00 и составил 36 минут, а в контрольной группе максимальное значение было выявлено в 08:00 (23 минут) (см. рисунок 1).
По перемещению по клетке в дневное время самки опытной группы затратили на 59% больше времени, чем самки контрольной группы (14 минут). Днем самки в контрольной группе перемещались по клетке 13 минут от дневного времени, а в опытной на 61% больше (см. таблицу 1). В ночное время суток наблюдалось повышение активности по данному показателю в обеих группах на 67% (см. таблицу 1). Самки опытной группы на 60% были активнее самок контрольной группы в ночное время (см. таблица 1). В суточной динамике период активности животных опытной группы приходился с 21:00 до 08:00 (в среднем 12 минут), а у контрольной с 21:00 до 09:00 (в среднем 3 минуты). В суточной динамике поведения самок контрольной группы по этому показателю пик активности был зафиксирован в 02:00 и составил 6 минут, а в опытной группе максимальное значение было выявлено в 22 часа (18 минут) (см. рисунок 2). Самки опытной группы в суточном балансе по форме поведения «перемещение по клетке» затрачивали на 5% времени больше, чем в контрольной группе (см. рисунок 5).
Таблица 1 – Мониторинг поведения самок в течении суток
| формы поведения | группа | |||||
| контрольная | опытная | |||||
| время суток | ||||||
| дневное, мин. | ночное, мин. | сутки, мин. | дневное, мин. | ночное, мин. | сутки, мин. | |
| сон | 267±33,7 | 66±24,5 | 334±50,5 | 253±15,1 | 29±10,1 | 282±14,4 |
| дремота | 185±14,7 | 161±26,9 | 347±35,2 | 163±41,3 | 187±39,2 | 350±46,1 |
| отдых | 148±37,6 | 316±42,8 | 461±76,8 | 121±20,4 | 247±18,4 | 366±19,0 |
| общее неактивное поведение | 600±16,2 | 543±21,7 | 1142±26,8* | 536±32,5 | 463±32,8 | 997±21,2* |
| погрызание сетки клетки | 8±2,8 | 14±2,0 | 22±4,5 | 17±4,9 | 16±4,9 | 34±7,2 |
| прием корма | 25±4,1 | 53±6,7 | 79±9,4 | 32±4,3 | 61±2,9 | 94±3,3 |
| прием болюса | 43±10,3 | 7±3,8 | 51±10,0 | 46±9,2 | 2±1,1 | 49±10,1 |
| прием воды | 3±1,1 | 7±0,7 | 11±1,5 | 6±3,3 | 6±0,5 | 12±3,2 |
| груминг | 16±3,7 | 17±3,0 | 34±2,3 | 19±5,1 | 20±2,4 | 39±7,1 |
| перемещение по клетке | 13±2,4 | 40±12,3 | 54±13,9 | 33±10,1 | 100±31,5 | 133±40,2 |
| погрызание деревянной полки | 2±1,4 | 4±3,2 | 6±3,4 | 3±2,4 | 2±2,1 | 5±2,7 |
| потягивание | 0,3±0,13 | 0,2±0,08 | 0,7±0,21 | 2,7±2,24 | 0,2±0,09 | 3,0±2,2 |
| почесывание | 1,9±0,37 | 1,3±0,14 | 3,4±0,29 | 4,8±2,67 | 1,5±0,32 | 6,4 ±2,61 |
| погрызание деревянного бруска | 2,1±2,03 | 27±17,2 | 29±18,8 | 6±2,6 | 37±13,9 | 43±14,3 |
| общение с шиншиллами соседней клетки | 0,7±0,28 | 0,3±0,26 | 1,1 ± 0,43 | 3,2±2,11 | 1,0±0,92 | 4,4±2,2 |
| общее активное поведение | 119±16,2 | 177±21,7 | 298±26,7* | 184±32,5 | 257±32,8 | 442±21,2* |
По пищевому поведению, которое включало такие формы, как прием корма, прием воды и автокопрофагию, обнаружено, что на протяжении всего времени животные периодически проявляли данный тип активности. При потреблении корма самками опытной группы максимальное значение было зафиксировано в 05:00 (9 минут), а в контрольной группе – 06:00 (7 минут). В дневное время самки контрольной группы на потребление корма затрачивали в среднем по 25 минут, а в опытной на 22% больше времени (см. таблицу 1). В ночное время самки контрольной группы проявляли данный вид пищевой активности в течение 53 минут, а в опытной на 15 % больше времени. В течение суток шиншиллы в опытной группе на прием корма затрачивали 94 минуты, а в контрольной группе на 16% меньше (см. таблицу 1).
По форме поведения «прием воды» пищевая активность у шиншилл наблюдалась на протяжении всего суточного времени. По потреблению воды самки наибольшую активность проявили в 06:00, продолжительность в опытной группе составила 1 минуту, а в контрольной – 2 минуты. В суточном балансе Chinchilla lanigera на прием воды затрачивала 0,7-0,8% времени (см. рисунок 5).
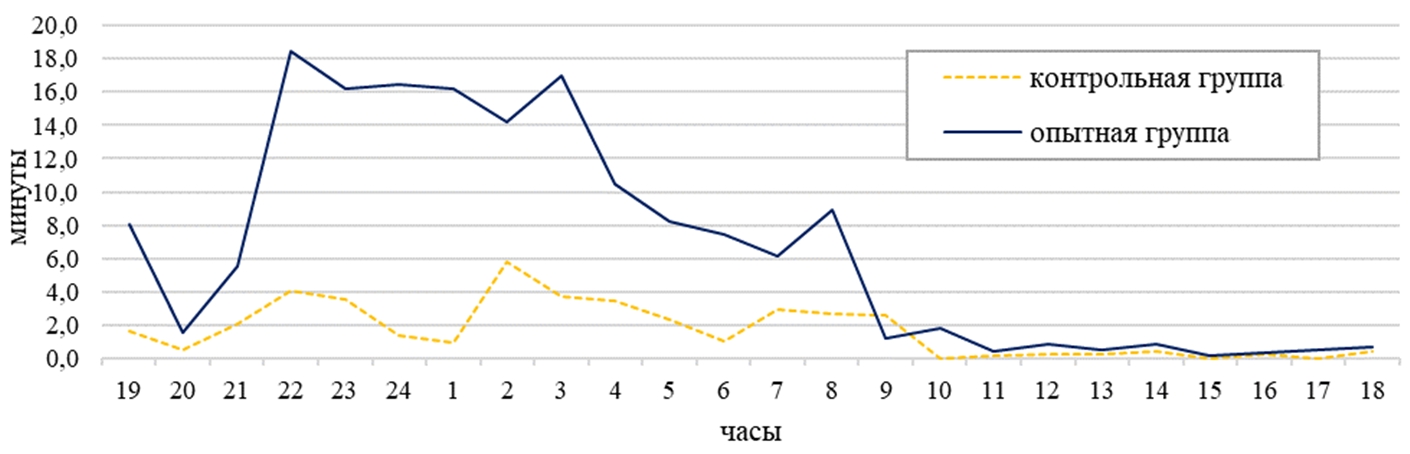
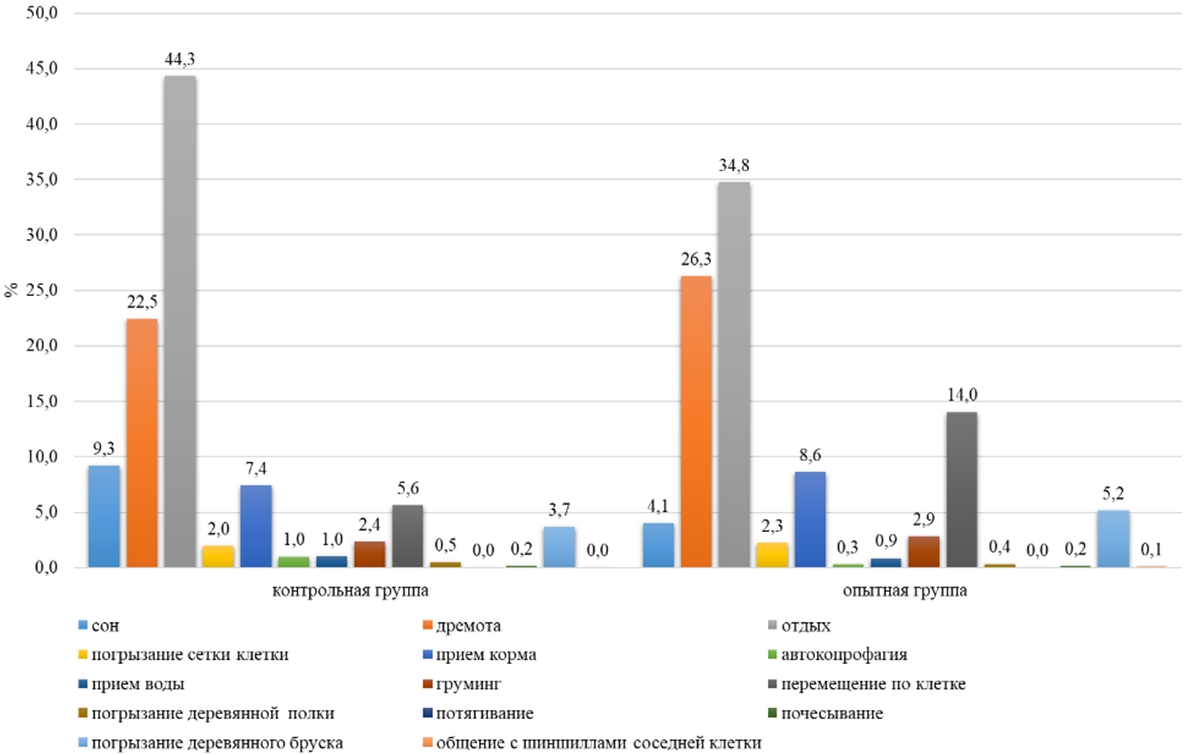
У самок пищевая активность по автокопрофагии проявлялась с 07:00 до 19:00, при этом пик активности наблюдался в контрольной группе в 08:00 и составлял 8 минут за один паттерн, а в опытной группе – в 09:00 (15 минут). В дневное время животные на потребление болюса в среднем расходовали 6% времени (см. рисунок 3). В ночное время Chinchilla lanigera в среднем на потребление болюса затрачивали 0,3% - 1% (см. рисунок 4). В суточном балансе Chinchilla lanigera на прием болюса в обеих группах затрачивала 3% времени (см. рисунок 5).
По форме поведения «погрызание деревянного бруска» наблюдалось, что в контрольной группе самки затрачивали по 2% суточного времени, в опытной группе – 3% (см. рисунок 5). В контрольной группе на погрызание деревянного бруска в ночное время в среднем самки затрачивали на 92% времени больше, чем в дневное время (см. таблицу 1). В опытной группе самки расходовали в дневное время при погрызании деревянного бруска на 84 % меньше времени, чем в ночное время (см. таблицу 1). У самок в суточной динамике поведения пик активности приходился в контрольной группе на 01:00 и составил по продолжительности 11 минут за один паттерн, а в опытной группе – на 02:00 (10 минут).
По форме поведения «погрызание деревянной полки» выявили, что животные обеих групп затрачивали в среднем по 5 минут суточного времени (см. таблицу 1). В суточной динамике поведения по данному показателю пик активности наблюдался в обеих группах в 07:00 и составил по продолжительности 2 минуты.
На форму поведения «груминг» самки контрольной группы расходовали 2% суточного времени, а в опытной группе – 3% (см. рисунок 5). У самок в дневное и ночное время в контрольной группе активность составила 16-17 минут, а в опытной группе – на 13% больше (см. таблицу 1). В суточной динамике поведения шиншилл груминг наблюдался на протяжении всего времени. Самки контрольной группы максимальную активность по грумингу проявили в 9:00 (3 минуты), а в опытной группе – в 6:00 (3 минуты).
Рис. 1 – Суточная динамика активного поведения самок малой длиннохвостой шиншиллы
Рис. 2 – Суточная динамика самок малой длиннохвостой шиншиллы по форме поведения «перемещение по клетке»
На такие активные формы поведения как потягивание, почесывание, общение с шиншиллами соседней клетки приходилось на обе группы в среднем по 0,3-1% суточного времени (см. рисунок 5) По данным формам поведения существенных различий между группами не обнаружено.
Рис. 3 – Поведение самок малой длиннохвостой шиншиллы в дневное время суток
Рис. 4 – Поведение самок малой длиннохвостой шиншиллы в ночное время суток
Рис. 5 – Поведение самок малой длиннохвостой шиншиллы в течении суток
Заключение
В результате экспериментального исследования нами было обнаружено, что включение воды, обогащенной молекулярным водородом, в рацион малой длиннохвостой шиншиллы увеличивало общую суточную активность у самок опытной группы на 33% (р˂0,05), по сравнению с животными контрольной группы. Наибольшее различие среди активных форм поведения наблюдалось по форме «перемещение по клетке». В дневное и ночное время самки опытной группы затрачивали на перемещение по клетке на 60% больше времени, чем самки контрольной группы. В опытной группе на сон затрачивалось на 16% меньше, а на отдых – на 21% меньше суточного времени, чем в контрольной.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Valladares P. Nuevo registro de Chinchilla chinchilla (Rodentia, Chinchillidae) para la región de Atacama, Chile Implicancias para su estado de conservación / P. Valladares, M. Espinosa, M. Torres et al. // Mastozoologia Neotropical. - 2012. - №19-1. - P. 173-178.
- Panina E. Behavior of Chinchilla lanigera under cage keeping with the introduction of molecular hydrogen into the diet / E. Panina, A. Ivanov, D. Petrov et al. // E3S Web of Conferences. – 2021. - №254, P. 08008.
- Fan L. Controllable synthesis of hydrogen bubbles via aeration method for efficient antioxidant process / L. Fan, H. Chen, J. Liang et al. //Applied Nanoscience. – 2021. - №11. – P. 833–840.
- Jafta N. The Production and Role of Hydrogen-Rich Water in Medical Applications / N. Jafta, S. Magagula, K. Lebelo, et al. // Applied Water Science. – 2021. - №1.
- Hancock J.T. Molecular Hydrogen: Redox Reactions and Possible Biological Interactions / J.T. Hancock, T.W. LeBaron, G. Russell // Reactive Oxygen Species. - 2021. - №11. – Р. 17-25.
- Fu J. Hydrogen molecules (H2) improve perfusion recovery via antioxidant effects in experimental peripheral arterial disease / J. Fu, J. Zou, C. Chen et al. // Molecular Medicine Reports. - 2018. - №18-6. – Р. 5009-5015.
- Sato T. 1.2% Hydrogen gas inhalation protects the endothelial glycocalyx during hemorrhagic shock: a prospective laboratory study in rats / T. Sato, S. Mimuro, T. Katoh et al. // J. Anesthesia. - 2020. - №34. - P. 268–275.
- LeBaron T.W. Acute Supplementation with Molecular Hydrogen Benefits Submaximal Exercise Indices. Randomized, Double-Blinded, Placebo-Controlled Crossover Pilot Study / T.W. LeBaron, A.J. Larson, S. Ohta et al. // J. Lifestyle Med. - 2019. - №91. - P. 36-43.
- Hirayama M. Inhalation of hydrogen gas elevates urinary 8-hydroxy-20 - deoxyguanine in Parkinson’s disease / M. Hirayama, M. Ito, T. Minato et al. // Med. Gas Res. - 2018. - №8-4. - P. 144-149.
- Tamasawa A. Hydrogen gas production is associated with reduced interleukin-1β mRNA in peripheral blood after a single dose of acarbose in Japanese type 2 diabetic patients / A. Tamasawa, K. Mochizuki, N. Hariya et al. // Eur. J. Pharmacol. - 2015. -№762. - P. 96-101.