ВЛИЯНИЕ ПИЩЕВОЙ ДЕПРИВАЦИИ В ПЕРИОД ОРГАНОГЕНЕЗА ПРЕНАТАЛЬНОГО РАЗВИТИЯ НА ОБМЕН ГАМК В СТРУКТУРАХ ЦНС У ТРЕХМЕСЯЧНЫХ КРЫС В ПОСТНАТАЛЬНОМ ОНТОГЕНЕЗА
Ибрагимова К.И.
Аспирант,
Азербайджанский Государственный Педагогический Университет в г. Баку
ВЛИЯНИЕ ПИЩЕВОЙ ДЕПРИВАЦИИ В ПЕРИОД ОРГАНОГЕНЕЗА ПРЕНАТАЛЬНОГО РАЗВИТИЯ НА ОБМЕН ГАМК В СТРУКТУРАХ ЦНС У ТРЕХМЕСЯЧНЫХ КРЫС В ПОСТНАТАЛЬНОМ ОНТОГЕНЕЗА
Аннотация
Целью данной работы было изучение обмена ГАМК (содержание ГАМК, Глу и Асп, активность ГДК и ГАМК-Т) в митохондриальных фракциях различных структур головного мозга у потомства крыс, перенесших пищевую депривацию в период органогенеза.
После пищевой депривации матери в период органогенеза происходит значительное изменение обмена ГАМК в митохондриях коры больших полушарий мозга, мозжечка, ствола мозга и гипоталамуса у 3-месячных крыс. Голодание в период органогенеза как специфический и неспецифический фактор влияет на обмен ГАМК в митохондриях структур ЦНС мозга у 3-месячных крыс.
Ключевые слова: гамма-аминомасляная кислота, глутаминовая кислота, аспарагиновая кислота, глутаматдекарбоксилаза, ГАМК-трансаминаза, пищевая депривация, голодания.
Ibragimova K.I.
Postgraduate student,
Azerbaijan State Pedagogical University in Baku
INFLUENCE OF FOOD DEPRIVATION IN ORGANOGENESIS PERIOD OF PRENATAL DEVELOPMENT FOR EXCHANGE OF GABA IN CNS STRUCTURES OF THREE MONTH RATS IN POSTNATAL ONTOGENESIS
Abstract
The aim of this work was to study the exchange of GABA (GABA, Glu and Asp content, GAD and GABA-T activity) in mitochondrial fractions of various brain structures in offspring of rats who underwent food deprivation during organogenesis. After food deprivation of mother during organogenesis there is a significant change in GABA metabolism in mitochondria of cortex, cerebral hemispheres, cerebellum, brainstem and hypothalamus in 3-month-old rats. Starvation during organogenesis as a specific and nonspecific factor affects the exchange of GABA in the mitochondria of CNS brain structures in 3-month-old rats.
Keywords: gamma-aminobutyric acid, glutamic acid, aspartic acid, glutamate decarboxylase, GABA transaminase, food deprivation, starvation.
Энергообеспечение лежит в основе адаптивных процессов организма для поддержания оптимального функционирования его систем в экстремальных условиях.
Согласно данным литературы, при голодании – особом процессе адаптации организма к эндогенному питанию – происходит выраженные изменения в активности различных ферментов [1], [2]. Установлено, что в различные сроки голодания в организме взрослых животных существенные изменения претерпевают медиаторные системы, особенно активность ферментов, участвующих в обмене ацетилхолина, норадреналина, адреналина, дофамина, серотонина, глутаминовой, аспарагиновой и гамма-аминомасляной кислот (Глу, Асп, ГАМК) [3], [4], [5].
Содержание свободных Глу, Асп и ГАМК, а также активность глутаматдекарбоксилазы (ГДК) и ГАМК-трансаминазы (ГАМК-Т) на тканевом и субклеточном уровнях в лимбической коре, гиппокампе, амигдале и ретикулярной формации среднего мозга в различные сроки голодания у трехмесячных и годовалых собак подвергается более глубоким изменениям, особенно после 20-суточного голодания [6].
Согласно учению П.Г.Светлова, пренатальный период развития разделяется на «критические периоды». В различные периоды пренатального развития происходит детерминация и дифференцировка клеток, что определяет восприимчивость к воздействующим факторам и уровень репаративных возможностей. После воздействия неблагоприятных факторов в предимплантационный период отмечается высокий уровень гибели зародышей, а в постимплантационный период часто наблюдаются нарушения нормального развития [7].
Показано, что воздействие стрессорных факторов в пренатальном периоде развития приводит к дезорганизации генетически детерминированной миграции клеток, при этом отмечается различная чувствительность разных участков герминальной зоны в различные критические периоды внутриутробного развития. Выявлено нарушение четкой организации слоев коры, нарушение пропорции нейронов и глии в слоях [8].
Голодание во внутриутробном периоде может способствовать развитию отдаленных метаболических нарушений [9].
Исходя из вышесказанного, целью данной работы было изучение обмена ГАМК в митохондриях структур головного мозга у потомства крыс, перенесших пищевую депривацию в период органогенеза.
Материалы и методы
Все эксперименты выполнены с соблюдением принципов международной декларации Европейского сообщества (86/609/ЕЕС) о защите животных, используемых для экспериментальных и других научных целей.
Эксперименты были проведены на белых крысах линии Вистар. Для опытов брали 16 особей самок крыс в возрасте шести месяцев. В течение всего периода эксперимента крыс содержали в стандартных условиях вивария.
Экспериментальные крысы были разделены на следующие группы:
а) контрольная группа - в качестве контроля использовали потомство интактных самок, которых выращивали в виварии при обычном питании,
б) опытная группа - самок крыс подвергали влиянию пищевой депривации на 9-15 дни беременности (соответствует периоду органогенеза) при свободном доступе к воде. Первый день беременности определяли согласно соответствующей методике [10].
Полученное потомство контрольных и опытных крыс использовалось в опытах в возрасте 3 месяца (период половозрелости) (всего 60 особей). Животных забивали путем мгновенной декапитации. Головной мозг крысы извлекали в течение 3-4 минут и помещали на лед. Структуры головного мозга - кора больших полушарий головного мозга, мозжечок, ствол мозга и гипоталамус идентифицировали по атласам мозга крысы [11].
После обработки ткани мозга (кора больших полушарий головного мозга, мозжечок, ствол мозга и гипоталамус) [12], [13] содержание аминокислот определяли методом электрофореза на бумаге [14] у интактных и опытных 3-месячных крыс. Об активности ферментов ГДК [15] и ГАМК-Т [16] в митохондриальных фракциях судили по увеличению ГАМК и Глу во время инкубирования с Глу (вместе с α-кетоглутаратом) и с ГАМК соответственно в течение 30 минут при температуре 370С в атмосфере азота и выражали в мкмоль глутамата и ГАМК, образовавшихся в грамме свежей ткани за час инкубирования (мкмоль/г.ч).
Исходную митохондриальную фракцию из отделов мозга выделяли по методу Сомогьи и Фонью [17].
Обработка полученных данных проводилась в программе Origin Pro 7.0. Статистическую обработку данных проводили с использованием пакета анализа программы Excel-2007. Данные представлены в виде средней арифметической величины (M) ± стандартная ошибка средней (m). Оценка значимости различий данных между контрольными и опытными группами проводилась с использованием t критерия Стьюдента при соответствии сравниваемых выборок закону нормального распределения. При значениях p<0,05 различия считались достоверными.
Результаты и обсуждение
Результаты проведенных опытов показали, что у 3-месячных крыс после пищевой депривации матери в период органогенеза содержание ГАМК в митохондриальных фракциях коры больших полушарий, мозжечка, ствола мозга и гипоталамуса увеличивается на 18% (p<0,05), 24% (p<0,01), 22% (p<0,01), 29% (p<0,01), по сравнение с контролем (рис. 1).
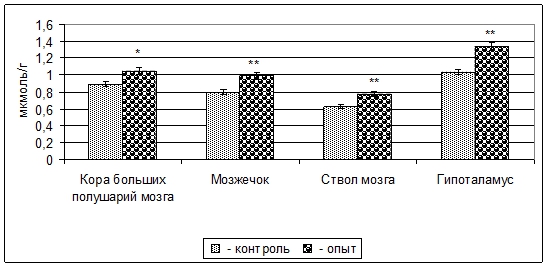
Рис. 1 – Изменение содержания ГАМК в митохондриальных фракциях структур головного мозга 3-месячных крыс при пренатальной (в период органогенеза) пищевой депривации (M±m, n=5)
Примечание: * - p<0,05; ** - p<0,01.Содержание свободной Глу в митохондриальных фракциях избранных структур ЦНС после внутриутробной пищевой депривации, в отличие от содержания ГАМК, уменьшается: в коре больших полушарий – 13% (p>0,05), мозжечке - 9% (p>0,05), стволе мозга - 17% (p<0,01), гипоталамусе - 23% (p<0,01) (рис. 2).
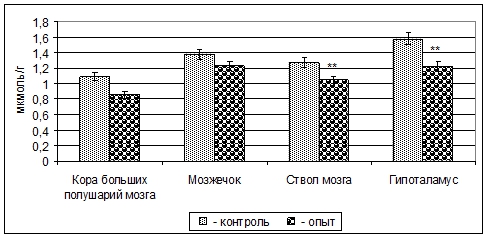
Рис. 2 – Изменение содержания Глу в митохондриальных фракциях структур головного мозга 3-месячных крыс при пренатальной (в период органогенеза) пищевой депривации (M±m, n=5)
Примечание: ** - p<0,01.При этом содержание Асп у 3-месячных крыс в митохондриальных фракциях коры больших полушарий уменьшается на 12% (p>0,05), мозжечка - 10% (p>0,05), ствола мозга - 15% (p<0,05) и гипоталамуса - 26% (p<0,001) (рис. 3).
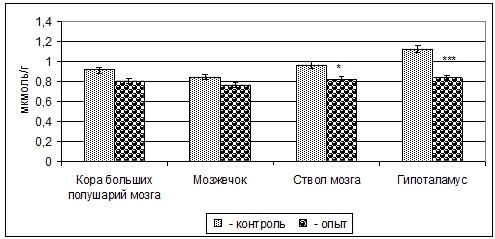
Рис. 3 – Изменение содержания Асп в митохондриальных фракциях структур головного мозга 3-месячных крыс при пренатальной (в период органогенеза) пищевой депривации (M±m, n=5)
Примечание: * - p<0,05; *** - p<0,001.Как видно из полученных данных, увеличение содержания ГАМК происходит за счет повышения ГДК и понижения ГАМК-Т в различных структурах головного мозга 3-месячных крыс в указанных условиях (таб.). Мы можем отметить, что влияние голодания на гипоталамические аминергические системы в целом выражено сильнее.
Таблица 2 – Изменение активности ГДК и ГАМК-Т в митохондриальных фракциях структур головного мозга 3-месячных крыс при пренатальной (в период органогенеза) пищевой депривации (M±m, n=5)
| Области мозга | Группы | ГДК (мкмоль ГАМК/г.час) | ГАМК-Т (мкмоль Глу/г.час) |
| Кора больших полушарий мозга | Контроль | 19,83±0,88 | 25,12±1,05 |
| Опыт | 22,23±1,00 | 22,11±0,96 | |
| % | 112 | 88 | |
| P | >0,05 | >0,05 | |
| Мозжечок | Контроль | 25,17±1,08 | 27,63±1,05 |
| Опыт | 30,51±1,46 | 23,76±1,13 | |
| % | 121 | 86 | |
| P | <0,05 | <0,05 | |
| Ствол мозга | Контроль | 16,11±0,78 | 18,95±0,76 |
| Опыт | 20,68±1,06 | 15,75±0,55 | |
| % | 128 | 83 | |
| P | <0,01 | <0,01 | |
| Гипоталамус | Контроль | 37,87±1,53 | 40,79±1,71 |
| Опыт | 52,70±1,91 | 31,81±1,24 | |
| P | <0,001 | <0,01 | |
| % | 139 | 78 |
Успехи в изучении организации пищевого центра, и в особенности его гипоталамических отделов, привели к предположению о состояниях голода и сытости, а первичные стимулы в этих процессах зависят от наличия в гипоталамусе специализированных рецепторов, чувствительных к концентрации глюкозы в крови [18]. Эти авторы [19] отмечают, что на уровне гипоталамических ядер (паравентрикулярное ядро (PVN), габенулярное ядро HL, вентримедиальное ядро (VM), мамилярное медиальное ядро (MM)) имеются глюкозочувствительные нейроны, под контролем которых находится «уровень потребления глюкозы», тесно связанный с ГАМК, которые оказывают влияние на уровень потребления глюкозы нейронами гипоталамических ядер. Также известно, что около 70% всей глюкозы, поступающей с пищей, утилизируется мозгом, составляющим всего 2-2,5% массы тела [20].
Мы считаем, что на уровне гипоталамуса взаимодействие нервных и гормональных регуляторных механизмов более выражено, может проявлять себя в виде адаптивно-компенсаторных реакций в нейронах на модели нарушения энергетического (при голодании) гомеостаза.
В период беременности организм матери отдает значительную часть пластических и энергетических ресурсов развивающемуся потомству. Дефицит этих ресурсов восполняется за счет повышения потребления пищи [21].
ГАМК участвует во многих метаболических превращениях, из которых наибольшее значение имеют связанные с обменом дикарбоновых аминокислот и глюкозы [22].
Большинство нейромедиаторных систем, в том числе ферментные, рецепторные и транспортные системы, интенсивно развиваются в течение пренатального периода развития мозга. При этом нейротрансмиттеры имеют также другую роль в развитии мозга в дополнение к нейротрансмиссии. На это указывает – появление ГАМК, ГДК и ГАМК-рецепторов еше до начала развития ГАМК-ергических синапсов [23], [24]; связь мускариновых и метаботропных глутаматных рецепторов с фосфолипазой С системы сигнальной трансдукции [25], а также переходные сверхэкспрессии NMDA-рецепторов глутамата или дофамина на определенных стадиях развития [26].
Эффект действия тормозных нейромедиаторов ГАМК и глицина инвертируется в течение эмбриогенеза, т.е. в развивающемся мозге основные тормозящие аминокислоты являются возбуждающими, т.е. деполяризующими, только после рождения становятся ингибирующими, что связано с переходом от высокого к низкому содержанию Cl- в нервных клетках. Это имеет важное значение для становления нейронных сетей в раннем онтогенезе. Деполяризующая, т.е. возбуждающая, активность ГАМК в предшественниках нервных клеток контролирует деление клеток, способствует миграции и созреванию нейронов [27].
Пищевая депривация в период органогенеза вызывает нарушение баланса между ГАМК и Глу. ГАМК как одна из стресс-лимитирующей системы [28] активирует адаптацию к пищевой депривации.
В заключение можно заметить, что после пищевой депривации беременных крыс ГАМК как медиатор торможения активно участвует в реализации механизма адаптации и развития компенсаторных процессов в ЦНС.
Список литературы / References
- Markovska-Gosic B. The influence of starvation and water deprivation upon certain serum enzyme activity in chicks in the first week after hatching / B. Markovska-Gosic, A. Dodovski, V. Stojkovski and others // Macedonian veterinary review. – 2009. – Vol. 32. - № 2. - P. 11-22.
- Swaiman K. F. The effect of food deprivation on enzyme activity in developing brain / K. F. Swaiman, N. D. Jeanne, R. N. Wolfe J. // Neurochem. – 1970. – Vol. 17. - № 9. - P. 1387-1391.
- Amer A. 5-Hydroxy-l-tryptophan suppresses food intake in food deprived and stressed rat / A. Amer, J. Breu, J. McDermitt and others // Pharmacology, biochemistry and behavior, - 2004. – Vol. 77. - P. 137-143.
- Ko K. I. Starvation promotes concerted modulation of appetitive olfactory behavior via parallel neuromodulatory circuits / I. K. Ko, C. M. Root, Lindsay S. A. and others // eLife 2015. – № – e088298. -17 P. doi: 10.7554/eLife.08298
- Kristophe J. K. Effect of food deprivation and hormones of glucose homeostasis on the acetyl CoA carboxylase activity in mouse brain: a potential role of acc in the regulation of energy balance / J. K. Kristophe, C. John, K. Karthik and others //Nutrition & Metabolism. – 2006. - 3. - № 15. – 9 P. doi: 10.186/1743-7075-3-15
- Фараджев А. Н. Возрастные особенности обмена дикарбоновых аминокислот и ГАМК в лимбической системе мозга собак постнатальном онтогенезе и в условиях голодания. Автореф. … докт. биол. наук /А. Н. Фараджев - Тбилиси. - 1990 - 47 C.
- Пучков В. Ф. Учение П.Г.Светлова о критических периодах развития и его значение для современной эмбриологии / В. Ф. Пучков // Морфология. - – Т. 105. - № 11. - C. 147-158.
- Кассиль В. Г. Критические периоды развития головного мозга / В. Г. Кассиль, В. А. Отеллин, Л. И. Хожай и др. // Рос. физиол. журн. им. И.М.Сеченова. – 2000. Т. 86. – С. 1418-1425.
- Могучая Е. В. Голодание в начале жизни – возможное влияние на дальнейшее здоровье. Клинический случай / Е. В. Могучая, О. П. Ротарь, А. О. Конради //Артериальная гипертензия. – 2015. – Т.21 - № 6. - C. 639-64
- Западнюк И. П. Лабораторные животные, их разведение, содержание и использование в эксперименте / И.П. Западнюк, В.И. Западнюк, Е.А. Захария - Киев: Медгиз УССР. – 1962.- 350 с.
- Pellegrino L. J. A stereotaxic atlas of the rat brain / L. J. Pellegrino, A. S. Pellegrino, A. J. Cushman // Plenum Press, N.Y. – 1979. – 122 P.
- Robert E. Gamma-aminobutyric acid in brain: its formation from glutamic acid / Robert, S. Frankel // J.Biol. Chem. – 1950. – Vol. 187. - №1. - P. 55-63.
- Shatunova N. F. On the intracellular localization of glutamate decarboxylase and gamma-amonibutyric acid in mammalian brain / N. F. Shatunova, I. A. Sytinsky // J. Neurochem. - 1964. – Vol. 11. - P. 701-708.
- Doze K. Dir anvendug der hochspanmumgspherographie dei der guantitativen totalanoiyse von protein hydrolysaten / K. Doze // Mittelling Biochem. Z. – 1957. – Vol. 329. - № 2. - P. 390-398.
- Sytinsky I. A. Effect of certain drugs on gamma-aminobutyric acid system on central nervous system / I. A. Sytinsky, T. N. Priyatkina // Biochem. Pharmacol. – 1966. – Vol. 115. - № 1 - P. 49-57.
- Нилова Н. С. Аммиак и ГАМК-трансаминазная активность ткани головного мозга / Н. С. Нилова // Докл. АН СССР. – 1966. - Т. 2. - С. 483-486.
- Somogyi J. Preparation of brain mitochondria / J. Somogyi, A. Fonjo, I. Vincze // Acta Physiol. Acad. Sci. Hung. – 1962. Vol. 21. - 295-300.
- Leibowitz S. F. Hypothalamic control of energy balance: different peptides, different functions / S. F. Leibowitz, K. E. Wortley // Peptides. – 2004. – Vol. 25. - № 3 - P. 473-504.
- Vong L. Leptin action on GABAergic neurons prevents obesity and reduces inhibitory tone to POMC neurons / L. Vong, C. Ye, Z. Yang and others //Neuron. – Vol. 1. - № 71. - P. 142-154.
- Eun R. Brain regulation of energy metabolism / R. Eun, K. Min-Seon //Endocrinol Metab. – 2016. – Vol. 31. - P. 519-524.
- Augustine R. A. From feeding one to feeding many: hormone-induced changes in bodyweight homeostasis during pregnancy / R. A. Augustine, S. R. Ladyman, D. R. Grattan // J. Physiol. – – Vol. 586. - № 2 - P. 387-397.
- Tong Q. Synaptic release of GABA by AgRP neurons is required for normal regulation of energy balance / Tong, C. P. Ye, J. E. Jones and others // Nat. Neurosci. – 2008. - № 11. - P. 998-1000.
- Costa L. G. Structural effects and neurofunctional sequelae of developmental exposure to psychotherapeutic drugs: experimental and clinical aspects / L. G. Costa, L. Steardo, V. Cuomo // Pharmacological Reviews. – 2004. – Vol. 56. - № 1. - P. 103-147.
- Kim H. Y. GABA and GABAA receptors: development and regulation, in Receptor Dynamics in Neural Development (shaw CA ed.) CRC Press, / H. Y. Kim, R. W. Olsen, A. J. Tobin // Boca Raton, FL. - 1996. - P. 54-72.
- Balduini W. Regional development of catechol, -glutamate-, norepinephrine- and serotonin-stimulated phosphoinositide metabolism in rat brain / W. Balduini, S. M. Candura, L. G. Costa // Brain Res. Dev. – 1991. – Vol. 62. - № 1. - P. 115-120.
- Retz W. Neurotransmission and the ontogeny of human brain / W. Retz, J. Kornhuber, P. Riederer // J. Neural. Transm. – 1996. – Vol. 103. - № 4. - P. 403-419.
- Salazar P. GABA effects during neuronal differentiation of stem cells / P. Salazar, M. A. Velasco-Velazquez, I. Velasco // Neurochem. Res. – 2008. Vol. 33. – P. 1546-1557.
- Мартюшев-Поклад А. В. Стресс-лимитирующие системы и нейрональная пластичность в патогенезе психических и неврологических расстройств / А. В. Мартюшев-Поклад, Т. А. Воронина // Обзоры по клинической лекарственной терапии. – 2003. Т. 2. - № 4. - C. 15-25.
Список литературы на английском языке / References in English
- Markovska-Gosic B. The influence of starvation and water deprivation upon certain serum enzyme activity in chicks in the first week after hatching / B. Markovska-Gosic, A. Dodovski, V. Stojkovski and others // Macedonian veterinary review. – 2009. – Vol. 32. – No. 2. – P. 11-22.
- Swaiman K. F. The effect of food deprivation on enzyme activity in developing brain / K. F. Swaiman, N. D. Jeanne, R. N. Wolfe J. // Neurochem. – 1970. – Vol. 17. – № 9. – P. 1387-1391.
- Amer A. 5-Hydroxy-l-tryptophan suppresses food intake in food deprived and stressed rat / A. Amer, J. Breu, J. McDermitt and others // Pharmacology, biochemistry and behavior, – 2004. – Vol. 77. – P. 137-143.
- 4/ Ko K.I. Starvation promotes concerted modulation of appetitive olfactory behavior via parallel neuromodulatory circuits / I.K. Ko, C. M. Root, Lindsay S. A. and others // eLife 2015. – No. 4. – e088298. – 17 P. doi: 10.7554/eLife.08298
- Kristophe J. K. Effect of food deprivation and hormones of glucose homeostasis on the acetyl CoA carboxylase activity in mouse brain: a potential role of acc in the regulation of energy balance / J. K. Kristophe, C. John, K. Karthik and others //Nutrition & Metabolism. – 2006. – Vol. 3. – No. 15. – 9 P. doi: 10.186/1743-7075-3-15
- Faradzhev A. N. Vozrastnye osobennosti obmena dikarbonovyh aminokislot i GAMK v limbicheskoj sisteme mozga sobak postnatal'nom ontogeneze i v uslovijah golodanija [Age features of the exchange of dicarboxylic amino acids and GABA in the limbic system of the brain of dogs after postnatal ontogenesis and in conditions of fasting]. Abstract of PhD thesis in Biology / A. N. Faradzhev. – Tbilisi. – 1990 – 47 p. [in Russian].
- Puchkov V. F. Uchenie P.G.Svetlova o kriticheskih periodah razvitija i ego znachenie dlja sovremennoj jembriologii [Teaching of P.G. Svetlova on Critical Periods of Development and Its Significance for Modern Embryology] / V. F. Puchkov // Morphology. – 1993. – V. 105. – No. 11. – P. 147-158. [in Russian]
- Kassil' V. G. Kriticheskie periody razvitija golovnogo mozga [Critical Periods of Brain Development] / V. G. Kassil', V. A. Otellin, L. I. Hozhaj et al. // Ros. fiziol. zhurn. im. I.M.Sechenova [Russian Physiological Journal named after I.M. Sechenov]. – 2000. V. 86. – P. 1418-1425. [in Russian]
- Moguchaja E. V. Golodanie v nachale zhizni – vozmozhnoe vlijanie na dal'nejshee zdorov'e. Klinicheskij sluchaj [Fasting at Beginning of Life – Possible Influence on Further Health. Clinical Case] / E.V. Moguchaja, O.P. Rotar', A. O. Konradi // Arterial'naja gipertenzija [Arterial hypertension]. – 2015. – V. 21 – No. 6. – P. 639-645. [in Russian]
- Zapadnjuk I. P. Laboratornye zhivotnye, ih razvedenie, soderzhanie i ispol'zovanie v jeksperimente [Laboratory Animals, Their Breeding, Content and Use in Experiment] / I.P. Zapadnjuk, V.I. Zapadnjuk, E.A. Zaharija – Kiev: Medgiz USSR. – 1962. – 350 p. [in Russian]
- Pellegrino L. J. A stereotaxic atlas of the rat brain / L. J. Pellegrino, A. S. Pellegrino, A. J. Cushman // Plenum Press, N.Y. – 1979. – 122 P.
- Robert E. Gamma-aminobutyric acid in brain: its formation from glutamic acid / E. Robert, S. Frankel // J.Biol. Chem. – 1950. – Vol. 187. – No.1. – P. 55-63.
- Shatunova N. F. On the intracellular localization of glutamate decarboxylase and gamma-amonibutyric acid in mammalian brain / N. F. Shatunova, I. A. Sytinsky // J. Neurochem. – 1964. – Vol. 11. – P. 701-708.
- Doze K. Dir anvendug der hochspanmumgspherographie dei der guantitativen totalanoiyse von protein hydrolysaten / K. Doze // Mittelling Biochem. Z. – 1957. – Vol. 329. – No. 2. – P. 390-398.
- Sytinsky I. A. Effect of certain drugs on gamma-aminobutyric acid system on central nervous system / I. A. Sytinsky, T. N. Priyatkina // Biochem. Pharmacol. – 1966. – Vol. 115. – No. 1 – P. 49-57.
- Nilova N. S. Ammiak i GAMK-transaminaznaja aktivnost' tkani golovnogo mozga [Ammonia and GABA transaminase activity of brain tissue] / N. S. Nilova // Reports of the Academy of Sciences of the USSR. – 1966. – V. 2. – P. 483-486. [in Russian]
- Somogyi J. Preparation of brain mitochondria / J. Somogyi, A. Fonjo, I. Vincze // Acta Physiol. Acad. Sci. Hung. – 1962. Vol. 21. – P. 295-300.
- Leibowitz S. F.Hypothalamic control of energy balance: different peptides, different functions / S. F. Leibowitz, K. E. Wortley // Peptides. – 2004. – Vol. 25. – No. 3 – P. 473-504.
- Vong L. Leptin action on GABAergic neurons prevents obesity and reduces inhibitory tone to POMC neurons / L. Vong, C. Ye, Z. Yang and others // Neuron. – Vol. 1. – No. 71. – P. 142-154.
- Eun R. Brain regulation of energy metabolism / R. Eun, K. Min-Seon // Endocrinol Metab. – 2016. – Vol. 31. – P. 519-524.
- Augustine R. A. From feeding one to feeding many: hormone-induced changes in bodyweight homeostasis during pregnancy / R. A. Augustine, S. R. Ladyman, D. R. Grattan // J. Physiol. – – Vol. 586. – No. 2 – P. 387-397.
- Tong Q. Synaptic release of GABA by AgRP neurons is required for normal regulation of energy balance /Q. Tong, C. P. Ye, J. E. Jones and others // Nat. Neurosci. – 2008. – No. 11. – P. 998-1000.
- Costa L. G. Structural effects and neurofunctional sequelae of developmental exposure to psychotherapeutic drugs: experimental and clinical aspects / L. G. Costa, L. Steardo, V. Cuomo // Pharmacological Reviews. – 2004. – Vol. 56. – No. 1. – P. 103-147.
- Kim H. Y. GABA and GABAA receptors: development and regulation, in Receptor Dynamics in Neural Development (shaw CA ed.) CRC Press, / H. Y. Kim, R. W. Olsen, A. J. Tobin // Boca Raton, FL. – 1996. – P. 54-72.
- Balduini W. Regional development of catechol, -glutamate-, norepinephrine- and serotonin-stimulated phosphoinositide metabolism in rat brain / W. Balduini, S. M. Candura, L. G. Costa // Brain Res. Dev. – 1991. – Vol. 62. – No. 1. – P. 115-120.
- Retz W. Neurotransmission and the ontogeny of human brain / W. Retz, J. Kornhuber, P. Riederer // J. Neural. Transm. – 1996. – Vol. 103. – No. 4. – P. 403-419.
- Salazar P. GABA effects during neuronal differentiation of stem cells / P. Salazar, M. A. Velasco-Velazquez, I. Velasco // Neurochem. Res. – 2008. Vol. 33. – P. 1546-1557.
- Martjushev-Poklad A.V. Stress-limitirujushhie sistemy i nejronal'naja plastichnost' v patogeneze psihicheskih i nevrologicheskih rasstrojstv [Stress-limiting systems and neuronal plasticity in the pathogenesis of mental and neurological disorders] / A. V. Martjushev-Poklad, T. A. Voronina // Reviews of clinical drug therapy. – 2003. - Vol. 2. – No. 4. – P. 15-25. [in Russian]
