СВОЙСТВА ЧАСТИЧНО ОЧИЩЕННОЙ ВНЕКЛЕТОЧНОЙ КИСЛОЙ ПРОТЕАЗЫ, ПОЛУЧЕННОЙ ИЗ PENICILLIUM NOTATUM BDU-M5
СВОЙСТВА ЧАСТИЧНО ОЧИЩЕННОЙ ВНЕКЛЕТОЧНОЙ КИСЛОЙ ПРОТЕАЗЫ, ПОЛУЧЕННОЙ ИЗ PENICILLIUMNOTATUMBDU-M5
Научная статья
Сафарова А.Х.1, Ганбаров Х.Г.2, *
2 ORСID: 0000-0002-6847-3598;
1 Университет Одлар Юрду, Баку, Азербайджан;
2 Бакинский Государственный Университет, Баку, Азербайджан
* Корреспондирующий автор (khuda1949[at]mail.ru)
АннотацияРабота посвящена изучению свойства внеклеточной кислой протеазы, полученной из гриба PenicilliumnotatumBDU-M5. Показано, что лучшим осадителем внеклеточной кислой протеазы из культуральной жидкости гриба Р. notatumBDU-M5 был (NH4) 2SO4.Высокая активность фермента наблюдалась в диапазоне температур 45-60°С, а оптимальная температура – при 55°С. Фермент проявлял устойчивость при 40-70°С в течение 1 часа, однако высокая термоустойчивость проявлялась при 40-50°С.
Высокая активность кислой протеазы гриба наблюдалась в диапазоне кислотности рН 3.5-5.5, а оптимальная активность фермента проявилась при рН 4.5. Фермент оказался кислотоустойчивым при рН 3.5-5.5 в течение 3-х часов.
Ключевые слова: Penicilliumnotatum, кислая протеаза, температурный и рН оптимумы, термоустойчивость и кислотоустойчивость.
PROPERTIES OF PARTIALLY PURIFIED EXTRACELLULAR ACID PROTEASE DERIVED FROM PENICILLIUM NOTATUM BDU-M5
Research article
Safarova A.Kh.1, Ganbarov Kh.G.2, *
2 ORCID: 0000-0002-6847-3598;
1 Odlar Yurdu University, Baku, Azerbaijan;
2 Baku State University, Baku, Azerbaijan
* Corresponding author (khuda1949[at]mail.ru)
AbstractThe current study deals with the properties of extracellular acid protease derived from the fungus Penicillium notatum BDU-M5. It was shown that the best precipitator of extracellular acid protease from the culture fluid of the fungus P. notatum BDU-M5 was (NH 4) 2 SO 4. High enzyme activity was observed in the temperature range of 45-60 °C, while the optimal temperature was observed at 55 °C. The enzyme showed resistance at 40-70°C for 1 hour; however, high thermal stability was registered at 40-50 °C.
The high activity of the acid protease of the fungus was observed in the pH range of 3.5-5.5, while the optimal activity of the enzyme was registered at pH 4.5. The enzyme was acid-resistant at pH 3.5-5.5 for 3 hours.
Keywords: Penicillium notatum, acid protease, temperature and pH optima, thermal stability and acid resistance
ВведениеФерменты являются биологическими катализаторами, которые осуществляют все биохимические процессы, протекающие в живых организмах. В настоящее время более ста ферментов широко применяются в промышленности. Более половины их получают из грибов, около 30% – из бактерий, 8% из животных и 4% из растений (20).
Микробные протеазы играют важную роль в биотехнологических процессах и медицине. Они составляют около 60% применяемых ферментов. В этих целях протеазы производят из плесневых грибов, дрожжей и бактерий. В биотехнологических процессах важное место занимают грибные кислые протеазы. Они используются в хлебопечении как незаменимое средство для протеолиза глютеина, для получения соевого соуса, белкового гидролизата и приправочного материала [19].
В качестве продуцента кислой протеазы были исследованы следующие виды грибов: Aspergillusclaviatus [24], A. hennebergii [10], A. niger [23], A. oryzae [16], [22], [27], [31], Penicilliumcamemberti [7], P. chrysogenum [12], P. citrinum [30], P. bilaiae [17], P. expansum [25], P. griseoseum [11], P. roqueforti [15], Rhizopuschinensis [8], R. microsporus [21], R. hangchow [13], R. orysae [6], [9], [14], Neosartaryafischeri [29], Phycomycesblakesleeanus [26].
В предыдущих работах нами была исследована протеолитическая активность грибов рода Penicillium и отобран Р. notatumBDU-M5 в качестве активного продуцента [3]. У данной культуры изучено влияние температуры [4], источников углерода и азота на биосинтез кислой протеазы [5].
В данной работе изучены свойства частично очищенной кислой протеазы, полученной из грибной культуры PenicilliumnotatumBDU-M5.
Материалы и методы исследованияДля получения внеклеточной протеазы гриб PenicilliumnotatumBDU-M5 выращивали в жидкой среде следующего состава (%): сахароза – 3, пептон – 0.5; NaCl – 0.2; MgSO4 – 0.5; КН2РО4 – 0.05 и инкубировали при 30С в течении 48 часов. Биомассу отделяли фильтрованием и культуральную жидкость центрифугировали при 10000 об/30 мин и надосадочную жидкость использовали в качестве ферментного раствора. Из ферментного раствора (культуральной жидкости) протеазу осаждали ацетоном, этанолом и (NH4)2SO4. Ферментный раствор смешивали с ацетоном в соотношении 1:3 (v/v), с этанолом в соотношении 1:2 (v/v) и с 90%-ным раствором (NH4)2SO4 в соотношении 1:1 (v/v) при температуре осадителей не более 8°С. Осадок отделяли центрифугированием при 10000 об/30 мин, высушивали при 40-42°С и использовали в качестве ферментного препарата. Препарат растворяли в 0.05 М цитратном буфере (рН 2.5 и 5.5), содержащем 0.1 М NaCl.
Активность протеазы определяли спектрофотометрически по методу Ансона в модификации [1, C. 211]. В качестве субстрата фермента использовали 2% раствор казеината натрия. Ферментный раствор (1 мл) помещали в водяной термостат при 37°С на 10-15 мин. Затем добавляли 1 мл раствора субстрата (1%) перемешивали и инкубировали при 30°С на 1 мин. Реакцию останавливали добавлением ровного объема 10%-ный раствор трихлоруксусной кислоты (ТХУК). Контрольный опыт готовили также, только перед внесением раствора субстракта к реакционной смеси добавляли 10%-ный раствор ТХУК. Растворы фильтровали и в фильтрате спектрофотометрически определяли количество не осажденных ТХУ кислотой продукта реакции (тирозина).
Температурный оптимум определяли при 30-75°С, а рН оптимумы – при рН 2.5-7.5. Термостобильность (термоактивация) фермента определяли при 40, 50, 60 и 70°С. В пробирки вносили определенное количество ферментного раствора и помешали в водяную баню. При достижении соответствующей температуры ферментного раствора брали пробу и определяли начальную активность. Затем через определенное время брали следующие пробы и определяли активность фермента. Пробы брали до тех пор, пока активность едва определялась. В таком же порядке определяли кислотоустойчивость при рН 3.5, 4.5, 5.5 и 6.5.
За единицу активности принимали такое количество фермента, которое за 1 мин при 37°С превращает казеинат натрия в неосаждаемое состояние трихлоруксусной кислотой в количестве (0.181мг), соответствующем 1 мкмоль тирозина и выражали в мкмоль/мин/мг белка (ед/мг белка).
Содержание белка в культуральной жидкости и растворе фермента определяли спектрофотометрически при длине волны 280 нм [28]. Все опыты проводили в 4-х повторностях и статистически обрабатывали [2, C. 451]. Для установления достоверности данных использовали следующую формулу:
Р = м/М≤ 0,05
Р- критерия Стьюдента; м- квадратичное отклонение; М- среднее число повторов.
Результаты и их обсуждениеИз культуральной жидкости гриба PenicilliumnotatumBDU-M5 путем осаждения получали частично очищенную кислую протеазу. Данные представлены в табл.1. Показано, что в культуральной жидкости активность кислой протеазы при рН 5.5 в 1.6 раза была больше активности при рН 2.5. После осаждения с ацетоном активность протеазы при рН 2.5 и 5.5, увеличивалась в 1.63 и 1.70 раза соответственно. При этом активность фермента при рН 5.5 была в 1.7 раза больше активности при рН 2.5. Осаждение раствором (NH4)2SO4 увеличивало активность протеазы при рН 2.5 и рН 5.5 в 2.5 раза. Осаждение этанолом приводило к уменьшению активности фермента в 1.7-1.8 раза, по сравнению с активностью в культурной жидкости.
Таблица 1– Активность кислой протеазы после осаждения из культурной жидкости гриба PenicilliumnotatumBDU-M5
| Кислая Протеаза | Активность фермента ед/мг белка | |||
| до осаждения | после осаждения | |||
| ацетоном | Этанолом | (NH4)2SO4 | ||
| pH 2,5 | 4,8±0,2 | 7,8±0,4 | 2,8±0,1 | 11,8±0,6 |
| pH 5,5 | 7,7±0,4 | 13,0±0,1 | 4,4±0,3 | 19,2±0,8 |
Следует отметить, что активность протеазы, осажденной (NH4)2SO4 была в 1.5 раза больше активности фермента, осажденной ацетоном. Следовательно, лучшим осадителем кислой протеазы из культуральной жидкости гриба Р. notatumBDU-M5 является (NH4)2SO4.Во всех вариантах уровень активности кислой протеазы рН 5.5 была больше активности при рН 2.5. Поэтому продолжали изучать свойства кислой протеазы рН 5.5.
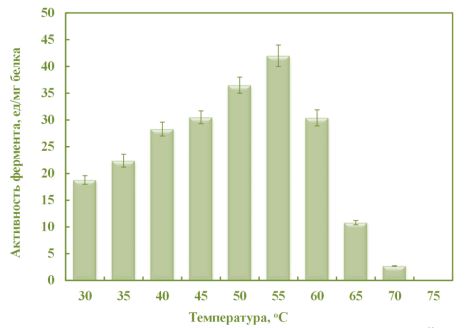
Изучение влияния температуры на активность кислой протеазы рН 5.5 показало, что по мере увеличения температуры до 55°С активность фермента постепенно увеличивается и достигает максимума, после чего наблюдается резкое понижение активности.Высокая активность фермента наблюдалась в диапазоне температур 45-60°С, а максимум активности – при 55°С (рис. 1).
Рис. 1 –Влияние температуры на активность кислой протеазы рН 5.5,полученной из PenicilliumnotatumBDU-M5
Оптимальная температура активности кислой протеазы рН 5.5 из Р. notatum BDU-M5 не совпадала с литературными данными, где показано, что оптимальная температура кислой протеазы из грибов Aspergillus oryzae MTCC 5341 [27] и Rhizopus oryzae MTCC 3690 [9] была 60°С, из A. niger BCRC 32720 – 40°C [18], из A. hennebergii HXO8 [10] и R. oryzae NBRC 4749 [6] – 50°C, из R. oryzae RA99880 – 75°C [14], Neosartarya fischeri IBT4872 – 35°C [29]. Следовательно, оптимальная температура активности кислой протеазы варьирует в зависимости от вида и штамма гриба.
Изучение термоинактивации показало, что при 40°С активность фермента в течении 30 мин не менялась, а через час потеря активности составляла 4%. В течении 3-х часов фермент сохранял 42% активности. При 50°С через час понижение активности составляло 26%. При 60 и 70°С через 10 мин активность фермента понизилась на 10 и 16%, соответственно, а через час – на 56и 88%, соответственно. Полная инактивация фермента происходила через 100 и 70 мин, соответственно, при 60° и 70°С (рис. 2). Следовательно, термоустойчивость кислой протеазы из гриба Р. notatumBDU-M5 проявилась в диапазоне 40-50°С, что не совпадает с термоустойчивостью кислой протеазы других грибов. Например, кислая протеаза из гриба A. nigerBCRC 32720 проявляла термоустойчивость в диапазоне температур 20-40°С [18], из A. niger 21 [23] и R. oryzaeNBRC 4749 [6] – при 30-40°С, из А. oryzaeMTCC 5341 (27) и R.oryzaeMTCC 3690[14] – при 40°С, из А. hennebergiiHX08 – при 30-50°С [10],из А. clavatus– при 45-55°C [24],из RhizopusoryzaeRA99880–при 35-45°С [14],из Phycomycesblakeslecanus – при 40°С [26].
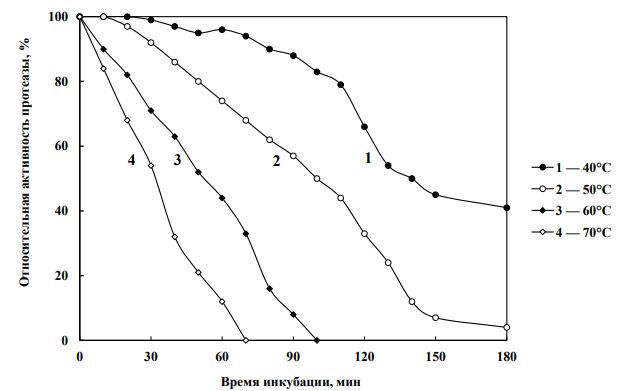
Рис. 2–Термостабильность кислой протеазы рН 5.5,полученной из PenicilliumnotatumBDU-M5
Высокая активность кислой протеазы гриба P. notatumBDU-M5 наблюдалась в диапазоне кислотности рН 3.5-5.5, а наибольшая активность – при рН 4.5 (рис. 3).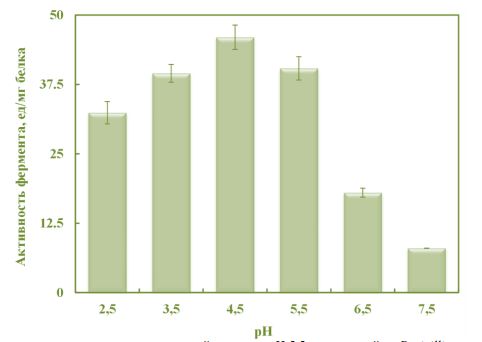
Рис. 3–Влияние кислотности на активность кислой протеазы рН 5.5,полученной из PenicilliumnotatumBDU-M5
Оптимальное значение кислотности фермента гриба Р. notatumBDU-M5 отличалось от рН оптимумов кислых протеаз, полученных из разных грибов. Так, кислая протеаза из грибов A. nigerBCRC32720 [18] и A. niger 21 [23], RhizopusoryzaeNBRC4749 [6] и R. hangchow [13] имели оптимум рН 3.0, из A. oryzaeMTCC 5341 – рН 3.2 [27], из А. hennebergiiHX08 – pH 4.0 [10],из RhizopusoryzaeRA99880–pH 3.4 [9], R. oryzaeUTCC 3690 –pH 5.5 [9], A. nigerBCRC-32720 [26] и R. microsporus – pH 2.5 [27].
Изучение кислотоустойчивости кислой протеазы гриба PenicilliumnotatumBDU-M5 показало, что через 2 часа инкубации при рН 3.5, 4.5, 5.5 и 6.5 активность фермента уменьшается, соответственно 52, 56, 70 и 18 %. Следовательно, наибольшая устойчивость фермента проявляется в диапазоне рН 3.5-5.5 (рис. 4). И эти данные отличаются от рН стабильности кислых протеаз других грибов. Так, кислотоустойчивость кислой протеазы из грибовA. nigerBCRC 32720 [10] и R. oryzaeRA99880 [9] наблюдалось в диапазоне рН 3.0-6.0, из A. oryzaeLK-101–pH 4.5-7.5 [16], из A. oryzaeMTCC5341 – pH 2.5-6.0 [27], из A. clavatus – pH 4.5-6.0 [24], из A. hennebergiiHXO8– pH 3.0-5.0 [10].
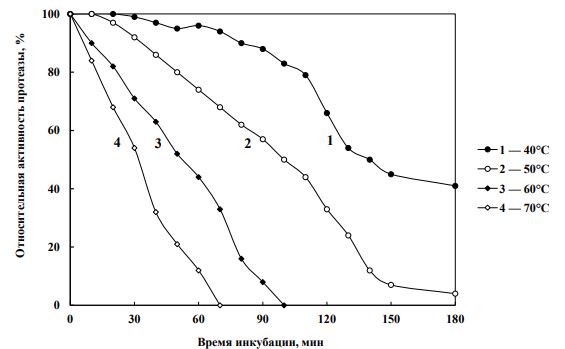
Рис. 4–Кислотоустойчивость кислой протеазы, полученной из PencilliumnotatumBDU-M5
ЗаключениеТаким образом, показано, что лучшим осадителем внеклеточной кислой протеазы (рН 5.5) гриба PenicilliumnotatumBDU-M5 является (NH4)2SO4.Высокая активность фермента наблюдается в диапазоне температур 45-60°С, а оптимальной температурой является 55°С. Высокая термоустойчивость кислой протеазы наблюдается при 40-50°С.
Высокая активность кислой протеазы гриба проявляется в диапазоне рН 3.5-5.5 а наибольшая активность– при рН 4.5. Фермент показал кислотоустойчивость в течение 3-х часов при рН 3,5-5,5.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
- Дудка И.А.Методы экспериментальной микологии / И. А. Дудка, С. П. Вассер, И.А.Элланская и др. - Киев: Наукова-Думка, 1982.- 550 с.
- Ковкарь А.И. Прикладная математическая статистика / А.И.Ковкарь.- М.: ФИЗМАТЛИТ, 2006.- 816 с.
- Сафарова А.Х. Протеолитическая активность грибов рода Penicillium/ А.Х.Сафарова, С.М.Шафиева, Н.А.Агаева и др. // Научные труды института Микробиологии НАН Азербайджана. - 2018. - Т.16.- № 1. - С. 48-53.
- Сафарова А.Х. Влияние температуры на биосинтез протеолитических ферментов у Aspergillusflavus и Penicilliumnotatum / А.Х.Сафарова // Научные труды Университета Одлар Юрду. – 2020.- № 53.- С. 42-46.
- Сафарова А.Х. Влияние источников углерода и азота на биосинтез кислой протеазы у гриба PenicilliumnotatumBDU-M5 / А.Х.Сафарова, Х.Г.Ганбаров // Биотехнология микроорганизмов: материалы Международной науч.-практ. конф. 27-29 ноября 2019 г. Минск / Беларусский Государственный Университет - Минск, 2019. - С.196-197.
- Chen C. Purification and characterization of a new rhizopuspepsin from Rhizopus oryzae NBRC 4749 /С.Сhen, Y.Cho, C.Lai et al. // Four. Agric. Food Chem. -2009 - V. – 57. - P. 6742-6747.
- Chrzanowska J. Aspartic proteinase from Penicillium camemberti: purificution, properties and Substrate specifity /J.Chrzanowska, M.Kolaczkowska, M.Dryjanski // Enzym. Microbial. Technol. -1995.- V.- 17.- P.719-724.
- Fukumoto J. Studies on mold protase. Part 1. Purification, crystallization, and some enzymatic properties of acid protease of Rhizopus chinensis / Fukumoto, T.D.Daisuke, T.Yamamoto // Agr. Biol. Chem.- 1967.- V. 31.- P.710-717.
- Hsiao N. Purification and characterization of an aspartic protease from the Rhizopus oryzae protease extract / N.Hsiao, Y.Chen, Y.Kuanal et al. // Electronic J. Biotechnology. – 2014.- V.17.- P. 89-94.
- Huang Y. Purification and characterization of an acid protease from the Aspergillus hennebergii HXO8 and its potential in traditional fermentation / Huang, Y.Wang, Y.Xu // Jour. Inst. Brew.- 2017.- V.123.- P. 432-441.
- Ikram-Ul-Hag. Biosynthesis of acid proteases by Penicillium griseoroseum I11-02 in solid-state fermentation / Ul-Hag Ikram, H.Mukhtar // Pakistan J. Botany.- 2007.- V.39.- P. 2717-2724.
- Ikram-Ul-Hag. Fermentation medium optimization for the biosynthesis of Protase by Penicillium chrysogenum / Ul-Hag.Ikram, H.Mukhtar, H.Umber // Pakistan J. Zool.- 2008.- V. 40.- №2.- P. 69-73.
- Khishima E. Molecular and enzymatic Khishima properties of an aspartic proteinase from Rhizopus hangchow / E.Khishima, M.Ojima, J.Jamagata et al. // Phytochemistry.- 1995.- V. 38.- P. 27-30.
- Kumar S. Extracellular acid protase from Rhizopus oryzae: Purification and characterization / S.Kumar, N.Sharma, M.Saharan et al. // Process Biochem.- 2005.- V. 40.- P. 1701-1705.
- Larsen M.D. Characterization of the proteolytic activity of starter cultures of Penicillium roqueforti for production of bleu veined cheeses / M.D.Larsen, K.R.Kristiansen, T.K.Hansen // Int. J. Food Microbiology. - 1998. - V.43. - P.215-221.
- Lee S. Purification and characterization of Aspergillus oryzae 2K-101 salt tolerant acid protease / S.Lee, J.Hwang, H.Seung et al. // Food Science Technol.- 2010.- V. 19.- P. 327-334.
- Mefteh F. Response surface methodology optimization of an acidic protease produced by Penicillium bilaiae isolate TDPE 30 / F.Mefteh, F.Frikha, A.Daud et al. // Microorganisms.- 2019.- V.7.- № 74.- P. 1-8.
- Oseni O.A. Production of microbial protease from selected soil fungal isolates / O.A.Oseni // Nigerian four. Biotechnology.- 2011.- V. 23.- P. 28-34.
- Rao M. Molecular and biotechnology aspects of microbial proteases / M.Rao, A.Tanksale, M.Ghatge et al. // Microbiology and Molecular Biology. Reviews.- 1998.- V. 62.- P. 597-635.
- Razzaq A. Microbial proteases Applications / A.Razzaq, S.Shamsi, A.Ali et al. // Frontiers in Bioengineering and Biotechnology.- 2019.- V.7.- P.1-20.
- Schoen C. Molecular cloning of an extracellular aspartic proteinase from Rhizopus microsporus and evidence for its expression during infection / C.Schoen, U.Reichard, M.Monod et.al // Med. Mycol.- 2002.- V. 40.- P. 61-71.
- Si K. Purification and characterization of Aspergillius oryzae LK-101 salt – talerant acid protease / K.Si, J.Joo, H.Seug, M.Sang // Food. Sci. Biotechnol.- 2010.- V. 19.- № 2.- P. 327-334.
- Siala R. Extracellular acid protease from Aspergillus niger 21: Purification and characterization / R.Siala, A.Sellami, M.Hajji et al. // African Jour. Biotechnology.- 2009.- V. 8.- N 18.- P. 4582-4589.
- Talita A. Purification and some properties of an extracellular acid protease from Aspergillus clavatus / Talita, S.Sampaloe, K.Adriana // Wold Jour. Microbial. Biotechnol.- 2011.- V. 27.- P. 2491-2497.
- Umar Dahot M. Purification and some properties of alkaline protease from Penicillium expansum / M.Umar Dahot // Journal of Islamic Academy of Sciences.-1994.- V. 7.- №2.- P. 100-105.
- Vicente J. Purification and characterization of an extracellular aspartate protease from Phycomyces blakeslecanus / J.Vicente, D.Arrciago, P.Valle et al. // Fungal Genetics and Biology.- 1996.- V. 20.- P. 115-124.
- Vishwanatha K. Characterization of acid protease expressed from Aspergillus oryzae MTCE 5341 / K.Vishwanatha, A.Appubao, S.Singh // Food chemistry.- 2009.- V. 114.- P. 402-407.
- Withakker F.R. An absolute method for protein determination based of differences in absorbance at 235 and 260 nm / F.R.Withakker, P.E.Granum // Analytical Biochemistry.-1980.- V. 109.- P. 156-159.
- Wu L. Purification and characterization of acid proteinase from Neosurtarya fischeri IBT4872 / L.Wu, Y.Hang // Lett. Appl. Microbiol. - 1988. - V. 27. - P. 71-75.
- Yamanoto N. A hotlabile serine proteinase from Penicillium citrinum / N.Yamanoto, K.Matsumoto, J.Jamagata // Phytochemistry.-1993.- V. 32.- P. 1393-1397.
- Yin L. Purification and characterization of acidic protease from Aspergillus oryzae BCRC 30118 / L.Jin, J.Chou, S.Jiang // Journal of Marine Science and Technology- 2013.- Vol. 21.- № 1.- P. 105-110.
Список литературы на английском языке /References in English
- Dudka I.A. Metodi experimentalnoy mykologii [Methods of experimental mycology] / I.A.Dudka, S.P.Vasser, I.A.Ellanskaya et al. Kiyev: Naukova-Dumka.-1982.- 550 p. [in Russian]
- Kobzar A.I. Prikladnaya matematicheskaya statistika [Applied mathematical statistics] / A.I.Kobzar // FIZMATLIT: Moscow.- 2006.- 816 p. [in Russian]
- Safarova A.Kh. Proteoliticheskaya aktivnost gribov roda Penicillium [ Proteolytic activity of fungi genus Penicillium] / A.Kh.Safarova, S.M.Shafiyeva, N.A.Agayeva et al. // Transaction of the Institute of Microbiology of Azerbaijan National Academy of Sciences.Baku.-2018.- V.16.- N 1.- P.48-53 [in Russian]
- Safarova A.Kh. Vliyaniye temperaturi na biosintez proteoliticheskix fermentov [The impact of temperature on protease biosynthesis of fungi Aspergillus and Penicillium] / A.Kh.Safarova // The Scientific and Pedagogical news of Odlar Yurdu University.- 2019. N 52.- P.155-158 [in Russian]
- Safarova A.Kh. Vliyaniye istochnikov ugleroda i azota na biosintez kisloy proteazi u griba Penicillium notatum BDU-M5 [The impact of carbon and nitrogen sources on biosynthesis of acidic proteinase of funugus Penicillium notatum BDU-M5] / A.Kh.Safarova, Kh.G.Ganbarov // Materials of International Conference “Biotechnology of Microrganisms”, 27-29 November,Minsk / Belarus State University, Minsk.- 2019.- P.196-197 [in Russian]
- Chen C. Purification and characterization of a new rhizopuspepsin from Rhizopus oryzae NBRC 4749 /С.Сhen, Y.Cho, C.Lai, W.Hsu // Four. Agric. Food Chem. -2009 - V. – 57. - P. 6742-6747.
- Chrzanowska J. Aspartic proteinase from Penicillium camemberti: purificution, properties and Substrate specifity / J.Chrzanowska, M.Kolaczkowska, M.Dryjanski // Enzym. Microbial. Technol. -1995.- V.- 17.- P.719-724.
- Fukumoto J. Studies on mold protase. Part 1. Purification, crystallization, and some enzymatic properties of acid protease of Rhizopus chinensis / J.Fukumoto, T.D.Daisuke, T.Yamamoto // Agr. Biol. Chem.- 1967.- V. 31.- P.710-717.
- Hsiao N. Purification and characterization of an aspartic protease from the Rhizopus oryzae protease extract / N.Hsiao, Y.Chen, Y.Kuanal et al. // Electronic four. Biotechnology. – 2014.- V.17.- P. 89-94.
- Huang Y. Purification and characterization of an acid protease from the Aspergillus hennebergii HXO8 and its potential in traditional fermentation / Y.Huang, Y.Wang, Y.Xu // Jour. Inst. Brew.- 2017.- V.123.- P. 432-441.
- Ikram-Ul-Hag. Biosynthesis of acid proteases by Penicillium griseoroseum I11-02 in solid-state fermentation / Ul-Hag Ikram, H.Mukhtar // Pakistan Jour. Botany.- 2007.- V.39.- P. 2717-2724.
- Ikram-Ul-Hag. Fermentation medium optimization for the biosynthesis of Protase by Penicillium chrysogenum / Ul-Hag.Ikram, H.Mukhtar, H.Umber // Pakistan J. Zool.- 2008.- V. 40.- №2.- P. 69-73.
- Khishima E. Molecular and enzymatic Khishima properties of an aspartic proteinase from Rhizopus hangchow / E.Khishima, M.Ojima, J.Jamagata et al. // Phytochemistry.- 1995.- V. 38.- P. 27-30.
- Kumar S. Extracellular acid protase from Rhizopus oryzae: Purification and characterization / S.Kumar, N.Sharma, M.Saharan et al. // Process Biochem.- 2005.- V. 40.- P. 1701-1705.
- Larsen M.D. Characterization of the proteolytic activity of starter cultures of Penicillium roqueforti for production of bleu veined cheeses / M.D.Larsen, K.R.Kristiansen, T.K.Hansen // Int. J. Food Microbiology. - 1998. - V.43. - P.215-221.
- Lee S. Purification and characterization of Aspergillus oryzae 2K-101 salt tolerant acid protease / S.Lee, J.Hwang, H.Seung et al. // Food Science Technol.- 2010.- V. 19.- P. 327-334.
- Mefteh F. Response surface methodology optimization of an acidic protease produced by Penicillium bilaiae isolate TDPE 30 / F.Mefteh, F.Frikha, A.Daud et al. // Microorganisms.- 2019.- V.7.- № 74.- P. 1-8.
- Oseni O.A. Production of microbial protease from selected soil fungal isolates / O.A.Oseni // Nigerian four. Biotechnology.- 2011.- V. 23.- P. 28-34.
- Rao M. Molecular and biotechnology aspects of microbial proteases / M.Rao, A.Tanksale, M.Ghatge, V.Deshpande // Microbiology and Molecular Biology. Reviews.- 1998.- V. 62.- P. 597-635.
- Razzag A. Microbial proteases Applications / A.Razzaq, S.Shamsi, A.Ali et al. // Frontiers in Bioengineering and Biotechnology.- 2019.- V.7.- P. 1-20.
- Schoen C.Molecular cloning of an extracellular aspartic proteinase from Rhizopus microsporus and evidence for its expression during infection / C.Schoen, U.Reichard, M.Monod et al. // Med. Mycol.- 2002.- V. 40.- P. 61-71.
- Si K. Purification and characterization of Aspergillius oryzae LK-101 salt – talerant acid protease / K.Si, J.Joo, H.Seug, M.Sang // Food. Sci. Biotechnol.- 2010.- V. 19.- № 2.- P. 327-334.
- Siala R. Extracellular acid protease from Aspergillus niger 21: Purification and characterization / R.Siala, A.Sellami, M.Hajji et al. // African Jour. Biotechnology.- 2009.- V. 8.- N 18.- P. 4582-4589.
- Talita A. Purification and some properties of an extracellular acid protease from Aspergillus clavatus / A.Talita, S.Sampaloe, K.Adriana // Wold Jour. Microbial. Biotechnol.- 2011.- V. 27.- P. 2491-2497.
- Umar Dahot M. Purification and some properties of alkaline protease from Penicillium expansum / M.Umar Dahot // Journal of Islamic Academy of Sciences.-1994.- V. 7.- №2.- P. 100-105.
- Vicente J. Purification and characterization of an extracellular aspartate protease from Phycomyces blakeslecanus / J.Vicente, D.Arrciago, P.Valle et al. // Fungal Genetics and Biology.- 1996.- V. 20.- P. 115-124.
- Vishwanatha K. Characterization of acid protease expressed from Aspergillus oryzae MTCE 5341 / K.Vishwanatha, A.Appubao, S.Singh // Food chemistry.- 2009.- V. 114.- P. 402-407.
- Withakker F.R. An absolute method for protein determination based of differences in absorbance at 235 and 260 nm / F.R.Withakker, P.E.Granum // Analytical Biochemistry.-1980.- V. 109.- P. 156-159.
- Wu L. Purification and characterization of acid proteinase from Neosurtarya fischeri IBT4872 / L.Wu, Y.Hang // Lett. Appl. Microbiol. - 1988. -V.27.- P.71-75.
- Yamamoto N. A hotlabile serine proteinase from Penicillium citrinum / N.Yamanoto, K.Matsumoto, J.Jamagata // Phytochemistry.-1993.- V. 32.- P. 1393-1397.
- Yin L. Purification and characterization of acidic protease from Aspergillus oryzae BCRC 30118 / L.Jin, J.Chou, S.Jiang // Journal of Marine Science and Technology- 2013.- Vol. 21.- № 1.- P. 105-110.