СООТНОШЕНИЕ МЕЖДУ ПОКАЗАТЕЛЯМИ СВОБОДНОРАДИКАЛЬНОГО ОКИСЛЕНИЯ ЛИПИДОВ И БЕЛКОВ В ПЛАЗМЕ КРОВИ ПОСЛЕ СИСТЕМНОЙ АНОКСИИ У ЖИВОТНЫХ С РАЗНОЙ УСТОЙЧИВОСТЬЮ К ГИПОКСИИ
Байбурина Г.А.1, Нургалеева Е.А.2, Аглетдинов Э.Ф.3, Степанова Е.М.4
1Кандидат медицинских наук, доцент, 2Доктор медицинских наук, доцент, 3Доктор медицинских наук, 4Кандидат медицинских наук, доцент, Башкирский государственный медицинский университет в г. Уфе
СООТНОШЕНИЕ МЕЖДУ ПОКАЗАТЕЛЯМИ СВОБОДНОРАДИКАЛЬНОГО ОКИСЛЕНИЯ ЛИПИДОВ И БЕЛКОВ В ПЛАЗМЕ КРОВИ ПОСЛЕ СИСТЕМНОЙ АНОКСИИ У ЖИВОТНЫХ С РАЗНОЙ УСТОЙЧИВОСТЬЮ К ГИПОКСИИ
Аннотация
Эксперимент выполнен на самцах неинбредных белых крыс, разделенных на 2 группы по устойчивости к гипоксии. 5-минутную аноксию моделировали под общим эфирным наркозом интраторакальным пережатием сосудистого пучка сердца с последующей реанимацией. Период наблюдения составлял 35 дней. В плазме крови определяли содержание ТБК-реагирующих продуктов, карбонилированных белков, железо-зависимое образование битирозина. Установлено, что для высокоустойчивых к гипоксии животных в постгипоксическом периоде характерна высокая устойчивость белков плазмы крови к свободнорадикальному окислению на фоне высокого уровня перекисного окисления липидов. Напротив, у животных неустойчивых к гипоксии на фоне относительно низких значений липопероксидации регистрировали высокие уровни показателей окислительного модифицирования белков, которые в несколько раз превышали соответствующие значения в оппозитной группе.
Ключевые слова: гипоксия, крысы, перекисное окисление липидов, окислительная модификация белков, резистентность к гипоксии.
Bayburina G.A.1, Nurgaleeva E.A.2, Agletdinov E.F.3, Stepanova E.M.4
1MD, аssociate professor, 2MD, аssociate professor, 3MD, 4MD, аssociate professor, Bashkir State Medical University in Ufa
THE RATIO BETWEEN FREE RADICAL OXIDATION OF LIPIDS AND PROTEINS IN THE BLOOD PLASMA AFTER SYSTEMIC ANOXIA IN ANIMALS WITH DIFFERENT RESISTANCE TO HYPOXIA
Abstract
The experiment was performed on male noninbred albino rats divided into 2 groups of resistance to hypoxia. 5-minute simulated anoxia was modeled under general ether anesthesia with an intrathoracic cardiac vascular clamping beam with a subsequent resuscitation. The observation period lasted for 35 days. The blood plasma was determined with a content of TBA-reactive products, carbonylated proteins, an iron-dependent formation of bitirozin. It was found that a highly resistant to hypoxia animals have a posthypoxic period, which is characterized with a high stability of the plasma proteins to a free radical oxidation in the context of high levels of lipid peroxidation. In contrast, the animals unstable to hypoxia at relatively low values of the background lipoperoxidation high levels of oxidative modification of proteins were recorded, which several times are higher than the corresponding values in an opposite group.
Keywords: hypoxia, rats, lipid peroxidation, oxidative modification of proteins, resistance to hypoxia.
Свободнорадикальное окисление является кислородзависимым процессом, а напряженность энергетических кислородзависимых процессов в клетке является ведущим фактором, определяющим интенсивность процессов окислительной деструкции биомолекул [1]. Известно, что низкоустойчивые (НУ) к гипоксии животные, по сравнению с высокоустойчивыми (ВУ) животными, характеризуются более высоким уровнем потребления кислорода, что влечет за собой более высокий уровень свободнорадикального окисления [2, С. 202]. Установлено, что для НУ животных характерны более высокие значения активности микросомального окисления и более высокий уровень перекисного окисления липидов (ПОЛ) в микросомах [3, С.105-108], [4, С. 4-10].
Согласно современным представлениям, в состоянии окислительного стресса атаке активных форм кислорода подвергаются не только и не столько фосфолипиды, но и белки плазматических мембран, что приводит к их деполимеризации и лизису клеток. Поэтому окислительную модификацию белков (ОМБ), наряду с липидной пероксидацией, рассматривают как один важнейших маркеров повреждения ткани [5, С.1-3].
В ходе ряда патологических состояний окислительный стресс сочетается с карбонильным, возникающим в результате увеличения концентрации активных соединений, содержащих альдегидные и карбонильные группы. К этим соединениям относятся глиоксаль, метилглиоксаль, 3-гидроксиглюкозон, представляющие собой продукты окисления углеводов. Активными карбонильными соединениями являются также малоновый диальдегид и 4-гидроксиноненаль, возникающие при перекисном окислении липидов [6, С.84]. Карбонильные продукты образуются также при свободнорадикальном окислении белков [7, С. 389-390]. Вышеперечисленные соединения модифицируют аминокислотные остатки белков и азотистые основания нуклеиновых кислот, меняя свойства этих важнейших биомолекул. Карбонильный стресс в настоящее время считается наиболее тяжелым проявлением оксидативного стресса, приводящим к инициации воспаления, аутоиммунных повреждений, гибели клетки (апоптоз или некроз) [8, С. 399-406].
Поэтому оценка соотношения между интенсивностью липопероксидации и окислительной модификации белков необходима для комплексной оценки процессов свободнорадикального окисления и характеристики проявлений окислительного стресса.
Таким, образом, отличия в реакции на гипоксические повреждения у ВУ и НУ к гипоксии животных в восстановительном периоде могут приводить к существенным отличиям динамики формирования окислительного стресса, а, следовательно, определять многие важные особенности течения постреанимационных осложнений.
Цель исследования: комплексная характеристика динамики формирования окислительного стресса у высоко- и низкоустойчивых к гипоксии животных в восстановительном периоде после остановки системного кровообращения.
Материалы и методы. Серия экспериментов выполнена на 320 половозрелых самцах неинбредных белых крыс массой 150-180 г. Животных содержали на стандартном рационе вивария при свободном доступе к воде. Условия проведения экспериментов для контрольных и опытных групп были идентичными.
По итогам тестирования на устойчивость к гипоксии [9] животные были разделены на 4 группы – неустойчивые, низкоустойчивые, среднеустойчивые и высокоустойчивые. В эксперимент брали животных отнесенных к двум крайним по устойчивости группам: высокоустойчивым и неустойчивым к гипоксии. Группы включали по 70 опытных и 10 контрольных крыс. Через неделю после тестирования под общим эфирным наркозом моделировали 5-минутную аноксию интраторакальным пережатием сосудистого пучка сердца по методу Корпачева В.Г. [10, С. 78-80]. Реанимация проводилась с помощью наружного массажа сердца и искусственной вентиляции легких. Контрольная группа крыс после тестирования на устойчивость к гипоксии подвергалась эфирному наркозу без моделирования аноксии. Период наблюдения составлял 35 дней. По истечении 1-х, 3-, 5-, 7-, 14-, 21- и 35-х суток животных под эфирным наркозом выводили из эксперимента декапитацией и осуществляли забор крови для исследования.
Содержание в плазме крови карбонилированных белков (КБ) определяли по их реакции с 2,4-динитрофенилгидразином с последующей спектрофотометрической регистрацией продуктов взаимодействия – динитрофенилгидразонов [11, С. 272], железо-зависимое образование битирозина (БТ) по методу [11, С. 275], продуктов, реагирующих с тиобарбитуровой кислотой (ТБК-рп) с помощью набора реактивов «ТБК-АГАТ» (фирма ООО АГАТ-МЕД, Москва).
Статистическую обработку результатов проводили с использованием стандартного пакета программ Statistica 6.0. Описательная статистика данных проводилась в виде среднего квадратического отклонения М±m. Сравнение групп проводили с использованием непараметрического (критерий (U) Манна–Уитни) метода.
Результаты исследования
При анализе данных, полученных при исследовании плазмы крови интактных животных (контрольные группы), установлено, что высокоустойчивые к гипоксии животные исходно отличались относительно меньшим уровнем окислительной модификации белков плазмы крови (рисунок 1Б, 1В).
Уровень карбонилирования, как базального, так и металл-катализируемого статистически значимо отличался от соответствующих показателей групп животных с высокой и низкой устойчивостью к гипоксии (рисунок 1Б, 1В). При этом исходный уровень ТБК-РП и БТ не имел существенных отличий в группах животных с различной устойчивостью к гипоксии (рис. 1А, 1Г).
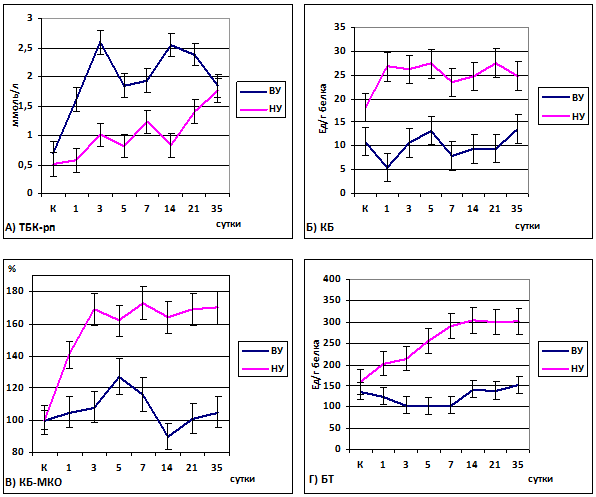
Рис. 1 – Динамика карбонилирования белков и содержания ТБК-РП в плазме крови в восстановительном периоде у крыс с различной устойчивостью к гипоксии. Примечание: КБ – карбонилированные белки; КБ-МКО – металл-катализируемое окисление (индукция Fe2+/H2O2); БТ – битирозин
Таким образом, животные с низкой интенсивностью кислородного метаболизма (высокоустойчивые) отличаются меньшей интенсивностью карбонилирования белков плазмы крови. При этом интенсивность липидной пероксидации и уровень битирозина в крови не зависят от устойчивости к гипоксии.
Тяжелая гипоксия, вызванная системной остановкой кровообращения, закономерно сопровождалась развитием окислительного стресса: на протяжении всего периода наблюдения (35 суток с момента остановки системного кровообращения) в плазме крови наблюдались существенные изменения уровней продуктов свободнорадикального окисления, как липидов, так и белков.
Уровень продуктов перекисного окисления липидов в плазме крови, исходно не зависящий от интенсивности кислородного метаболизма, статистически значимо превышал контрольные значения в течение всего периода наблюдения вне зависимости от устойчивости к гипоксии. При этом наибольший прирост продуктов ПОЛ наблюдался у ВУ животных, а наименьший – в группе НУ животных. Следует отметить, что уровень ПОЛ к концу периода наблюдения в обеих группах был практически одинаков, однако не достигал контрольных значений, статистически значимо от них отличаясь.
У высокоустойчивых к гипоксии животных, исходно отличавшихся низким уровнем ОМБ плазмы крови, не наблюдаюсь его существенных колебаний вплоть до 35 суток. Уровень ОМБ у ВУ животных не только не превышал контрольных значений, но и был статистически значимо снижен с 3-го по 5-е сутки наблюдения (битирозин) после системной остановки кровообращения. Таким образом, для ВУ к гипоксии животных в постгипоксическом периоде характерна высокая устойчивость белков плазмы крови к свободнорадикальному окислению на фоне высокого уровня липидной пероксидации.
Животные НУ к гипоксии, напротив, демонстрировали большие уровни ОМБ на фоне относительно низких значений ПОЛ. При этом показатели, характеризующие как карбонилирование, так и образование битирозина, в несколько раз (статистически значимо) превышали соответствующие значения в группах ВУ к гипоксии животных.
Анализ данных литературы позволяет сделать заключение о том, что изменения уровня продуктов свободнорадикального окисления наблюдается в результате:
- изменения количества и/или доступности субстратов для свободнорадикальных процессов [11, С. 9-24];
- изменения количества и/или активности прооксидантов (с последующим изменением генерации свободных радикалов) [12, С.136-141];
- изменения количества и/или активности компонентов антиоксидантной системы [11, С.88-98], [12, С. 431-434].
Такого рода взаимодействия между про- и антиоксидантными системами приводят к преобладанию тех или иных продуктов свободнорадикального окисления в ткани. В целом, в плазме крови как ВУ, так и НУ животных отчетливо прослеживаются реципрокные изменения уровней ПОЛ и ОМБ: высокий уровень ПОЛ ассоциирован с низким уровнем ОМБ, и наоборот. Эта ситуация характерна для состояний, сопровождающихся адекватным ответом антиоксидантных систем, что согласуется с данными по активности ключевых антиоксидантов. Поэтому транзиторная активация ПОЛ у высокоустойчивых к гипоксии животных не сопровождается усилением ОМБ. То есть, свободнорадикальное повреждение молекул ограничивается только липидами за счет адекватной емкости и сохранности антиоксидантных систем, экранирующих белки. У низкоустойчивых животных, напротив, относительная «сохранность» липидов, видимо, в силу относительно большей емкости липофильных антиоксидантных систем, является причиной активации ОМБ. Руководствуясь обозначенной выше логикой, следует отметить, что относительно низкий уровень ТБК-РП в группе НУ животных может быть связан с относительно меньшим уровнем субстратов для переокисления, т.е. ненасыщенных ацильных остатков в структуре липидов. Таким образом, у НУ животных основным проявлением окислительного стресса является усиление ОМБ, а у ВУ животных – активация ПОЛ. Поскольку у животных с НУ к гипоксии на протяжении всего периода наблюдения наблюдалось статистически значимое повышение как ПОЛ, так и ОМБ, можно говорить о большей выраженности окислительного стресса в данной группе.
С позиций концепции адаптационных стратегий В.И. Кулинского и И.А. Ольховского [13, С. 697-714] чувствительность к гипоксии можно рассматривать как один из интегральных показателей толерантной (т.е. гипометаболической) стратегии адаптации, а в рамках представлений Ф.З. Меерсона [14, c.574-575] – как метод общей оценки функционирования стресс-лимитирующих систем. Авторы концепции двух адаптационных стратегий аргументированно декларируют гомологичность толерантного гипобиоза и стадии истощения (дистресса по Г.Селье), иными словами, в понимании В.И. Кулинского и И.А. Ольховского, "стадия истощения" – это семантически устаревшее понятие, реальным содержанием которого является целенаправленная толерантная стратегия адаптации, сменяемая в случае своей неэффективности мобилизацией механизмов стрессорной резистентности.
Список литературы / References
- Чеснокова Н. П. Молекулярно-клеточные механизмы индукции свободнорадикального окисления в условиях патологии / Н. П. Чеснокова, Е. В. Понукалина, М. Н. Бизенкова // Современные проблемы науки и образования. – 2006. – № 6.
- Лукьянова Л. Д. Дизрегуляция аэробного энергетического обмена – типовой патологический процесс / Л. Д. Лукьянова // Дизрегуляторная патология / под ред. Г. Н. Крыжановского. - М.: Медицина, 2002. - С. 188-215.
- Грек O. P. Гипобарическая гипоксия и метаболизм ксенобиотиков / О. Р. Грек, А. В. Ефремов, В. И. Шарапов. – М. : ГЭОТАР-Медиа, 2007. – 120 с.
- Лукьянова Л. Д. Сигнальная функция митохондрий при гипоксии и адаптации / Л. Д. Лукьянова // Патогенез. – 2008. – Т. 6, № 3. – С. 4–12.
- Dean R. T. Biochemistry and pathology of radical-mediated protein oxidation / R. T. Dean, R. Stocker, M. Davies // J. Biochem. – 1997. - № 15 (324). – P. 1-18.
- Байбурина Г. А. Роль путей клеточной сигнализации в развитии последствий окислительного стресса / Г. А. Байбурина // Медицинский вестник Башкортостана. – 2016. - Т. 11, № 2 (62). - С. 82-91.
- Miyata T. Alterations in nonenzymatic biochemistry in uremia: origin and significance of “carbonyl stress” in long-term uremic complications / T.Miyata, C. De Strihou, K. Kurokawa // Kidney Int. – 1999. – Vol. 55, № 2. – P. 389-399.
- Protein carbonylation and metabolic control systems / J. M. Curtis, W. S. Hahn, E. K. Long, J. S. Burrill // Trends Endocrinol. Metabolism. – 2012. – Vol. 23, №. 8. – P. 399-406.
- Способ определения степени устойчивости к гипобарической гипоксии мелких лабораторных животных: пат. 2563059 Рос. Федерация, МПК G09B 23/28 / Г. А. Байбурина, Е. А. Нургалеева, Д. З. Шибкова [и др.]. - № 20141377/14; заявл. 17.09.2014; опубл. 20.09.2015. Бюл. № 26.
- Корпачев В. Г. Моделирование клинической смерти и постреанимационной болезни у крыс / В. Г. Корпачев, С. П. Лысенков, Л. З. Телль // Патологическая физиология и экспериментальная терапия. - 1982. - № 3. - С. 78-80.
- Дубинина Е. Е. Продукты метаболизма кислорода в функциональной активности клеток (жизнь и смерть, созидание и разрушение). Физиологические и клинико-биохимические аспекты / Е. Е. Дубинина. - СПб.: изд-во Медицинская пресса, 2006. - 397 с.
- Меньщикова Е. Б. Окислительный стресс. Прооксиданты и антиоксиданты / Е. Б. Меньщикова, В. З. Ланкин, Н. К. Зенков. - М.: «Слово», 2006. - 556 с.
- Кулинский В. И. Две адаптационные стратегии в неблагоприятных условиях - резистентная и толерантная. Роль гормонов и рецепторов / В. И. Кулинский, И. А. Ольховский // Успехи современной биологии. - 1992. - Вып. 5-6. - С. 697-714.
- Меерсон Ф. З. Адаптация к стрессу и гипоксия / Ф. З. Меерсон // Бюллетень экспериментальной биологии и медицины. – 1994. – № 1. – С. 574–575.
Список литературы на английском языке / References in English
- Chesnokova N. P. Molekuljarno-kletochnye mehanizmy indukcii svobodnoradikal'nogo okislenija v uslovijah patologii [Molecular and cellular mechanisms of induction of free radical oxidation in terms of pathology] / N. P. Chesnokova, E. V. Ponukalina, M. N. Bizenkova // Sovremennye problemy nauki i obrazovanija [Modern problems of science and education]. – 2006. – № 6. [in Russian]
- Luk'janova L. D. Dizreguljacija ajerobnogo jenergeticheskogo obmena – tipovoj patologicheskij process [Dysregulation of aerobic energy metabolism - sample pathological process] / L. D. Luk'janova // Dizreguljatornaja patologija [Disregulatory pathology] / pod red. G. N. Kryzhanovskogo. - M.: Medicina, 2002. - S. 188-215. [in Russian]
- Grek O. P. Gipobaricheskaja gipoksija i metabolizm ksenobiotikov [Hypobaric hypoxia and metabolism of xenobiotics] / O. R. Grek, A. V. Efremov, V. I. Sharapov. – M. : GJeOTAR-Media, 2007. – 120 s. [in Russian]
- Luk'janova L. D. Signal'naja funkcija mitohondrij pri gipoksii i adaptacii [Signal function of mitochondria during hypoxia and adaptation] / L. D. Luk'janova // Patogenez [Pathogenesis]. – 2008. – V. 6. - № 3. – S. 4–12. [in Russian]
- Dean R. T. Biochemistry and pathology of radical-mediated protein oxidation / R. T. Dean, R. Stocker, M. Davies // J. Biochem. – 1997. - № 15 (324). – P. 1-18.
- Bajburina G. A. Rol' putej kletochnoj signalizacii v razvitii posledstvij okislitel'nogo stressa [Role of cell signaling pathways in the development of the consequences of oxidative stress] / G. A. Bajburina // Medicinskij vestnik Bashkortostana [Medical Bulletin of Bashkortostan]. – 2016. - V. 11. - № 2 (62). - S. 82-91. [in Russian]
- Miyata T. Alterations in nonenzymatic biochemistry in uremia: origin and significance of “carbonyl stress” in long-term uremic complications / T. Miyata, C. De Strihou, K. Kurokawa // Kidney Int. – 1999. – V. 55. - № 2. – P. 389-399.
- Protein carbonylation and metabolic control systems / J. M. Curtis, W. S. Hahn, E. K. Long, J. S. Burrill // Trends Endocrinol. Metabolism. – 2012. – V. 23. - №. 8. – P. 399-406.
- Sposob opredelenija stepeni ustojchivosti k gipobaricheskoj gipoksii melkih laboratornyh zhivotnyh: pat. 2563059 Ros. Federacija, MPK G09B 23/28 [A method for determining the degree of resistance to hypobaric hypoxia small laboratory animals Pat. 2563059 Ros. Federation, IPC G09B 23/28] / G. A. Bajburina, E. A. Nurgaleeva, D. Z. Shibkova [i dr.]. - № 20141377/14; zajavl. 17.09.2014; opubl. 20.09.2015. Bjul. № 26. [in Russian]
- Korpachev V. G. Modelirovanie klinicheskoj smerti i postreanimacionnoj bolezni u krys [Modeling of clinical death and disease in rats postresuscitational] / V. G. Korpachev, S. P. Lysenkov, L. Z. Tell' // Patologicheskaja fiziologija i jeksperimental'naja terapija [Pathological physiology and experimental therapy]. - 1982. - № 3. - S. 78-80. [in Russian]
- Dubinina E. E. Produkty metabolizma kisloroda v funkcional'noj aktivnosti kletok (zhizn' i smert', sozidanie i razrushenie). Fiziologicheskie i kliniko-biohimicheskie aspekty [Oxygen metabolism products in the functional activity of the cells (life and death, creation and destruction). Physiological and biochemical aspects of clinical and] / E. E. Dubinina. - SPb.: izd-vo Medicinskaja pressa, 2006. - 397 s. [in Russian]
- Men'shhikova E. B. Okislitel'nyj stress. Prooksidanty i antioksidanty [Oxidative stress. Pro-oxidants and antioxidants] / E. B. Men'shhikova, V. Z. Lankin, N. K. Zenkov. - M.: «Slovo», 2006. - 556 s. [in Russian]
- Kulinskij V. I. Dve adaptacionnye strategii v neblagoprijatnyh uslovijah - rezistentnaja i tolerantnaja. Rol' gormonov i receptorov [Two adaptation strategies in adverse conditions - resistant and tolerant. The role of hormones and receptors] / V. I. Kulinskij, I. A. Ol'hovskij // Uspehi sovremennoj biologii [Successes of modern biology]. - 1992. - Vyp. 5-6. - S. 697-714. [in Russian]
- Meerson F. Z. Adaptacija k stressu i gipoksija [Adaptation to stress and hypoxia] / F. Z. Meerson // Bjulleten' jeksperimental'noj biologii i mediciny [Bulletin of Experimental Biology and Medicine]. – 1994. – № 1. – S. 574–575. [in Russian]
