РАЗРАБОТКА ИММУНОХРОМАТОГРАФИЧЕСКИХ ТЕСТОВ С ВИЗУАЛЬНОЙ И ПРИБОРНОЙ РЕГИСТРАЦИЕЙ ДЛЯ БЫСТРОГО ВЫЯВЛЕНИЯ САЛЬМОНЕЛЛ
Шиленко И.В.1, Ярков С.П.2, Титов А.А.3, Кононенко А.Б.4, Иванчикова М.С.5
1Кандидат технических наук, 2Доктор биологических наук, 3Кандидат биологических наук, ФГУП «Государственный научно-исследовательский институт биологического приборостроения», 4Кандидат биологических наук, доцент, ФГБНУ «Всероссийский научно-исследовательский институт ветеринарной санитарии, гигиены и экологии», 5Студент, Российский химико-технологический университет имени Д.И. Менделеева
РАЗРАБОТКА ИММУНОХРОМАТОГРАФИЧЕСКИХ ТЕСТОВ С ВИЗУАЛЬНОЙ И ПРИБОРНОЙ РЕГИСТРАЦИЕЙ ДЛЯ БЫСТРОГО ВЫЯВЛЕНИЯ САЛЬМОНЕЛЛ
Аннотация
Разработаны иммунохроматографические тесты на основе конъюгатов наночастиц коллоидного золота и люминесцентных микрочастиц со специфическими антителами для быстрого выявления сальмонелл различных групп. Показано влияние свойств антител полученных из различных источников на чувствительность тестов. Указаны преимущества и недостатки использованных меток антител при конструировании иммунохроматографических тестов для выявления сальмонелл.
Ключевые слова: иммунохроматографический анализ, сальмонеллы, наночастицы коллоидного золота, люминесцентные микрочастицы.
Shilenko I.V.1, Yarkov S.P.2, Titov A.A.3, Kononenko A.B.4, Ivanchikova M.S.5
1PhD in Engineering, 2,3PhD in Biology, Federal State Unitary Enterprise «State Scientific Research Institute of Biological Engineering», 4PhD in Biology, «All Russian Scientific Research Institute of Veterinary Sanitary Hygiene and Ecology», 5Student, D. Mendeleev University of Chemical Technology of Russia
DEVELOPMENT OF THE IMMUNOCHROMATOGRAPHIC TESTS FOR THE RAPID SALMONELLA DETECTION USING VISUAL AND DEVICE DETECTION
Abstract
Immunochromatographic tests based on conjugates of gold nanoparticles and luminescent microparticles with specific antibodies for rapid detection of Salmonella various groups are developed. Influence of properties of antibodies from different sources on sensitivity of tests is shown. Advantages and disadvantages of the used antibodies labels at designing immunochromatographic tests for Salmonella detection are specified.
Keywords: immunochromatographic assay, salmonella, gold nanoparticles, luminescent microparticles.
Введение
В России сохраняется неблагоприятный прогноз по заболеваемости сальмонеллезом, поэтому своевременное выявление возбудителя заболевания представляет собой актуальную санитарно-гигиеническую задачу. По данным Роспотребнадзора три серовара S. enteritidis, S. typhimurium, S. infantis в 2014 г. составляли от 83,9 до 93% от общего числа выявленных сальмонелл [1].
Иммунохроматографические тесты (далее тесты) занимают самостоятельное место в обширном перечне методов выявления сальмонелл и, как правило, используются совместно с культуральным методом их выявления и идентификации. В большей части тестов для выявления сальмонелл применяют конъюгаты наночастиц коллоидного золота (НКЗ) с антителами [2-5]. Тесты представляют собой полоску мультимембранного композита, помещенную в пластиковую оправу. Мультимембранный композит состоит из нитроцеллюлозной мембраны, мембраны пропитанной конъюгированными НКЗ со специфическими антителами против сальмонелл и впитывающих подложек, соединенных между собой для обеспечения движения тока жидкости. На нитроцеллюлозной мембране в аналитической зоне нанесены антитела к сальмонеллам, а в контрольной зоне – антивидовые по отношению к антителам конъюгата антитела. Клетки сальмонелл, содержащиеся в жидкой пробе, под действием капиллярных сил взаимодействуют с конъюгатом и антителами, нанесенными на мембрану, образуя иммобилизованные на мембране иммунные комплексы, которые визуализируются благодаря метке использованной в конъюгате.
Известно, что иммунохроматографический анализ (ИХА) с применением люминесцентных меток имеет более высокую чувствительность по сравнению с другими, например, колориметрическими, метками [6]. Целью работы было сравнение эффективности различных по конструкции тестов, по выявлению клеток сальмонелл.
Материалы и методы
Для изготовления тестов применяли материалы компании Millipore, США: нитроцеллюлозную мембрану HF120, закрепленную на основе из полистирола, стекловолоконную GFCP и целлюлозную CFSP мембраны.
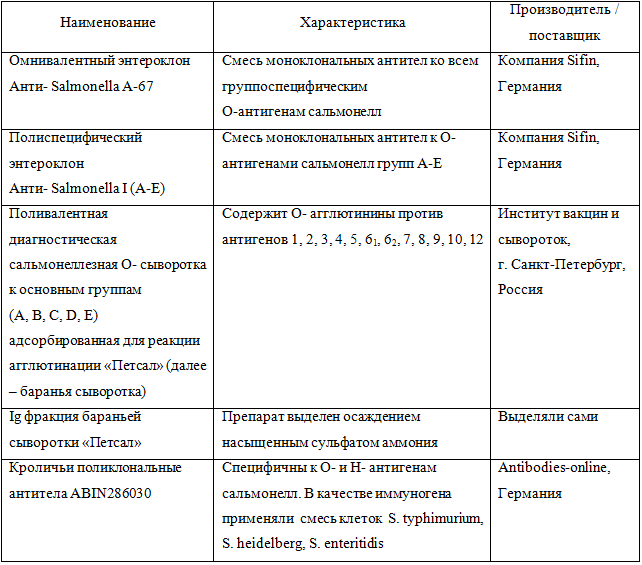
Для получения конъюгатов и формирования аналитической зоны мембраны применяли иммунокомпоненты, указанные в таблице 1.
Для конструирования тестов с визуальной регистрацией использовали конъюгаты НКЗ со специфическими антителами. НКЗ средним диаметром 25 и 40 нм получали по методу Frens [7] восстановлением 0,01% HAuCl4 раствором 1% цитрата натрия. Конъюгаты НКЗ с антителами получали по методике, описанной в [8].
Таблица 1 – Иммунокомпоненты, применявшиеся для разработки тестов
Для тестов с приборной регистрацией применяли конъюгаты антител с карбоксилированными люминесцентными микрочастицами FluoSpheres® (Molecular Probes, США) диаметром 0,1 мкм. Длины волны возбуждения люминесценции и эмиссии λвозб / λэмисс = 350/435 нм (голубая область спектра). Конъюгаты антител с микрочастицами получали используя N-(3-диметиламинопропил)-N/-этилкарбодиимид гидрохлорид (EDAC) по методике [9]. Массовое соотношение антител и микрочастиц в полученных нами конъюгатах было равно 0,05, 0,1 и 0,2.
Тесты получали следующим образом. Для тестов с визуальной регистрацией на стекловолоконную подложку наносили конъюгаты НКЗ, разведенные в 50 мМ буфере трис-(гидроксиметил)-аминометана, рН 8,5, содержащем 10% сахарозы и 0,25% БСА до А525 = 3,0 (для НКЗ диаметром 25 нм) и А530 = 3,0 (для НКЗ диаметром 40 нм). Для тестов с приборной регистрацией на стекловолоконную подложку наносили предварительно трижды обработанные ультразвуком конъюгаты люминесцентных микрочастиц в концентрациях 0,015% и 0,03%. На нитроцеллюлозную мембрану диспенсером в виде линий наносили антитела, разведенные в 10мМ К-Na фосфатном буфере с рН 7,4. В аналитическую зону теста наносили антитела к сальмонеллам: баранью сыворотку «Петсал», либо Ig фракцию, выделенную из нее в концентрациях 10 мг/мл или 19 мг/мл, либо энтероклоны в концентрации 2 мг/мл, либо кроличьи поликлональные антитела ABIN286030. В контрольную зону теста наносили антивидовые антитела по отношению к антителам конъюгата в концентрации 2 мг/мл. Мультимембранные композиты высушивали, нарезали на полоски шириной 5 мм и помещали в пластиковые оправы. Готовые тесты хранили в герметичных пакетах с силикагелем.
Для оценки чувствительности тестов готовили взвеси сальмонелл в концентрации 5х104 - 1х108м.к./мл в буфере для проведения иммунохроматографического анализа (ФГУП «ГосНИИБП», Россия). Все бактериальные препараты были предварительно инактивированы кипячением. S. paratyphi A штамм 225, S. typhimurium, S. paratyphi B, S. heidelberg штамм 1150, S. newport, S. choleraesuis, S. enteritidis штамм 17, S. typhi штамм 33, S. anatum штамм 161 были получены из коллекции НИИ вакцин и сывороток (г. Санкт-Петербург). S. typhimurium штамм VGNK, S. infantis штамм 517, S. enteritidis штамм 29/1, S. enteritidis штамм 899, S. dublin штамм 412, S. anatum штамм 33/36 были получены из коллекции ВНИИВСГЭ (г. Москва). Объем анализируемого образца не превышал 150 мкл, регистрацию результата анализа проводили через 15 мин и 30 мин. Визуальная регистрация результатов анализа заключалась в наблюдении окрашенных НКЗ полос на аналитической мембране. Две полосы – результат анализа положительный; одна полоса в контрольной зоне – результат анализа отрицательный, если окрашенных полос не наблюдали, то результат анализа не учитывали. Приборную регистрацию проводили на регистраторе люминесценции видеоцифровом «РЛВ-1» (разработка ФГУП «ГосНИИБП», Россия). Принцип работы прибора основан на видеоцифровой регистрации люминесценции [6]. Излучающие светодиоды и светофильтры регистратора позволяли возбуждать люминесценцию в диапазоне длин волн 340-400 нм, и регистрировать люминесценцию при длинах волн более 400 нм. Отношение интенсивности люминесценции аналитической и контрольной зон тестов (Q=Ia/Ic) измеряли в условных единицах. Если Q > 0, то результат анализа положительный, если Q = 0, то результат анализа считали отрицательным.
Обсуждение результатов
Подбор иммунокомпонентов для конъюгата и аналитической зоны проводили на тестах с визуальной регистрацией с конъюгатами со средним размером наночастиц 25 нм. Комбинировали конъюгаты антител и антитела наносимые в аналитическую зону мембраны.
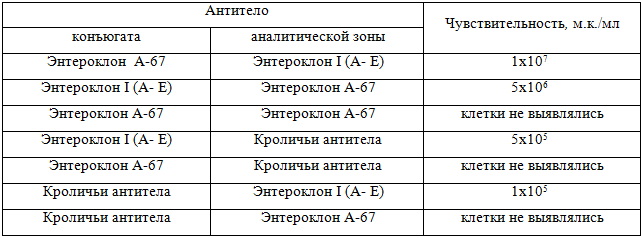
Было выявлено, что тесты с энтероклонами в конъюгате или аналитической зоне выявляли только S. typhimurium. Как видно из таблицы 2, если в составе теста присутствовали оба энтероклона, то чувствительность выявления S. typhimurium составляла 5х106 м.к./мл. Повысить чувствительность выявления S. typhimurium в 10 раз удалось заменой энтероклона А-67 на кроличьи поликлональные антитела. Энтероклоны для выявления других сальмонелл основных групп A, B, C, D, E иммунохроматографическим методом оказались малопригодны.
Таблица 2 – Выявление S. typhymurium экспресс-тестами с энтероклонами
Поскольку баранья сыворотка «Петсал» и ее Ig фракция помимо специфических иммуноглобулинов содержали другие белки, конъюгаты НКЗ получили с нагрузкой, равной пятикратной стабилизирующей концентрации. Различное комбинирование конъюгатов бараньей сыворотки, конъюгатов кроличьих антител с аналитическими мембранами, содержащими баранью сыворотку или Ig фракцию бараньей сыворотки, или кроличьи антитела, не привело к выявлению сальмонелл. Был сделан вывод, что агглютинирующую поливалентную сыворотку «Петсал» невозможно использовать в ИХА.
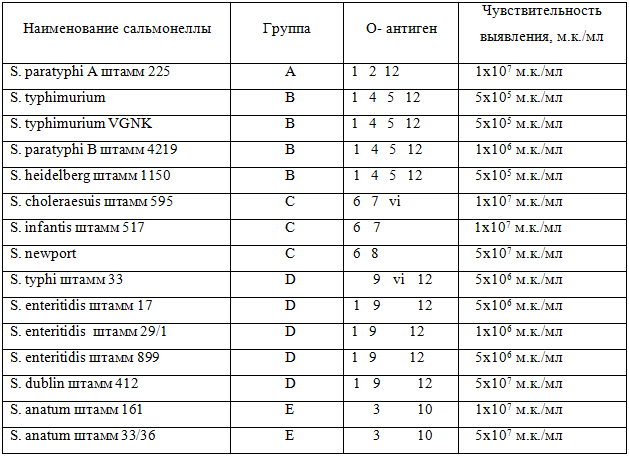
Основные группы сальмонелл A, B, C, D, E возможно было выявлять, если в конъюгате и аналитической зоне находились кроличьи поликлональные антитела. Время анализа составило 15 мин, увеличение времени анализа до 30 мин приводило к появлению окрашивания аналитической зоны теста (положительный результат) при анализе «холостой пробы». Как видно из таблицы 3, наибольшая чувствительность наблюдалась при выявлении сальмонелл группы В. Возможно, это объясняется тем, что в качестве иммуногена применяли смесь клеток S. typhimurium, S. heidelberg, S. enteritidis. S. typhimurium, S. heidelberg имеют три общих О-антигена (4, 5 и 12), а S. enteritidis – два общих О-антигена с S. typhimurium (1 и 12) и один с S. heidelberg (12). S. paratyphi A и S. typhi имели только один общий О-антиген (1 и 12 соответственно) с S. typhimurium, S. heidelberg, S. enteritidis. Остальные сальмонеллы общих антигенов не имели.
Таблица 3 – Чувствительность выявления сальмонелл экспресс-тестом на основе кроличьих поликлональных антител
Увеличение размера НКЗ для получения конъюгатов с кроличьими поликлональными антителами с 25 до 40 нм не привели к увеличению чувствительности выявления сальмонелл, хотя для белковых антигенов такой эффект наблюдался ранее [8]. Указанный тест был специфичен по отношению к микробным клеткам кишечной палочки, протея и шигелл в концентрациях в 10…100 раз превышающих чувствительность теста.
Поскольку наибольшим разнообразием выявляемых сальмонелл и чувствительностью обладал тест с кроличьими поликлональными антителами в конъюгате НКЗ и аналитической зоне, то именно с ними получили конъюгаты с люминесцентными микрочастицами. Конъюгаты отличались нагрузкой указанными антителами и концентрацией микрочастиц. Вначале сконструированные тесты на основе люминесцентных микрочастиц были испытаны «холостой» пробой. Были отобраны для дальнейших экспериментов тесты, проявившие яркую люминесценцию контрольной зоны (не менее 3000 усл. ед.) и отсутствие фоновой люминесценции аналитической зоны. Таким условиям удовлетворял тест с конъюгатом с концентрацией микросфер 0,015% и нагрузкой 0,2 мг кроличьих антител на 1 мг микросфер. Тестом, построенный на основе такого конъюгата, выявляли сальмонеллы, относящиеся к группам В, С и D.
При регистрации результата анализа через 15 мин чувствительность выявления сальмонелл S.typhimurium составила 5х106 м.к./мл, S. enteritidis 5х107 м.к./мл, S. heidelberg 1х106 м.к./мл. Для повышения чувствительности время анализа увеличили до 30 мин, тогда чувствительность выявления S.typhimurium стала 1х105 м.к./мл, S. enteritidis 1х106 м.к./мл, S. heidelberg 1х105м.к./мл.
Заключение
Показано, что для выявления сальмонелл групп A, B, C, D, E иммунохроматографическим методом в тестах для получения конъюгата и нанесения в аналитическую зону наиболее пригодны кроличьи поликлональные антитела, полученные к антигенам сальмонелл различных групп.
Исследована возможность выявления сальмонелл тестами на основе конъюгатов НКЗ и люминесцентных микрочастиц.
Тесты с приборной регистрацией на основе люминесцентных микрочастиц имеют чувствительность выявления сальмонелл в пять раз выше по сравнению с тестами с визуальной регистрацией на основе НКЗ. В то же время при конструировании и практическом применении тестов на основе люминесцентных микрочастиц существуют проблемы. Суспензии конъюгатов люминесцентных микрочастиц плохо стабилизируются антителами и белками, следовательно, способны к агрегации. Основная проблема заключается в агрегации суспензии полимерных микрочастиц за счет адгезии «полимер-полимер» в суспензии и «полимер-стекловолоконная подложка», учитывая значительную суммарную поверхность суспензии микрочастиц. Явления агрегации и адгезии затрудняют десорбцию конъюгата с подложки, а по мере хранения тестов приводят к необратимой адсорбции конъюгата. Сохраняемость тестов во времени требует дополнительного исследования. Необходимо постоянно контролировать агрегацию микрочастиц, из-за этого процесс получения конъюгата люминесцентных микрочастиц трудновоспроизводим. В процессе химической сшивки антител с микрочастицами возможна блокировка активных центров специфических антител, что приводит уменьшению активности взаимодействия с сальмонеллами. Для регистрации люминесценции требуется прибор, что с одной стороны увеличивает объективность полученных результатов, а с другой стороны – может удорожить стоимость единичного анализа. Тесты с визуальной регистрацией на основе НКЗ лишены данных недостатков. Срок годности тестов на основе НКЗ может достигать 2-3 лет при хранении при комнатной температуре.
Как правило, образцы продуктов питания имеют низкий уровень контаминации сальмонеллами. Поэтому иммунохроматографические тесты напрямую не применяют для выявления сальмонелл и сочетают с бактериологическим методом. В такой схеме анализа исследуемая проба после обогащения в жидкой питательной среде вносится в иммунохроматографический тест. Это позволяет сократить время, затрачиваемое в бактериологическом методе на весь анализ, и исключает последующую стадию культивирования микроорганизмов на плотных селективных средах [10]. Чувствительность иммунохроматографического теста в диапазоне 106-107 м.к./мл вполне приемлема для подобной схемы анализа. Иммунохроматографический тест должен быть чувствителен и специфичен, время анализа не должно превышать 30 мин, тогда в полной мере проявляются его преимущества перед общепризнанными, но более трудоёмкими методами – твердофазным иммуноферментным анализом (2-3 ч) и полимеразной цепной реакцией (4-6 ч).
Литература
- О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2014 году: Государственный доклад. –М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека, 2015. –206 с.
- Singlepath Salmonella for the rapid detection of Salmonella in food [Электронный ресурс]. Системные требования: Adobe Acrobat Reader. URL: http://www.amco-instruments.com/index_files/pdf/singlepath-salmonella.pdf (дата обращения 04.09.2015).
- Bird C.B. Reveal for Salmonella test system / C.B. Bird, R.L. Miller, B.M. Miller // J. AOAC Int. – 1999. – V. 82. – № 3. – P. 625–633.
- Evaluation of an immunochromatography strip assay for the detection of Salmonella sp. from poulty / D.A. Bautista, S. ElanKumaran, J.A. Akring, R.A. Heckert // J.Vet.Diagn.Invest. – 2002. – V. 14. – P. 427–430.
- RapidChek Select Salmonella enteritidis test system for detection of Salmonella enteritidis in poultry house drag swabs, shell egg pools, and chicken carcass rinsates / M.T. Muldoon, V. Gonzales, M.I. Sutzko et al. // J AOAC Int. –2011. – V. 94. – № 4. – P. 1138–115.
- Люминесцентный иммунохроматографический анализ антигенов микроорганизмов / С.П. Ярков, С.Н. Скопинская, И.В. Шиленко и др. // Вестник РАМН. – 2009. – № 3. – С. 20-26.
- Frens, G. Preparation of gold dispersions of varying particle size: Controlled nucleation for the regulation of the particle sise in monodisperse gold suspensions / G. Frens // Nature Phys Sci. – 1973. –V. 241, – № 1. – P. 20–22.
- Development and Optimization of Immunoassays for the Detection of Botulinum Toxins / A.A. Titov, I.V. Shilenko, A.A. Morozov et al. // Applied Biochemistry and Microbiology. – 2012. – v. 48. – № 2. – Р. 249-256.
- Working with FluoSpheres fluorescent microspheres. Molecular Probes. 2004. [Электронный ресурс]. Системные требования: Adobe Acrobat Reader. URL: http://tools.lifetechnologies.com/content/sfs/manuals/mp05001.pdf (дата обращения 12.03.2015).
- Соколов Д.М. Экспресс-тесты Singlepath и Duopath для выявления патогенных микроорганизмов и токсинов в пищевых продуктах / Д.М. Соколов, М.С. Соколов // Молочная промышленность. – 2015. – № 1. – С. 4-6.
References
- O sostojanii sanitarno-jepidemiologicheskogo blagopoluchija naselenija v Rossijskoj Federacii v 2014 godu: Gosudarstvennyj doklad.-M.: Federal'naja sluzhba po nadzoru v sfere zashhity prav potrebitelej i blagopoluchija cheloveka, 2015. –206 р.
- Singlepath Salmonella for the rapid detection of Salmonella in food. URL: http://www.amco-instruments.com/index_files/pdf/singlepath-salmonella.pdf
- Bird C.B. Reveal for Salmonella test system / C.B. Bird, R.L. Miller, B.M. Miller // J. AOAC Int. – 1999. – V. 82. – № 3. – P. 625–633.
- Evaluation of an immunochromatography strip assay for the detection of Salmonella sp. from poulty / D.A. Bautista, S. ElanKumaran, J.A. Akring, R.A. Heckert // J.Vet.Diagn.Invest. – 2002. – V. 14. – P. 427 – 430.
- RapidChek Select Salmonella enteritidis test system for detection of Salmonella enteritidis in poultry house drag swabs, shell egg pools, and chicken carcass rinsates / M.T. Muldoon, V. Gonzales, M.I. Sutzko et al. // J AOAC Int. – 2011. – V. 94. – № 4. – P. 1138–115.
- Ljuminescentnyj immunohromatograficheskij analiz antigenov mikroorganizmov / S.P. Yarkov, S.N. Skopinskaja, I.V. Shilenko i dr. // Vestnik RAMN. – 2009. – № 3. – S. 20–26.
- Frens, G. Preparation of gold dispersions of varying particle size: Controlled nucleation for the regulation of the particle sise in monodisperse gold suspensions / G. Frens // Nature Phys Sci. – 1973. –V. 241, – № 1. – P. 20–22.
- Development and Optimization of Immunoassays for the Detection of Botulinum Toxins / A.A. Titov, I.V. Shilenko, A.A. Morozov et al. // Applied Biochemistry and Microbiology. – 2012. – v. 48. – № 2. – Р. 249-256.
- Working with FluoSpheres fluorescent microspheres. Molecular Probes. 2004. URL: http://tools.lifetechnologies.com/content/sfs/manuals/mp05001.pdf .
- Sokolov D.M. Jekspress-testy Singlepath i Duopath dlja vyjavlenija patogenny mikroorganizmov i toksinov v pishcevyh produktah / D.M. Sokolov, M.S. Sokolov // Molochnaja promyshlennost'. – 2015. – № 1. – S. 4–6.