ПСИХРОТОЛЕРАНТНЫЕ БАКТЕРИИ ПОЧВ МОРСКОГО ПОБЕРЕЖЬЯ ПРИМОРСКОГО КРАЯ
ПСИХРОТОЛЕРАНТНЫЕ БАКТЕРИИ ПОЧВ МОРСКОГО ПОБЕРЕЖЬЯ ПРИМОРСКОГО КРАЯ
Научная статья
Сидоренко М.Л.1, *, Бойко А.Н.2, Слепцова Н.А.3, Сидоренко В.А.4
1 ORCID: 0000-0003-2008-3029;
2 ORCID: 0000-0002-0584-8882,
1, 2 ФНЦ Биооразнобразия наземной биоты восточной Азии ДВО РАН, Владивосток, Россия;
3 ORCID: 0000-0002-4226-1984,
3 Дальневосточный федеральный университет, Владивосток, Россия;
4 ORCID: 0000-0001-6483-1987,
4 Тихоокеанский государственный медицинский университет, Владивосток, Россия
* Корреспондирующий автор (sidorenko[at]biosoil.ru)
Аннотация
Из почв морского побережья Приморского края выделено 89 изолятов. 19 изолятов были психротолерантными и могли расти в диапазоне 4- 300С или 4-370С. Идентификация показала, что пять штаммов принадлежали к роду Kocuria, шесть штаммов – к роду Staphylococcus, по два штамма – к родам Bacillus и Pseudomonas, и по одному штамму принадлежали к родам Carnobacterium, Escherichia, Serratia, Agrococcus. Исследовали их ферментативную активность при разных температурах и выяснили, что наибольшим спектром при 40С обладают штаммы Pseudomonas и Serratia.
Ключевые слова: психротолерантные микроорганизмы, ферментативная активность, почвы морского побережья, Приморский край.
PSYCHROTOLERANT BACTERIA OF COASTAL SOILS OF PRIMORSKY KRAI
Research article
Sidorenko M.L.1, *, Boyko A.N.2, Sleptsova N.A.3, Sidorenko V.A.4
1 ORCID: 0000-0003-2008-3029;
2 ORCID: 0000-0002-0584-8882,
1 ,2 Federal Science and Biological Center for Bioenergy of the Terrestrial Biota of Eastern Asia, Vladivostok, Russia
3 ORCID: 0000-0002-4226-1984,
3 Far Eastern Federal University, Vladivostok, Russia;
4 ORCID: 0000-0001-6483-1987,
4 Pacific State Medical University, Vladivostok, Russia
* Corresponding author (sidorenko[at]biosoil.ru)
Abstract
89 isolates were singled out from the coastal soils of Primorsky Krai. 19 isolates were psychrotolerant and could grow in the range of 4–30 °C or 4–370 °C. Identification showed that five strains belonged to Kocuria genus, six strains – to Staphylococcus genus, two strains – to Bacillus and Pseudomonas genera, and one strain belonged to Carnobacterium, Escherichia, Serratia, Agrococcus genera. Their enzymatic activity at different temperatures was studied and it was established that the strains of Pseudomonas and Serratia have the highest spectrum at the temperature of 40 °C.
Keywords: psychrotolerant microorganisms, enzymatic activity, coastal soils, Primorsky Krai.
Исследования микроорганизмов в современном мире ведутся весьма активно, накоплено большое количество сведений о биоразнообразии, экологии и эволюции микроорганизмов. Только около 2% микроорганизмов используются на благо человека и приносят коммерческую выгоду, инвестиции в изучение микроорганизмов относительно малы [8]. Идентификация микроорганизмов, их изменчивость, различия в составе белков и липидов, их физиологический потенциал, химические характеристики могут иметь большое значение в будущем [20].
Микроорганизмы являются ценными источниками биологически активных веществ, которые могут быть использованы в различных областях промышленности, медицины, фармацевтики, науки и других. Психрофильные микроорганизмы обладают большим спектром ферментов, которые могут быть активны в достаточно широком диапазоне температур и поэтому очень ценны для биотехнологии [3], [4], [5], [6], [7]. Кроме этого, писхрофилы являются источником генов, которые расширяют возможности генной инженерии [4, 19]. Микроорганизмы, присутствующие в районах с постоянно низкими температурами, являются богатыми источниками ферментов [12], фармацевтических препаратов [9, 10], биотоплива, антимикробных соединений [15] и т.д.
Географическое положение российского Дальнего Востока, уникальные геологические особенности обеспечивают богатые источники разнообразия психрофильных микроорганизмов.
Цель исследования - выделение и изучение психротолерантных микроорганизмов из почв Приморского края.
В качестве объектов исследования служили образцы почв, отобранные на морском побережье юга Приморского края. Район работ включал побережье бухт Троицы (Хасанский район), Находка (г. Находка), Золотой Рог (г. Владивосток), Круглая (о. Русский).
Образцы почвы, каждый весом около 30г (без содержания льда) отбирались в течение марта 2018г. До отбора образца 1-2 см поверхности почвы удаляли стерильным шпателем, затем использовали другой стерильный шпатель, с помощью которого почву собирали, переносили в стерильные полипропиленовые пакеты. Пакеты транспортировали в лабораторию в стерильных сумках-холодильниках и хранили до исследования при –16°C не более 2-х суток.
Для выделения культивируемых бактерий проводили посев почвы на пептонный агар (ПА) (1% пептона ("Микроген" ФГУП НПО МЗ РФ), 0,5% NaCI на дистиллированной воде с 2%-ным агаром, рН 7,4) и растительный агар (РА) [1]. Примерно 1 г образца почвы суспендировали в 0,9% NaCl и встряхивали в течение 2 ч при 15 ° С. Для изоляции бактерий, 100 мкл образца почвенной суспензии высевали на поверхность плотной питательной среды (ПА и РА) и инкубировали при 4 ° С в течение 15 дней [18]. Регистрировали количество колоний и разные морфотипы очищали и поддерживали на агаровой среде ПА и РА
Рост при разных температурах (4, 18, 30, 370C) Проверяли с использованием питательного бульона (ПБ) (1% пептона ("Микроген" ФГУП НПО МЗ РФ), 0,5% NaCI на дистиллированной воде, рН 7,4)
Внеклеточные ферментативные активности, такие как амилазу [16], липазу [5], протеазу [16] проверяли путем инкубации на агаровых пластинах ABM, дополненных либо 0,2% растворимыми крахмал, 1% Твин-60 вместе с 0,01% CaCl2, 0,3% казеина, соответственно, и инкубировали при 4 и 180С в течение 5-10 дней.
Морфологические и физиолого-биохимическе свойства выделенных бактерий устанавливали в соответствии с классическими методами микробиологии [2]. Идентификацию проводили с помощью определителя Берджи [6] и также были использованы наборы для идентификации API (BioMerieux, Франция).
В ходе исследования было выделено 89 изолятов бактерий из почв морского побережья: 30 – побережье Золотого Рога, 19 – побережье бухты Троица, 24 – побережье бухты Находка и 16 – побережье бухты Круглая. Для дальнейших исследований все изоляты были сгруппированы в 19 морфотипов на основе морфологии их колонии
Для определения таксономической принадлежности полученных микроорганизмов проводилось изучение их культуральных и физиолого-биохимических свойств с помощью классических микробиологических методов.
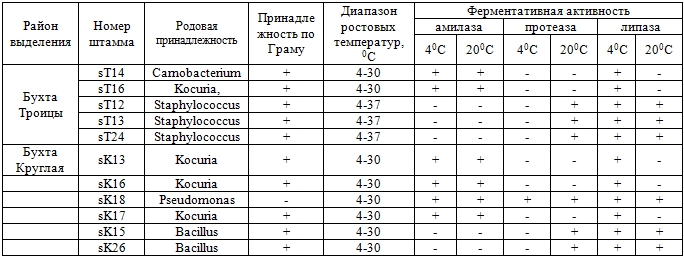
Таксономический анализ всех 19 штаммов различного морфотипа, выделенных из образцов почвы, показал, что 4 штамма были грамотрицательными и 15 были грамположительными. Результаты биохимических исследований и API-тестов показали, что пять штаммов принадлежали к роду Kocuria, шесть штаммов – к роду Staphylococcus, по два штамма – к родам Pseudomonas и Bacillus, и по одному штамму принадлежали к родам Carnobacterium, Escherichia, Serratia, Agrococcus (таблица1).
По результатам таксономического исследования обнаружено присутствие бактерий рода Staphylococcus в почвах прибрежных территорий трех бухт (Троицы, Золотой рог, Находка). Бактерии рода Kocuria также обнаружены в почвах прибрежных территорий трех бухт (Троицы, Находка и Круглая).
Таблица 1 – Характеристики и ферментативная активность бактериальных штаммов, выделенных из образцов почвы морского побережья Приморского края
Окончание табл. 1 – Характеристики и ферментативная активность бактериальных штаммов, выделенных из образцов почвы морского побережья Приморского края
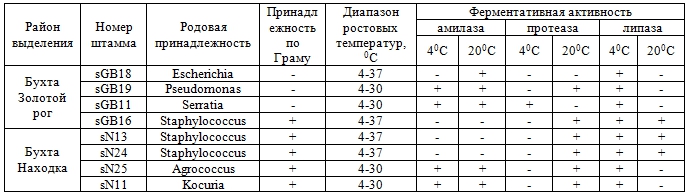
Отобранные 19 изолятов были исследованы на психрофильность. В результате установлена психротолерантность всех 19 изолятов, все они могли расти в диапазоне 4- 300С или 4-370С (таблица 1).
Активность амилазы была обнаружена у большинства штаммов (11 из 19), при этом она не зависела от температурного режима (таблица 1). Активность липазы обнаруживалась у всех штаммов при 40С, а при 200С таком свойством обладали только 9 из 19 штаммов. Протеазная активность при 40С обнаруживалась только у двух штаммов (sK18 Pseudomonas и sGB11 Serratia), при этом при 200С протеазную активность показали 12 штаммов.
В результате исследований выделяются два штамма, обладающие наилучшей ферментативной активностью. Штамм sGB11 Serratia, выделенный из прибрежных почв бухты Золотой рог, обладает амилазной, протеазной и липазной активностью при 40С, при 200С показывает только амилазную активность. Штамм sK18 Pseudomonas выделенный из прибрежных почв бухты Круглая обладает полным набором исследованных активностей не зависимо от температуры.
Бактерии рода Pseudomonas, по литературным данным, выделяется из активного ила на муниципальных очистных сооружениях в Японии, с возможностью использования алкилфенола с прямой цепью от 1 до 9 атомов углерода [17]. В питательном бульоне штамм может расти на 30 и 370С, но не могут расти при температуре 40С или 420С. Другая исследовательская группа опубликовала результаты своих исследований штамма P. japonica, выделенного из активного ила и способного вырабатывать сигнальные молекулы и образовывать биопленку в мембранном реакторе [14]. В нашем предварительном исследовании штамм sK18 Pseudomonas, выделенный из почвы морского побережья, обладает способностью продуцировать ферменты, разрушающие крахмал, Твин-60 и казеин, а активность не зависит от температуры культивирования. Насколько нам известно, это первый случай выделения штамма с ферментативной активностью при низкой температуре с потенциалом для разработки новых холодных активных ферментов, поэтому мы планируем дальнейшую работу с этим штаммом.
Бактерии рода Serratia являются факультативными анаэробами, которые могут быть обнаружены в окружающей среде и способны колонизировать в почве, воде и пищеварительных трактах грызунов, насекомых, рыб, людей и на растениях [13]. Было доказано, что эта бактерия обладает противогрибковыми свойствами в ризосфере растений [11]. Мы выделили штамм sGB11 Serratia, который показывает активность широкого спектра гидролитических ферментов в диапазоне 40С.
Таким образом, из почв морского побережья выделено 19 психротолерантных штаммов. Холодоактивные ферменты психротолерантных бактериальных штаммов sGB11 Serratia и sK18 Pseudomonas, выделенных из почв морского побережья Приморского края могут дать новые возможности для биотехнологического использования.
| Финансирование Статья подготовлена по результатам работы, выполненной при финансовой поддержке Президиума ДВО РАН (проект 18-МНТ-010). | Funding The article was prepared based on the results of the work carried out with the financial support of the Presidium of the Far Eastern Branch of the Russian Academy of Sciences (project 18-MNT-010). |
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Бузолева Л.С. Адаптация патогенных бактерий к абиотическим факторам окружающей среды: дисс. … докт. биол. наук: 03.00.07: защищена 22.09.01: утв. 15.12.01 / Бузолева Любовь Степановна. – Владивосток, 2001. –316 с.
- Винникова О.И., Самойлов А.М., Попова Ю.В. Выделение и идентификация бактерий: методические рекомендации для студентов биологического факультета специализации "Микробиология и вирусология" / О.И. Винникова, А.М. Самойлов, Ю.В. Попова – Харьков: ХНУ имени В. Н. Каразина, 2011. – 60 с.
- Нетрусов А.И., Бонч-Осмоловская Е.А., Горленко В.М. Экология микроорганизмов / А.И. Нетрусов, Е.А. Бонч-Осмоловская, В.М. Горленко. – М.: Академия, 2004. — 272 с.
- Bell N. Methyl iodide: Atmospheric budget and use as a tracer of marine convection in global models / N. Bell, L. Hsu, D.J. Jacob and others // J. Geophys. Res. – 2002. – Vol. 107. - № 17. – Р. 4340. doi:10.1029/2001JD001151.
- Methods in microbiology / edited by C. Booth. – New York: Academic Press, 1971. – 794 p.
- Bergey's Manual of Systematic Bacteriology / edited by G.M. Garrity. – Berlin: Springer, 2004. — 1136 p.
- Feller G., Gerday C. Psychrophilic enzymes: hot topics in cold adaptation / G. Feller, C. Gerday // Nat. Rev. Microbiol. – 2003. – № 1. – Р. 200–208.
- Gomes J., Steiner W. The Biocatalytic Potential of Extremophiles and Extremozymes / J. GOMES, W. STEINER // Food Technol. Biotechnol. – 2004. –Vol. 42. – № 4. – P. 223–235.
- Guider T.A.M., Moore B.S. Chasing the treasures of the sea bacterial marine natural products / T.A.M. Guider, B.S. Moore // Curr. Opin. Microbiol. –2009. – № – P. 252-260.
- Haygood M.G., Schmidt E.W., Davidson S.K. and others. Microbial symbionts of marine invertebrates: opportunities for microbial biotechnology / M.G. Haygood, E.W. Schmidt, S.K. Davidson and others // J Molec Microbiol Biotechnol. – 1999. – Vol. 1. – № 1. – P. 33-43.
- Kalbe C., Marten P., Berg G. Strains of the genus Serratia as beneficial rhizobacteria of oilseed rape with antifungal properties / C. Kalbe, P. Marten, G. Berg // Microbiol Res. – 1996. – Vol. 151. – P. 433-439.
- Kennedy J., Marchesi J.R., Dobson A.D.W. Marine metagenomics: strategies for the discovery of novel enzymes with biotechnological applications from marine environments / J. Kennedy, J.R. Marchesi, A.D.W. Dobson // Microb Cell Factories. – 2008. – № 7. – P. 27.
- Labbate M.I., Queck S.Y., Koh K.S. and others. Quorum sensing-controlled biofilm development in Serratia liquefaciens MG1/ M.I. Labbate, S.Y. Queck, K.S. Koh and others // Journal of Bacteriology. – 2004. – Vol. 186. – №3. – P. 692-698.
- Lade H., Paul D., Kweon J.H. Isolation and molecular characterization of biofouling bacteria and profiling of quorum sensing signal molecules from membrane bioreactor activated sludge / H. Lade, D. Paul, J.H. Kweon // Int J Mol Sci. – 2014. – № 15. – P. 2255–2273.
- Newman D.J., Hill R.T. New drugs from marine microbes: the tide is turning / D.J. Newman, R.T. Hill // J Ind Microbiol Biotechnol. – 2006. – Vol. 33. – P. 539-544.
- Priest F.G. Extracellular enzyme synthesis in the genus Bacillus / F.G. Priest // Bacteriol Rev. – 1977. – Vol. 41. – P. 711–753.
- Pungrasmi W., Lee H.S., Yokota A. and others. Pseudomonas japonica sp. nov., a novel species that assimilates straight chain alkylphenols / W. Pungrasmi, H.S. Lee, A. Yokota and others // J Gen Appl Microbiol. – 2008. – Vol. 54. – P. 61-69.
- Reddy G.S.N., Prabagaran S.R., Shivaji S. Leifsonia pindariensis sp. nov., isolated from the Pindari glacier of the Indian Himalayas, and emended description of the genus Leifsonia / Reddy G.S.N., Prabagaran S.R., Shivaji S. // Int J Syst Evol Microbiol. – 2008. – Vol. 58. – P. 2229–2234.
- Robertson D.E., Steer B. A. Recent progress in biocatalyst discovery and optimization / D.E. Robertson, B. A. Steer // Current Opinion in Chemical Biology. – 2004. – № 8. – P. 141–149.
- Russell N.J. Molecular adaptations in psychrophilic bacteria: potential for biotechnological applications / N.J. Russell // In Biotechnology of Extremophiles. – Berlin: Springer, 1998. – P. 1-21.
Список литературы на английском языке / References in English
- Buzoleva L. S. Adaptacija patogennyh bakterij k abioticheskim faktoram okruzhajushhej sredy [Adaptation of pathogenic bacteria to abiotic environmental factors]: dis. … of PhD in Biology: 03.00.07: defense of the thesis 22.09.01: approved 15.12.01 / Buzoleva Ljubov' Stepanovna. – Vladivostok, 2001. –316 p. [in Russian]
- Vinnikova O. I. Vydelenie i identifikacija bakterij: metodicheskie rekomendacii dlja studentov biologicheskogo fakul'teta specializacii "Mikrobiologija i virusologija" [Isolation and identification of bacteria: guidelines for students of the biological faculty of specialization "Microbiology and Virology"] / O. I. Vinnikova, A. M. Samojlov, Ju. V. Popova – Har'kov: HNU imeni V. N. Karazina, 2011. – 60 p. [in Russian]
- Netrusov A. I. Jekologija mikroorganizmov [Ecology of microorganisms] / A. I. Netrusov, E. A. Bonch-Osmolovskaja, V. M. Gorlenko. – M.: Akademija, 2004. — 272 p. [in Russian]
- Bell N. Methyl iodide: Atmospheric budget and use as a tracer of marine convection in global models / N. Bell, L. Hsu, D.J. Jacob and others // J. Geophys. Res. – 2002. – Vol. 107. - № 17. – Р. 4340. doi:10.1029/2001JD001151.
- Methods in microbiology / edited by C. Booth. – New York: Academic Press, 1971. – 794 p.
- Bergey's Manual of Systematic Bacteriology / edited by G.M. Garrity. – Berlin: Springer, 2004. — 1136 p.
- Feller G., Psychrophilic enzymes: hot topics in cold adaptation / G. Feller, C. Gerday // Nat. Rev. Microbiol. – 2003. – № 1. – Р. 200–208.
- Gomes J. The Biocatalytic Potential of Extremophiles and Extremozymes / J. Gomes, W. Stein // Food Technol. Biotechnol. – 2004. –Vol. 42. – № 4. – P. 223–235.
- Guider T. A. M. Chasing the treasures of the sea bacterial marine natural products / T. A. M. Guider, B. S. Moore // Curr. Opin. Microbiol. –2009. – № – P. 252-260.
- Haygood M. G. Microbial symbionts of marine invertebrates: opportunities for microbial biotechnology / M. G. Haygood, E. W. Schmidt, S. K. Davidson and others // J Molec Microbiol Biotechnol. – 1999. – Vol. 1. – № 1. – P. 33-43.
- Kalbe C. Strains of the genus Serratia as beneficial rhizobacteria of oilseed rape with antifungal properties / C. Kalbe, P. Marten, G. Berg // Microbiol Res. – 1996. – Vol. 151. – P. 433-439.
- Kennedy J. Marine metagenomics: strategies for the discovery of novel enzymes with biotechnological applications from marine environments / J. Kennedy, J. R. Marchesi, A. D. W. Dobson // Microb Cell Factories. – 2008. – № 7. – P. 27.
- Labbate M.I. Quorum sensing-controlled biofilm development in Serratia liquefaciens MG1/ M.I. Labbate, S. Y. Queck, K. S. Koh and others // Journal of Bacteriology. – 2004. – Vol. 186. – №3. – P. 692-698.
- Lade H. Isolation and molecular characterization of biofouling bacteria and profiling of quorum sensing signal molecules from membrane bioreactor activated sludge / H. Lade, D. Paul, J. H. Kweon // Int J Mol Sci. – 2014. – № 15. – P. 2255–2273.
- Newman D. J. New drugs from marine microbes: the tide is turning / D. J. Newman, R. T. Hill // J Ind Microbiol Biotechnol. – 2006. – Vol. 33. – P. 539-544.
- Priest F. G. Extracellular enzyme synthesis in the genus Bacillus / F. G. Priest // Bacteriol Rev. – 1977. – Vol. 41. – P. 711–753.
- Pungrasmi W. Pseudomonas japonica sp. nov., a novel species that assimilates straight chain alkylphenols / W. Pungrasmi, H. S. Lee, A. Yokota and others // J Gen Appl Microbiol. – 2008. – Vol. 54. – P. 61-69.
- Reddy G. S. N. Leifsonia pindariensis sp. nov., isolated from the Pindari glacier of the Indian Himalayas, and emended description of the genus Leifsonia / Reddy G. S. N., Prabagaran S. R., Shivaji S. // Int J Syst Evol Microbiol. – 2008. – Vol. 58. – P. 2229–2234.
- Robertson D. E. Recent progress in biocatalyst discovery and optimization / D. E. Robertson, B. A. Steer // Current Opinion in Chemical Biology. – 2004. – № 8. – P. 141–149.
- Russell N. J. Molecular adaptations in psychrophilic bacteria: potential for biotechnological applications / N. J. Russell // In Biotechnology of Extremophiles. – Berlin: Springer, 1998. – P. 1-21.
