ОКИСЛИТЕЛЬНЫЙ СТРЕСС ПРИ ГОНАРТРОЗЕ: ПРООКСИДАНТЫ И АНТИОКСИДАНТЫ
Панина С.Б.1, Плотников А.А.1, Гвалдин Д.Ю.1, Шевякова Е.А.2
1Аспирант, 2магистрант, Южный федеральный университет
ОКИСЛИТЕЛЬНЫЙ СТРЕСС ПРИ ГОНАРТРОЗЕ: ПРООКСИДАНТЫ И АНТИОКСИДАНТЫ
Аннотация
В статье приведены и проанализированы данные о состоянии баланса прооксиданты-антиоксиданты в клетках крови (лимфоциты), а также синовиальной жидкости пациентов с диагнозом гонартроз. Кроме того, рассмотрены известные маркеры оксидативного и нитрозильного стресса и интенсивность апоптоза лимфоцитов периферической крови при данной суставной патологии, что может служить прогностическим тестом в диагностике и терапии.
Ключевые слова: окислительный стресс, активированные кислородные метаболиты, гонартроз, антиоксидантные ферменты.
Panina S.B.1, Plotnikov A.A.1, Gvaldin D.Yu.1, Sheviakova E.A.2
1Postgraduate student, 2undergraduate student, Southern Federal University
OXIDATIVE STRESS AND OSTEOARTHRITIS OF THE KNEE: PRO-OXIDANTS AND ANTIOXIDANTS
Abstract
The data concerning the balance of pro-oxidants and antioxidants in the blood cells (lymphocytes) and synovial fluid in patients with osteoarthritis of the knee are considered and analyzed. Besides, known markers of oxidative and nitrosative stress and the intensity of lymphocytes’ apoptosis bound with this joint disorder are discussed; the obtained results can be applied as tests in diagnosis and medical treatment.
Keywords: oxidative stress, reactive oxygen species, osteoarthritis of the knee, antioxidant enzymes.
Свободнорадикальные процессы – нормальная и необходимая составляющая многих процессов жизнедеятельности живых организмов, протекающая с участием активированных кислородных метаболитов (АКМ), продуктов неполного восстановления молекулярного кислорода или обращения спина одного из электронов. АКМ регулируют клеточную пролиферацию, экспрессию множества генов, апоптоз [1]. Остеоартроз (ОА) – самая распространенная возраст-ассоциированная cуставная патология, связанная с дегенерацией хряща, воспалением синовиальной среды, изменениями субхондральной кости. Особенно актуальна данная проблема для населения развитых стран, так, в США после 60 лет ОА поражает около 30% населения [2]. Основные механизмы развития ОА связаны с дисбалансом процессов репарации и деградации матрикса хряща на фоне хронического воспаления, а также гиперпродукцией активированных кислородных метаболитов и гибелью хондроцитов, в частности, путем апоптоза [3, 4, 5].
Цель работы состояла в исследовании взаимосвязи параметров окислительного стресса в клетках крови и синовиальной жидкости, уровня апоптоза лимфоцитов у больных гонартрозом (ГА) и роли этих процессов в развитии дегенеративно-дистрофических изменений в суставе. Проведено биохимическое обследование 96 пациентов, которые в зависимости от способа лечения были разделены на 2 группы: 1 группа – больные, получавшие консервативное медикаментозное лечение, 2 группа – больные, которым применяли эндоартрохирургические технологии без повреждения костной основы. В качестве контроля использовали кровь 20 практически здоровых людей (доноров) соответствующего возраста.
Материалом для анализа являлись: суспензия мононуклеарной фракции крови (лимфоциты, моноциты), плазма крови и синовиальная жидкость (СЖ), полученная путём пункции поражённого коленного сустава. Уровень свободнорадикального окисления (СРО) оценивали по интенсивности хемилюминесценции [6], по содержанию стабильных метаболитов оксида азота - нитритов/нитратов [7] – и вторичного продукта перекисного окисления липидов (ПОЛ) – малонового диальдегида (МДА) [8] – в плазме и СЖ, а также изучали активности прооксидантных ферментов – миелопероксидазы [9] и НАДФН-оксидазы [10] – в мононуклеарах крови. Состояние антиоксидантной системы в лимфоцитах и СЖ оценивали по активности супероксиддисмутазы (СОД) [11], каталазы [12], глутатионпероксидазы (ГПО) [13], глутатион-S-трансферазы (GSТ) [14], уровню восстановленного глутатиона (GSН) [15]. Апоптоз лимфоцитов оценивали методом лазерной проточной цитофлуориметрии на приборе FACS Canto, фирмы Becton Dickinson (США) с использованием набора Annexin V-FITC apoptosis detection kit 1, фирмы BD Pharmingen (США) согласно протоколу фирмы-производителя.
В результате исследований было обнаружено повышение большинства параметров Н2О2-люминол-индуцированной хемилюминесценции (ХЛ) в синовиальной жидкости пациентов 2-й группы, которым применяли эндоартрохирургические технологии, по сравнению с 1-й группой больных, получавших консервативное лечение. Повышенная продукция АКМ, показанная методом ХЛ, приводит к активации ПОЛ и накоплению его промежуточного молекулярного продукта – МДА, уровень которого в синовиальной жидкости 2-й группы больных возрастает на 64% относительно 1-ой группы. В плазме крови пациентов также наблюдается накопление МДА, но менее выраженное. Таким образом, при хирургическом лечении гонартроза происходит интенсификация процессов ПОЛ в синовиальной жидкости и плазме крови. Было установлено, что в СЖ больных гонартрозом наблюдается повышение на 18% уровня нитритов/нитратов (NOx−) во 2-й группе пациентов по сравнению с 1-й группой. В группе больных, которым проводили консервативное лечение, содержание нитритов/нитратов (NOx−) в плазме крови остается в пределах нормы. В то же время в группе пациентов, которые подвергались хирургическому вмешательству, наблюдается повышение на 32% уровня NOx− в плазме крови. Это отражает повышенную продукцию оксида азота в синовии, что может способствовать развитию катаболических реакций в тканях сустава и усилению воспалительной реакции, а также апоптоза хондроцитов.
Установлено, что при гонартрозе происходит возрастание прооксидантного потенциала мононуклеаров крови за счет активации ферментов, генерирующих АКМ: НАДФН-оксидазы, активность которой возрастает на 40% во 2-й группе пациентов и миелопероксидазы, активность которой увеличивается на 27% в 1-й группе больных.
В лимфоцитах крови пациентов обеих групп возрастает активность ферментов первичного звена антиоксидантной защиты: СОД (в 1-й группе на 72%, во 2-й – на 30%) и каталазы (в 1-й группе на 26%, во 2-й – на 37%). При этом активность СОД в лимфоцитах пациентов после операции на 25% ниже, чем у пациентов, получавших консервативную терапию. Показано, что в СЖ больных 2-й группы наблюдается снижение супероксидустраняющей активности на 30% и компенсаторное увеличение скорости утилизации гидропероксида - на 53%. В обеих обследованных группах больных активность глутатионпероксидазы в лимфоцитах остается в пределах нормы. В СЖ больных 2-й группы активность ГПО снижена на 27% относительно больных 1-й группы, при этом содержание важнейшего антиоксиданта биологических жидкостей восстановленного глутатиона ниже на 38%. В лимфоцитах наблюдается повышение активности глутатион-S-трансферазы: в 1-й группе пациентов - на 61%, во 2-й группе – на 47% по сравнению с донорами. Таким образом, и в лимфоцитах, и в синовиальной жидкости при гонартрозе наблюдаются дисбаланс системы прооксиданты↔антиоксиданты в сторону усиления свободнорадикального оксиления, что в случае с лимфоцитами может привести к необратимым последствиям в виде запуска апоптоза.
Анализ уровня апоптоза по экспрессии фосфатидилсерина во внешнем монослое мембраны лимфоцитов с помощью FITC-меченого аннексина V на проточном лазерном цитофлуориметре показал, что в обеих группах пациентов наблюдается повышение уровня апоптоза лимфоцитов: в 1-й группе – на 50%, во 2-й – на 69% (рис.1).
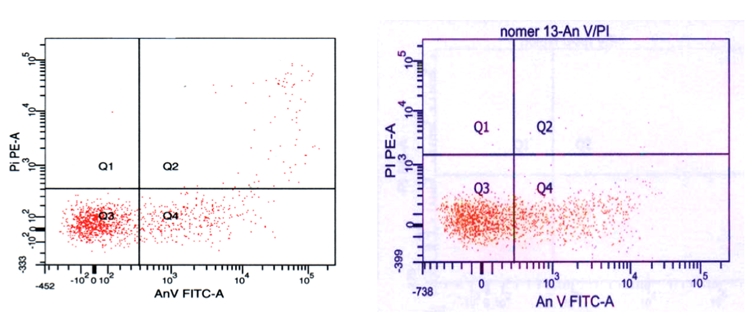
Рис. 1 - Оценка уровня апоптоза лимфоцитов с помощью двойного окрашивания иодидом пропидия и аннексином V, меченным ФИТЦ (метод лазерной проточной цитофлуориметрии). Картина получена с использованием набора Annexin V-FITC apoptosis Deteсtion Kit I (BD Biosciences, США) на цитофлуориметре FACS Canto, фирмы Becton Dickinson (США)
Таким образом, проведение биохимического исследования синовиальной жидкости и крови больных гонартрозом, получавших различные типы лечения, показало нарушение свободно-радикального гомеостаза и развитие окислительного стресса, выраженного в большей степени в СЖ. Это сопровождалось повышенной продукцией АКМ, накоплением молекулярных продуктов ПОЛ типа МДА на фоне активации ферментативных механизмов образования АКМ, а также дисбаланса и ингибирования компонентов антиоксидантной системы как в СЖ, так и в крови. Интенсификация свободно-радикального окисления и усиление прооксидантных свойств СЖ больных гонартрозом зависели от выраженности патологического процесса, тяжести оперативного вмешательства, и способствовали углублению деструктивно-дистрофических изменений тканей сустава.
Список литературы
Меньщикова Е.Б. и др. Окислительный стресс. Прооксиданты и антиоксиданты. М.: Слово, 2006. 556 c.;
Clouet J., Vinatier C., Merceron C. et al. From osteoarthritis treatments to future regenerative therapies for cartilage // Drug Discovery Today. – 2009. – Vol. 14, No. 19/20. - 913-25;
Henrotin Y.E., Bruckner P., Pujol J.-P. L. The role of reactive oxygen species in homeostasis and degradation of cartilage // Osteoarthritis and Cartilage. – 2003. - Vol. - P. 747–55;
Henrotin Y., Kurz B., Aigner T. Oxygen and reactive oxygen species in cartilage degradation: friends or foes? // Osteoarthritis and Cartilage. - 2005. Vol. 13. - P. 643-54;
Kuhn K., D’Lima D.D., Hashimoto S., Lotz M. Cell death in cartilage // Osteoarthritis and Cartilage. - 2004. - Vol. 12. - P. 1-16;
Шестаков В.А., Бойчевская Н.О., Шерстнев М.П. Хемилюминесценция плазмы крови в присутствии перекиси водорода// Вопросы медицинской химии.- -№ 2. - С. 132-137.
Tsikas D. Methods of quantitative analysis of the nitric oxide metabolites nitrite and nitrate in human biological fluids // Free Radic. Res. – 2005. – Vol. 39. – P. 797-815;
Conti M., Morand P.C., Levillain P., Lemonnier A. Improved fluorimetric determination of malondialdehyde // Clin Chem. – 1991. – Vol. 37. – P. 1273-5;
Саидов М.З., Пинеги Б.В. Спектрофотометрический способ определения активности миелопероксидазы в фагоцитирующих клетках // Лабораторное дело. – 1991. - №3. – С. 56-60.
Длужевская Т. С., Погорелова Т. Н., Афонин А. А. Активность НАДФН-оксидазы в оценке состояния новорожденных детей // Педиатрия. - 1989. - N - С. 44-47.
Сирота Т.В. Новый подход в исследовании процесса аутоокисления адреналина и использование его для измерения активности супероксиддисмутазы // Вопросы медицинской химии. - 1999. - Т. 45, № 3. - С. 263-72;
Королюк М.А., Иванова Л.И., Майорова И.Г., Токарев В.Е. Метод определения активности каталазы. // Лабораторное дело. - 1988. - № 1. - C. 16-9;
Моин В.М. Простой и специфический метод определения активности глутатионпероксидазы в эритроцитах. // Лабораторное дело. - 1986. - № 12. - C. 724 – 7;
Habig W.H., Pabst M.J., Jacoby W.B. Glutathione S-Transferases. The first enzymatic step in mercapturic acid formation // J. Biol. Chem. - 1974. - Vol. 249, No.22. - P. 7130-39;
Ellman G. L. Tissue sulfhydryl groups. // Biochem. Biophys. – 1959. – Vol. 82, No. 1. – P. 70–7
