ОЦЕНКА ВОЗМОЖНОСТИ МЕТОДА ИММУНОХРОМАТОГРАФИИ ДЛЯ ВЫЯВЛЕНИЯ МИКРООРГАНИЗМОВ БИОДЕСТРУКТОРОВ В ЦЕЛЯХ ЗАЩИТЫ ОБЪЕКТОВ ТЕХНИКИ
Ярков С.П.1, Третьяков С.И.2, Башарова Л.А.3, Шаулина Е.К.4
1доктор биологических наук, 2кандидат технических наук, 3кандидат биологических наук, 4младший научный сотрудник
ФГУП «Государственный научно-исследовательский институт биологического приборостроения»
Благодарности. Авторы приносят глубокую благодарность канд. биол. наук О.Б. Пудовой за помощь в проведении работы. Исследование проведено в рамках государственного контракта с ФМБА России от 08 августа 2016 года № 42.143.17.0.
ОЦЕНКА ВОЗМОЖНОСТИ МЕТОДА ИММУНОХРОМАТОГРАФИИ ДЛЯ ВЫЯВЛЕНИЯ МИКРООРГАНИЗМОВ БИОДЕСТРУКТОРОВ В ЦЕЛЯХ ЗАЩИТЫ ОБЪЕКТОВ ТЕХНИКИ
Аннотация
Изучены возможности иммунохроматографических тестов для идентификации микроорганизмов биодеструкторов, способных вызывать повреждения конструкционных материалов и изделий техники. Исследованы влияние примесей неорганической и органической природы и сопутствующей микрофлоры на возможность иммунохроматографического выявления спор бактерий рода Bacillus, плесневых грибов рода Aspergillus в смывах с поверхности конструкционных материалов. Предложена конструкция иммунохроматографического стрип-теста, позволяющего осуществить обнаружение микроорганизмов биодеструкторов в условиях пониженной гравитации. Разработанные приемы иммунохроматографического анализа могут применяться в обитаемых замкнутых объемах (пилотируемых космических аппаратах, подводных лодках, кессонах) с целью уменьшение техногенных рисков и угроз здоровью людей, связанных с повреждением конструкционных материалов, электроники, систем жизнеобеспечения микроорганизмами биодеструкторами.
Ключевые слова: иммунохроматографический анализ, микроорганизмы биодеструкторы, технические средства идентификации.
Yarkov S.P.1, Tretyakov S.I.2, Basharova L.A.3, Shaulina E.K.4
1PhD in Biology, 2PhD in Engineering, 3PhD in Bilology, 4Junior researcher
FSUE State Scientific and Research Institute of Biological Instrumentation
The study was conducted within the state contract with FMBA of Russia of August 08, 2016 No. 42.143.17.0.
EVALUATION OF POSSIBILITY OF IMMUNOCHROMATOGRAPHY METHOD FOR IDENTIFICATION OF DEGRADER MICROORGANISMS FOR PROTECTION OF ENGINEERING OBJECTS
Abstract
The possibilities of immunochromatographic tests for the identification of degrader microorganisms, which are capable of causing damage to structural materials and engineering products have been studied in the paper. The influence of impurities of inorganic and organic nature and concomitant microflora on the possibility of immunochromatographic detection of bacteria spores (genus Bacillus), mold fungi (genus Aspergillus) in the washouts from the surface of structural materials is studied. The construction of an immunochromatographic strip test, which makes it possible to detect degrader microorganisms under the conditions of reduced gravity is proposed. The developed methods of immunochromatographic analysis can be used in habitable closed volumes (manned space vehicles, submarines, caissons) in order to reduce man-caused risks and threats to human health associated with damage to construction materials, electronics, life support systems by microorganisms, biodestructors.
Keywords: immunochromatographic analysis, degrader microorganisms, technical means of identification.
Введение
Длительная эксплуатация изделий техники в условиях замкнутого пространства (обитаемые подводные и космические аппараты) связана с риском повреждения аппаратуры и конструкционных материалов микроскопическими грибами, бактериями, дрожжами. Микроорганизмы не только принимают участие, но и могут играть первостепенную роль в инициировании и развитии коррозийного процесса металлов (бактерии и микромицеты), наиболее активными биодеградантами полимерных материалов являются микроскопические грибы [1, С. 162].
Стремясь создавать и поддерживать в замкнутом объеме адекватную своим потребностям среду обитания, человек неминуемо обеспечивает благоприятные условия для жизнедеятельности микроорганизмов. Многолетний опыт эксплуатации орбитальной станции «Мир» позволил выявить проблемы связанные с биоповреждениями аппаратуры и конструкционных материалов станции, влияющие на надежность техники, комфортность и безопасность обитания экипажа [2, С. 9-19]. Процессы микробной контаминации внутренней среды, оснащения и оборудования обитаемых отсеков протекают с высокой интенсивностью в условиях непрерывной работы сменяющихся экипажей на борту орбитальных комплексов, при осуществлении грузообмена (доставки с Земли приборов и оборудования, расходных материалов, пищевых продуктов и т.п.), использовании ряда систем, обеспечивающих регенерацию и утилизацию продуктов жизнедеятельности человека [3, С. 101].
Особую значимость проблемы биологического повреждения конструкционных материалов микроорганизмами приобретут при реализации перспективных космических программ: создания обитаемой лунной станции, длительного полета космического корабля с людьми к Марсу. Учитывая многолетние сроки эксплуатации космической техники, создаются необходимые предпосылки для реализации механизмов отбора и адаптации микробиоты, развития процессов резидентного заселения среды обитаемого объема различными группами микроорганизмов в качестве своеобразной экологической ниши.
Сказанное выше подтверждает актуальность создания средств обнаружения и идентификации микроорганизмов биодеструкторов, пригодных для работы в замкнутых объемах, в том числе и в условиях пониженной гравитации. Такие средства должны обеспечивать раннее обнаружение микроорганизмов биодеструкторов на поверхностях аппаратуры непосредственно персоналом, работающим в замкнутых обитаемых объемах и не использовать токсичные или коррозионные вещества, которые могут нанести ущерб здоровью экипажа. Иммунохроматография как метод выявления микроорганизмов является довольно эффективным инструментом [4, С. 57-118]. Ранее было предложено использовать иммунохроматографические стрип-тесты (ИСТ) для выявления бактерий рода Bacillus, плесневых грибов рода Aspergillus и дрожжей Candida albicans, известных как микроорганизмы биодеструкторы [5 С. 28-31], [6, С. 413-415], [7, С. 51-58].
В настоящей работе исследованы перекрестные реакции разработанных ИСТ с другими микроорганизмами, сохранность аналитических свойств ИСТ во времени, влияние бытовой пыли и примесей неорганического происхождения на эффективность выявления микроорганизмов биодеструкторов, предложена процедура отбора и последующего анализа жидкой пробы, исключающая образование взвеси частиц жидкости в воздухе в условиях пониженной гравитации.
Материалы и методы эксперимента
Наночастицы коллоидного золота (НКЗ) получали по методу Френса [8, С. 20-22]. Размер НКЗ оценивали спектрофотометрически, как это описано в [9, С. 340]. Получение конъюгатов НКЗ с антителами против антигенов микроорганизмов, используемые при этом материалы и реактивы, а также сборка ИСТ подробно описана нами ранее [7, С. 51-58], [10, С. 1-8],[11, С. 22-26]. Для получения конъюгатов наночастиц коллоидного золота (НКЗ) с антителами использовали поликлональные кроличьи антитела (ПКА) производства фирмы ThermoFisher Scientific (США): к микромицетам рода Aspergillus (кат. № РА 1-7202), к спорам Bacillus (кат. № РА 1-73032).
Для проведения количественных измерений регистрировали интенсивность окрашивания аналитической зоны ИСТ с помощью видеоцифрового анализатора иммунохроматограмм «Рефлеком» (НТЦ «Компонент», Россия).
В качестве поверхностей для искусственной микробной контаминации использовали пластины из гладкого ударопрочного полистирола, окрашенные эмалью металлические поверхности и пластины из алюминия.
Экспериментальные результаты
Типичные иммунохроматограммы микроорганизмов биодеструкторов на примере спор бактерий Bacillus cereus var. anthracoides 250 и плесневых грибов Aspergillum niger, полученные с помощью разработанных ИСТ приведены на рисунке 1.
Изучение перекрестных реакций с проводили путем внесения в ИСТ суспензий гетерологичных микроорганизмов в концентрации 1х108 м.к./мл в буфере для проведения иммунохроматографического анализа (БИхрА), производства ФГУП «ГосНИИБП». Время иммунохроматографии составляло 25 мин, по истечении этого времени регистрировали степень окрашивания аналитической зоны иммунохроматографического теста визуально. Результаты приведены в таблице 1
Рис. 1 – Типичные иммунохроматограммы микроорганизмов. А - Bacillus cereus var.anthracoides 250, концентрация выражена в м.к./мл; В - плесневые грибы Aspergillum niger, исходная концентрация 3.107 КОЕ/мл. Интенсивная полоса вверху ИСТ – контрольная зона, менее интенсивная полоса внизу аналитическая зона. К- «холостой опыт»
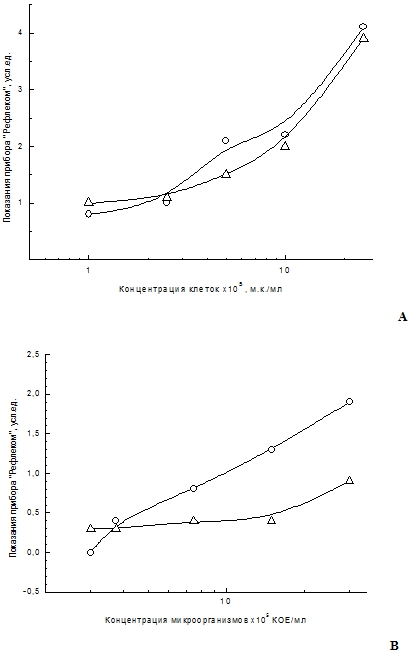
Сохранность аналитических свойств ИСТ во времени приведена на рисунке 2. ИСТ хранились в течение 12,5 месяцев, при температуре окружающей среды 18-250С. Интенсивность окрашивания аналитической зоны ИСТ пропорциональна концентрации микроорганизмов в анализируемой пробе.
Таблица 1 – Результаты перекрестных реакций микроорганизмов биодеструкторов выявляемых с помощью ИСТ
| Наименование микроорганизма | ИСТ для выявления бактерий рода Bacillus | ИСТ для выявления плесневых грибов рода Aspergillus |
| E. coli шт. 9637 | (-) | (-) |
| E. coli шт. М17 | (-) | (-) |
| E. coli шт. JM83 | (-) | (-) |
| E. coli шт. 3/15 | (-) | (-) |
| B. cereus var. anthracoides 250 (4х106 м.к./мл) | (++) | (-) |
| B. cereus 96 | (++) | (-) |
| B.cereus IP 5832 | (++) | (-) |
| Смесь B.subtilis 3 и В. lichenoformis 31 | (++) | (-) |
| B. anthracis СТИ | (++) | (-) |
| P. mirabilis | (-) | (-) |
| Y. enterocolitica | (-) | (-) |
| A. niger (3х106 КОЕ/мл) | (-) | (++) |
| P. chrysogenum (»107 КОЕ/мл) | (-) | (-) |
Примечание: 1. (-) – отрицательный результат; (+) - слабое окрашивание аналитической зоны теста; (++) -интенсивная окраска. 2. Концентрация микроорганизмов 108 м.к./мл, если не указано иное.
Рис. 2 – Графики зависимости окрашивания аналитической зоны ИСТ от концентрации микроорганизмов и времени хранения: (о)- дата измерения 21.09.2016 г, (∆)- измерение спустя 12,5 мес. А) - B.cereus var. anthracoides 250; В) - A.niger. Регистрировали интенсивность окрашивания аналитической зоны иммунохроматографического теста с помощью видеоцифрового анализатора «Рефлеком»
Исследовали возможность возникновения ложноположительных реакций при наличии в анализируемой пробе примесей - веществ, сопровождающую бытовую деятельность человека, например, бытовой пыли, содержащей частички эпителия кожи, кератина волос, волокна одежды и постельных принадлежностей, микрочастицы средств гигиены, а также сопутствующую микрофлору. В качестве примесей использовали экстракт бытовой пыли, отобранной из бумажного фильтра пылесоса циклонного типа. Препарат экстракта бытовой пыли был получен в соотношении по весу 15,4 мг пыли к 1000 мг БИхрА. Были получены отрицательные результаты при взаимодействия ИСТ с экстрактом бытовой пыли и 0,1 мг/мл взвеси порошкообразного карбоната магния (талька) в воде. Интенсивность окрашивания аналитической линии ИСТ при анализе смеси, состоящей из экстракта бытовой пыли и чистой культуры микроорганизмов, статистически не отличалась от результатов анализа чистой культуры.
Для изучения эффективности сбора микроорганизмов с поверхности конструкционных материалов проводили искусственную контаминацию поверхностей суспензией микроорганизмов: B. cereus var. anthacoides 250 и A. niger с известной концентрацией, затем поверхности высушивали при комнатной температуре в течение 12-24ч.
Салфеткой из микрофибры размером 10х10 мм, увлажненной 40 мкл БИхрА протирали 10 см2 искусственно контаминированной поверхности, затем салфетку помещали в пробирку эппендорф с 150 мкл БИхрА и вортексировали 1 мин. Полученный экстракт в количестве 110 мкл вносили в ИСТ, регистрировали результаты анализа спустя 25 мин. За 100% эффективность сбора микроорганизмов с поверхности принимали значения интенсивности окрашивания аналитической зоны при внесении в ИСТ соответствующего объема суспензии исходных контаминирующих микрооорганизмов в БИхрА. В таблице 2 приведены данные об эффективности выявления микроорганизмов биодеструкторов на твердых поверхностях таким методом.
Эффективность сбора вычислялась по формуле : Э = (Ic/Iн)х100% (1)
где: Ic - интенсивность окрашивания аналитической зоны ИСТ после внесения смыва с поверхности; Iн – интенсивность окрашивания аналитической зоны ИСТ исходной контаминирующей суспензией.
Таблица 2 – Эффективность выявления микроорганизмов на искусственно контаминированных поверхностях с помощью ИСТ
| Интенсивность окрашивания аналитической зоны теста | Материал поверхности | ||
| Пластик | Алюминий | Окрашенная эмалью металлическая поверхность | |
| B. cereus var. anthacoides 250, плотность контаминации 4,1х106 м.к./см2 | |||
| Ic | 2,83 | 2,23 | 2,57 |
| Iн | 2,80 | 2,80 | 2,80 |
| Э, % | 101,7 | 79,6 | 92,0 |
| A. niger , плотность контаминации 8,5х106 КОЕ/см2 | |||
| Ic | 0,57 | 0,53 | 0,53 |
| Iн | 0,77 | 0,77 | 0,77 |
| Э, % | 74,0 | 68,8 | 68,8 |
Обсуждение результатов
Построение иммунохроматографических тестов с высокой специфичностью (на уровне штамма или вида) по отношению к микроорганизмам биодеструкторам нецелесообразно, ввиду низкой вероятности обнаружения конкретного микроорганизма в окружающей среде. Ранее была предпринята попытка исследовать возможность идентификации микроорганизмов биодеструкторов на уровне рода, применяя ПКА, специфичные к общим антигенам [7]. Экспериментальные данные, полученные в настоящей работе, показывают, что ИСТ, использующие поликлональные антитела к общим антигенам выявляют споровые формы бацилл и микромицеты рода аспергилл, относящиеся к микроорганизмам биодеструкторам, что подтверждает полученные ранее результаты.
Как следует из данных таблицы 1 ИСТ специфичны по отношению к сопутствующей микрофлоре при 20-100 кратном избытке последней по отношению к порогу детекции искомого микроорганизма.
Чувствительность выявления микроорганизмов B. cereus var. anthacoides 250 составила 1х105 м.к./мл, а микромицетов A. niger 1х106 КОЕ/мл. Как следует из данных рисунка 1А за время хранения аналитический отклик ИСТ для выявления бацилл практически не изменился, аналитический отклик ИСТ для выявления микромицетов снизился на 50% для концентрации A. niger 1х106 КОЕ/мл. Сохранность свойств ИСТ в упаковке при температуре 18-250С составляет как минимум 12,5 месяца (время наблюдения).
Изучение эффективности смывов микроорганизмов и последующего выявления их с помощью иммунохроматографии показало, что споры бацилл более легко удаляются с поверхностей алюминия, окрашенных металлов и пластика, по сравнению с колониями микромицетов. Наиболее эффективно происходит удаление микроорганизмов с поверхности пластика. Метод иммунохроматографии позволяет выявлять споровые формы бактерий и плесневые грибы на конструкционных поверхностях в таких условиях, когда колонии микроорганизмов невооруженным глазом не видны.
Преимущества иммунохроматографии для выявления микроорганизмов на поверхностях объектов техники в условиях пониженной гравитации еще более очевидны. Известно, что при пониженной гравитации капли жидкости принимают сферическую форму и способны легко увлекаться током воздуха. Важным фактором безопасности экипажа является избежание образования при проведении анализа микрокапель жидкостей содержащих реагенты, например БИхрА, суспензии микроорганизмов, которые могут попасть в дыхательные пути человека. Нами предложена процедура проведения анализа, включающая сбор анализируемой пробы с контаминированной поверхности увлажненной БИхрА салфеткой из микрофибры, хранящейся в фольгированном герметичном пакете, экстракцию пробы в БИхрА с помощью специального приспособления. Последующий анализ проводится с помощью модифицированной конструкции ИСТ, когда собранная жидкая проба вводится короткой тупой иглой медицинского шприца в подложку для образца изготовленную из пористой целлюлозы, которая прилегает непосредственно к подложке с высушенным конъюгатом наночастиц коллоидного золота и имеет выход в торцевую часть корпуса индикаторного элемента (рисунок 3). Такая схема практически исключает контакт оператора с микроорганизмами, БИхрА, реагентами ИСТ и образования взвесей капель жидкости в условиях пониженной гравитации.
Анализ с помощью ИСТ имеет ряд преимуществ по сравнению с другими методами индикации и идентификации микроорганизмов, таких как культуральные методы, метод флуоресцирующих антител, твердофазный иммуноферментный анализ, полимеразная цепная реакция.
Эти преимущества заключаются в одностадийном анализе, исключающем применение процедур многократного диспенсирования реагентов, промывок, регистрирующей аппаратуры, соблюдение температурного режима хранения жидких и твердых реактивов. Типичное время иммунохроматографии микроорганизмов не превышает 25-30 мин.
Рисунок 3 – ИСТ для выявления микроорганизмов биодеструкторов в условиях пониженной гравитации. 1-корпус ИСТ, 2- впитывающая мембрана, 3 - аналитическая мембрана; 4 - мембрана с конъгатом НКЗ и антителами; 5 – мембрана для нанесения анализируемого жидкого образца
Токсичные реагенты при проведении иммунохроматографического анализа не используются и не образуются, также, как и не содержатся в составе ИСТ. Сбор и подготовка пробы к анализу заключается в переносе микроорганизмов с поверхности в буфер для проведения иммунохроматографического анализа и нанесении пробы на ИСТ. Простота операций при анализе делает его доступным для оператора с минимальным уровнем подготовки. Сказанное выше делает иммунохроматографию микроорганизмов привлекательным методом для контроля обсемененности поверхностей объектов техники в обитаемых замкнутых объемах, таких как орбитальные станции, подводные аппараты.
Список литературы / References
- Varfolomeev S. V. Biotechnology in Medicine Foodstaffs, Biocatalysis, Environment and Biotechnology./ S. V. Varfolomeev - New York: Nova Science Publishers, 2010 - 162 P.
- Алехова Т. А. Микроскопические грибы на Российском сегменте международной космической станции / Т. А. Алехова, А. В. Александрова, Н. А. Загустина и др. // Микология и фитопатология. - 2009. - Т 43. - № 5. - С. 9 -19.
- Новикова Н. Д. Микробное сообщество среды обитания пилотируемых орбитальных комплексов: проблемы, методы контроля и коррекции. Дисс. ...докт. биол. наук: 14.00.32. Новикова Наталья Дмитриевна.- М., С. 2002. - 215.
- Ярков С. П. Применение иммунохроматографии для выявления патогенов и диагностики заболеваний. Современные методы индикации патогенов и токсинов в объектах окружающей среды и диагностики социально - значимых инфекционных заболеваний для обеспечения химической и биологической безопасности / С. П. Ярков, И. В. Шиленко; под ред. В. Н. Злобина, - М.: ООО «Баллада РПК», 2010. – С. 57-118. ISBN 978-5-9902452-1-1
- Скопинская С. Н. Разработка иммунохроматографического теста для быстрого обнаружения грибов рода Аspergillus / Скопинская С. Н., Курбатова И. В. // Успехи медицинской микологии: материалы VI Всероссийского конгресса по медицинской микологии под ред. Сергеева Ю. В./ Национальная Академия Микологии – Москва, 2014. Т. XIII. С. 28-31. ISBN 978-5-901578-17-9.
- Башарова Л. А. Разработка иммунохроматографических тестов для выявления микроскопических грибов биодеструкторов в обитаемых гермозамкнутых объемах / Башарова Л. А., Третьяков С. И., Ярков С. П. // Современная микология в России: материалы четвертого съезда микологов России под ред. Ю.Т. Дьякова и Ю.В. Сергеева/ Национальная Академия Микологии – Москва, 2017. - Т. 6. - С. 413-415. ISBN 978-5-901578-26-1. DOI: 10/14427/cmr.2017.vi.11
- Ярков С.П. Исследование возможности иммунохроматографической индикации микроорганизмов биодеструкторов/ С.П. Ярков, С.И. Третьяков, Л.А. Башарова и др.// Медицина экстремальных ситуаций.- 2017.-№3.-С. 51-58.
- 8. Frens G. Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions ./ G Frens // Nature Phys. Sci. - 1973. - Vol. 241. - № 1. - P. 20-22.
- Дыкман Л.А. Золотые наночастицы: синтез, свойства, биомедицинское применение/ Л.А. Дыкман, В.А. Богатырев, С.Ю. Щеголев и др. // Институт биохимии и физиологии растений и микроорганизмов РАН. М. Наука. – 2008. - С. 319 ISBN 978-5-02-035892-8
- Титов А.А. Разработка и оптимизация иммунохроматографических тестов для выявления ботулинических токсинов/ А.А. Титов, И.В. Шиленко, С.П. Ярков и др.// Прикладная биохимия и микробиология. - 2012. - Т. 48 -№2. - С. 1-8.
- Ярков С.П. Индикация возбудителей особо опасных заболеваний с помощью иммунохроматографии и видеоцифрового анализа/ С.П. Ярков, С.И. Третьяков, Л.А. Башарова и др.// Вестник РАМН – 2007. - №12. – С.22-26.
Список литературы на английском языке/ References in English
- Varfolomeev S.V. Biotechnology in Medicine Foodstaffs, Biocatalysis, Environment and Biotechnology. / S. V. Varfolomeev - New York: Nova Science Publishers, 2010 - 162 P.
- Alehova T. A. Mikroskopicheskie griby na Rossijskom segmente mezhdunarodnoj kosmicheskoj stancii [Microscopic fungi on the Russian segment of the international space station] / T. A. Alehova, A. V. Aleksandrova, N. A. Zagustina and others. // Mikologija i fitopatologija [Mycology and phitopathology]. - 2009. - T 43. - № 5. - P. 9-19. [in Russian]
- Novikova N. D. Mikrobnoe soobshhestvo sredy obitanija pilotiruemyh orbital'nyh kompleksov: problemy, metody kontrolja i korrekcii [Microbial community of habitat of manned orbital complexes: problems, methods of control and correction]: diss. ... doctor of Biological Sciences: 14.00.32/ Novikova Natal'ja Dmitrievna.- M., 2002. Р. – 215. [in Russian]
- Jarkov S. P. Primenenie immunohromatografii dlja vyjavlenija patogenov i diagnostiki zabolevanij. Sovremennye metody indikacii patogenov i toksinov v ob#ektah okruzhajushhej sredy i diagnostiki social'no-znachimyh infekcionnyh zabolevanij dlja obespechenija himicheskoj i biologicheskoj bezopasnosti [The use of immunochromatography for the detection of pathogens and diagnosis of diseases. Modern methods of indicating pathogens and toxins in environmental objects and diagnosing socially significant infectious diseases to ensure chemical and biological safety] / S. P. Jarkov, I. V. Shilenko; edited by. V. N. Zlobina, - M.: OOO «Ballada RPK», 2010. - Р. 57-118. [in Russian]
- Skopinskaja S. N. Razrabotka immunohromatograficheskogo testa dlja bystrogo obnaruzhenija gribov roda Aspergillus [Development of an immunochromatographic test for rapid detection of fungi of the genus Aspergillus] / Skopinskaja S. N., Kurbatova I. V. // Uspehi medicinskoj mikologii: materialy VI Vserossijskogo kongressa po medicinskoj mikologii pod red. Sergeeva Ju. V. / Nacional'naja Akademija Mikologii [The successes of medical mycology: the materials of the 6th All-Russian Congress on Medical Mycology, ed. Sergeev Yu. V. / National Academy of Mycology] – Moskva, 2014 . T. XIII. Р. 28-31. [in Russian]
- Basharova L. A. Razrabotka immunohromatograficheskih testov dlja vyjavlenija mikroskopicheskih gribov biodestruktorov v obitaemyh germozamknutyh ob#emah [Development of immunochromatographic tests for the detection of microscopic fungi of biodestructors in inhabited hermoclimatic cells]/ Basharova L. A., Tret'jakov S. I., Jarkov S. P.// Sovremennaja mikologija v Rossii: materialy chetvertogo s#ezda mikologov Rossii [Recent modern mycology in Russia: materials of the fourth edition of the Russian Mycology] edited by Ju.T. D'jakova i Ju.V. Sergeeva/ Nacional'naja Akademija Mikologii [National Academy of Mycology] – Moskva, 2017. - T. 6. - P. 413-415. [in Russian]
- Jarkov S.P. Issledovanie vozmozhnosti immunohromatograficheskoj indikacii mikroorganizmov biodestruktorov [Investigation of the possibility of immunochromatographic indication of microorganisms biodestructors]/ S.P. Jarkov, S.I. Tret'jakov, L.A. Basharova and other.// Medicina jekstremal'nyh situacij [Medicine of extreme situations]. - 2017. -№3. -P. 51-58.
- Frens G. Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions ./ G Frens // Nature Phys. Sci. - 1973. - Vol. 241.- № 1. - P. 20-22.
- Dykman L.A. Zolotye nanochasticy: sintez, svojstva, biomedicinskoe primenenie [Gold nanoparticles: synthesis, properties, biomedical applications] / L.A. Dykman, V.A. Bogatyrev, S.Ju. Shhegolev and other.// Institut biohimii i fiziologii rastenij i mikroorganizmov RAN [Institute of Biochemistry and Physiology of Plants and Microorganisms, Russian Academy of Sciences]. M. Nauka. – 2008.- P. 319 [in Russian]
- Titov A. A. Razrabotka i optimizacija immunohromatograficheskih testov dlja vyjavlenija botulinicheskih toksinov [Development and optimization of immunochromatographic tests for the detection of botulinum toxins ]/ A.A. Titov, I.V. Shilenko, S.P. Jarkov and other.// Prikladnaja biohimija i mikrobiologija [Applied Biochemistry and Microbiology]. - 2012. - T. 48 -№2. - P. 1-8. [in Russian]
- Jarkov S.P. Indikacija vozbuditelej osobo opasnyh zabolevanij s pomoshh'ju immunohromatografii i videocifrovogo analiza [Indication of pathogens of especially dangerous diseases with the help of immunochromatography and video-digital analysis] / S. P. Jarkov, S. I. Tret'jakov, L.A. Basharova and other.// Vestnik RAMN[Bulletin of the Russian Academy of Medical Sciences] – 2007. - №12. – P.22-26. [in Russian]