ОЦЕНКА УСТОЙЧИВОСТИ АНТИБИОТИКОВ РАЗЛИЧНЫХ ГРУПП В ВОДНОЙ СРЕДЕ МЕТОДОМ БИОТЕСТИРОВАНИЯ
ОЦЕНКА УСТОЙЧИВОСТИ АНТИБИОТИКОВ РАЗЛИЧНЫХ ГРУПП В ВОДНОЙ СРЕДЕ МЕТОДОМ БИОТЕСТИРОВАНИЯ
Научная статья
Чеснокова С.М.1, Савельев О.В.2, *
1 ORCID: 0000-0001-5126-1786;
2 ORCID: 0000-0002-3425-8021;
1, 2 Владимирский государственный университет имени А. Г. и Н. Г. Столетовых” (ВлГУ); Владимир, Россия
* Корреспондирующий автор (olegator86[at]bk.ru)
АннотацияВ статье приведены экспериментальные данные, показывающие возможность использования метода биотестирования с применением в качестве тест-организмов черенков и проростков высших растений для косвенной оценки устойчивости антибиотиков окситетрациклина, тилозина и цефтриаксона в водной среде. В экспериментах применялась отстоянная в течение 10 дней водопроводная вода, для подготовки которой было использовано хлорирование. В качестве тест-организмов были выбраны черенки элодеи канадской, семена редиса красного с белым кончиком и маша (фасоль золотистая), а в качестве тест-параметров длина корня и побега проростков и масса черенков элодеи канадской. Растворы антибиотиков для биотестирования предварительно хранились в темных стеклянных бутылках в течение 0,2, 14, 28, 42 суток при комнатной температуре, затем использовались в опытах. Из выбранных тест-организмов наиболее чувствительным к исследуемым антибиотикам оказался редис красный с белым кончиком, а из тест-параметров – длина корня. По устойчивости в исследуемой воде выбранные антибиотики расположились в ряд: тилозин – цефтриаксон – окситетрациклин. С увеличением продолжительности экспозиции у всех антибиотиков происходил рост токсических эффектов, что свидетельствует об образовании более токсичных продуктов их трансформации.
Ключевые слова: антибиотики, биотестирование, отстоянная водопроводная вода, устойчивость в водной среде.
ASSESSING THE ANTIBIOTIC RESISTANCE OF VARIOUS GROUPS IN WATER ENVIRONMENT THROUGH BIOTESTING
Research article
Chesnokova S.M.1, Savelev O.V.2, *
1 ORCID: 0000-0001-5126-1786;
2 ORCID: 0000-0002-3425-8021;
1, 2 Vladimir State University named after Alexander and Nikolay Stoletovs; Vladimir, Russia
* Corresponding author (olegator86[at]bk.ru)
AbstractThe article presents experimental data demonstrating the possibility of biotesting method application using the cuttings and seedlings of land plants as test organisms for the indirect assessment of the antibiotics oxytetracycline, tylosin and ceftriaxone resistance in the water environment. In the experiments, we used tap water settled for ten days and chlorinated. For test organisms, we selected cuttings of Canadian waterweed, seeds of red radish having a white tip and of the mung bean (maash), and as the test parameters, we chose the length of the root and the scions and the weight of the cuttings of Canadian waterweed. Antibiotics solution for biotesting were first stored in dark glass bottles for 0.2, 14, 28, 42 days at room temperature, then used for the experiments.
Of the selected test organisms, the red radish with a white tip was the most sensitive to the studied antibiotics, and of the test parameters, the most sensitive was the root length. According to the resistance in the studied water, the selected antibiotics were arranged as follows: tylosin – ceftriaxone – oxytetracycline. With increasing exposure time, all antibiotics had an increase in toxic effects; this indicates the formation of more toxic products of their transformation.
Keywords: antibiotics, biotesting, settled tap water, resistance in the water environment.
ВведениеБесконтрольное использование антибиотиков населением при самолечении, в животноводстве, свиноводстве, птицеводстве и аквакультуре для лечения инфекционных заболеваний и повышения продуктивности животных и птиц привело к массовому загрязнению этими веществами поверхностных вод, почв, пищевых продуктов растительного и животного происхождения и распространению антибиотикорезистентных патогенных микроорганизмов [1], [4], [5]. Устойчивость к антибиотикам патогенных микроорганизмов приводит к снижению эффективности лечения антибиотиками опасных инфекционных заболеваний человека и животных и к значительным экономическим потерям [6], [7].
Антибиотики опасны для гидробионтов всех уровней организации, они могут накапливаться в компонентах гидроэкосистем и передаваться по трофическим цепям [1], [3]. Источниками загрязнения поверхностных вод этими поллютантами являются неочищенные сточные воды госпиталей, больничных комплексов, фармацевтических заводов, животноводческих комплексов, свиноферм, птицефабрик, коммунального хозяйства, ливневые стоки с полей, где используются в качестве органических удобрений навоз и осадки сточных вод сооружений биологической очистки, а также аквакультура [1].
Исходя из этого, становится актуальной проблема оценки устойчивости антибиотиков, наиболее часто применяемых в медицине и животноводстве, в водной среде.
Цель данной работы – оценка устойчивости антибиотиков различных групп в водной среде методом фитотестирования.
Фитотестирование в настоящее время широко используется в экологическом мониторинге для оценки токсичности природных и сточных вод, а также биологической активности различных соединений [8], [9]. Фитотесты, по сравнению с животными организмами, являются более доступным и дешевым материалом, не требуют специальных условий содержания. Методы фитотестирования при минимальных издержках позволяют увеличивать количество анализов и соответственно повысить точность экологических прогнозов. Показано применение метода фитотестирования с использованием в качестве тест-системы семян пшеницы сорта «Немарис» (Triticum aestrivum), гороха сорта «Насыпающийся-1» (Pisum satirum L.) и лука-шалота (Allium ascalonicum) для оценки токсичности и мутагенной активности загрязненных вод из различных источников [10]. Биотестирование с использованием проростков редиса красного с белым кончиком в качестве тест-системы применили для оценки загрязненности атмосферного воздуха в зимний период по фитотоксичности талых снеговых вод [11]. При исследовании токсического действия различных соединений селена на живые организмы в качестве тест-культур были использованы ячмень сорта «Сонет» (Hordeum vulgare) и маш (золотистая фасоль (Vigna radiata). Токсичность препаратов оценивали по снижению длины корней и колеоптиля проростков семян [12]. Биологические эффекты стероидного гормона (24-эпибрассинолина) в зависимости от его концентрации в водных растворах изучались с использованием в качестве тест-систем семян редиса (Raphanus sativus), маша (золотистая фасоль (Vigna radiata) и ячменя сорта «Раушан» (Hordeum vulgare). В качестве тест-параметров были использованы длина корня и колеоптиля. При этом наиболее чувствительной тест-культурой оказался редис [13].
Ранее нами показано возможность использования фитотестирования для оценки биологических эффектов антибиотиков тилозина и ампициллина в водной среде [14].
В результате анализа методик фитотестирования объектов окружающей среды и различных биологически активных веществ, приведенных в [9], [11], [14] и других источниках, для косвенной оценки устойчивости антибиотиков в водной среде нами выбрана методика определение токсичности антибиотиков с использованием в качестве тест-системы проростков семян редиса красного с белым кончиком, маша (золотистая фасоль) и черенков элодей канадской (Elodea canadensis), а в качестве тест-параметров – длину корешков и побегов проростка и массу черенков элодеи канадской.
В настоящее время сведения об устойчивости антибиотиков в объектах окружающей среды немногочислены и противоречивы. Изучены процессы деструкции тетрациклинов и антибиотиков группы макролидов микрофлорой сооружений биологической очистки сточных вод [15], [16]. Показано, что в процессе биологической очистки содержание макролидов снизилось на 90%, а хлортетрациклина – на 75%. При исследовании биодеструкции цефтриаксона микроорганизмами активного ила установлено, что при биологической очистке возможно происходит процесс изомеризации – трансформации Z-изомера антибиотика в менее активную форму (E-изомер) [17]. По данным [18] в природных средах менее устойчивы антибиотики пенициллиновой группы, более устойчивы макролиды и тетрациклины. Показано, что деградация антибиотиков многих групп в природных водах ускоряют УФ-лучи [19]. По данным [20] наиболее чувствительны к УФ-излучению в природных водах тетрациклины, хинолоны и сульфонамиды. В настоящее время предполагают, что активную роль в деградации антибиотиков в гидроэкосистемах играют бактерии и грибы. При этом образующиеся в процессе трансформации антибиотиков метаболиты могут быть более токсичны и устойчивы, чем исходные соединения [21].
Объекты и методы исследования
В работе применялись растворы окситетрациклина, тилозина и цефтриаксона, приготовленные на отстоянной в течении десяти дней водопроводной воде Нерлинского водозабора г. Владимир. Основные катионы и анионы в использованной воде определяли с помощью системы капиллярного электрофореза «Капель-104Т». Содержание в воде растворенного кислорода, гидрокарбонат-ионов и перманганатную окисляемость определяли общепринятыми методами. Установлено, что содержание основных компонентов в воде не превышает ПДК для питьевой воды, жесткость воды составляет 3,4 мг-экв/дм3, содержание растворенного кислорода – 6,8 мгО/дм3, перманганатная окисляемость – 3,8 мгО/дм3, содержание гидрокарбонат-ионов – 204,4 мг/дм3.
Окситетрациклин – антибиотик тетрациклиновой группы, широко используемый в медицине и в животноводстве, а также в пищевой промышленности в качестве консерванта. Обладает высокой противомикробной активностью. Совместно с другими антибиотиками тетрациклиновой группы наиболее часто встречается в поверхностных водах, почвах, продуктах питания [22].
Цефтриаксон – бактерицидный антибиотик из группы цефалоспоринов. Он угнетает синтез клеточных мембран, применяется в медицине для лечения инфекций центральной нервной системы и желудочно-кишечного тракта [23].
Тилозин – антибиотик группы макролидов, продуцируется Streptomyces fradiae, применяется широко в животноводстве для лечения и профилактики инфекционных заболеваний. Тилозин оказывает бактериостатическое действие, подавляя синтез белка в бактериальных клетках [23].
Токсичность антибиотиков для тест-организмов оценивали по величине токсического эффекта на выбранные тест-параметры (длина корня и побега проростков или массу черенков):
Для исследований брали черенки аквариумной культуры элодеи канадской массой 1,00±0,01 г и культивировали в растворах антибиотиков различной концентрации в стеклянных сосудах на свету при комнатной температуре в течение 21 и 35 дней.
При фитотестировании с семенами редиса красного и маша использовали растворы антибиотиков различной концентрации, которые выдерживали в темноте в стеклянных банках различные сроки (от 0,2 до 42 суток). Биотестирование проводили в чашках Петри. В них на фильтровальную бумагу помещали по 20 семян тест-культуры, обрабатывали 10 мл раствора антибиотика соответствующей концентрации и выдерживали в термостате при температуре 260С в течение 96 часов. Все анализы проводили в 3-х повторностях.
Результаты и их обсуждение
Из представленных в таблице 1 данных следует, что эффекты воздействия окситетрациклина на черенки элодей канадской зависели как от концентрации антибиотика в растворе, так и от продолжительности культивирования. При культивировании в течение 21 суток в сосудах с концентрацией антибиотика 20, 40 и 60 мг/дм3 наблюдались незначительные эффекты стимуляции роста массы черенков. Далее с увеличением концентрации окситетрациклина происходило уменьшение массы черенков из-за подавления процессов фотосинтеза, что выразилось в снижении интенсивности зеленой окраски листьев. При содержании антибиотика в сосудах в интервале концентраций 150-300 мг/дм3 растворы приобретали бурую окраску, интенсивность которой возрастала с увеличением концентрации и продолжительности культивирования. Изменение окраски растворов окситетрациклина от слабо-желтой до бурой связано с трансформацией его молекул под действием света. При культивировании черенков в течение 35 суток происходило более быстрое снижение массы черенков и увеличение токсического эффекта с ростом концентрации антибиотика в растворах. Окраска растров изменилась от светло-бурой до темно-бурой.
Таблица 1 – Масса черенков элодей канадской при различной продолжительности культивирования в растворах окситетрациклина различной концентрации
| Концентрация, мг/дм3 | Продолжительность культивирования | |||||
| 21 сутки | 35 суток | |||||
| масса, г | % отн. контроля | ТЭ, % | масса, г | % отн. контроля | ТЭ, % | |
| контроль | 1,13 | 100,00 | 0,00 | 1,27 | 100,00 | 0,00 |
| 20 | 1,21 | 106,60 | -7,08 | 1,20 | 94,90 | 5,52 |
| 40 | 1,15 | 101,80 | -1,77 | 1,21 | 95,20 | 4,72 |
| 60 | 1,17 | 103,54 | -3,57 | 1,10 | 87,00 | 13,39 |
| 80 | 1,12 | 99,10 | 0,88 | 1,04 | 82,20 | 18,11 |
| 100 | 1,03 | 91,20 | 8,85 | 1,02 | 80,60 | 19,68 |
| 150 | 0,98 | 86,70 | 13,27 | 0,94 | 74,01 | 25,98 |
| 200 | 0,94 | 83,60 | 16,81 | 0,72 | 56,69 | 43,31 |
| 300 | 0,82 | 72,56 | 27,43 | 0,60 | 47,24 | 52,76 |
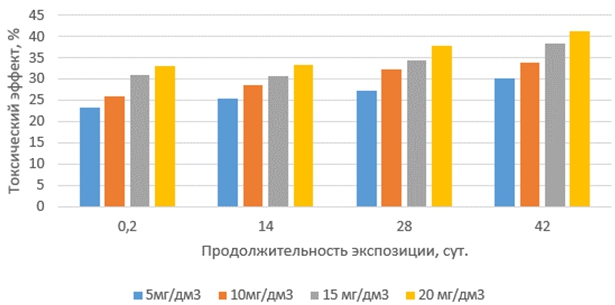
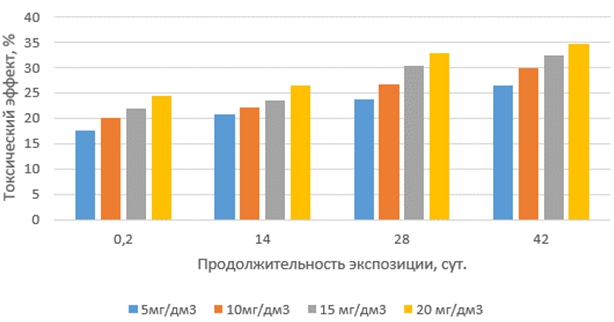
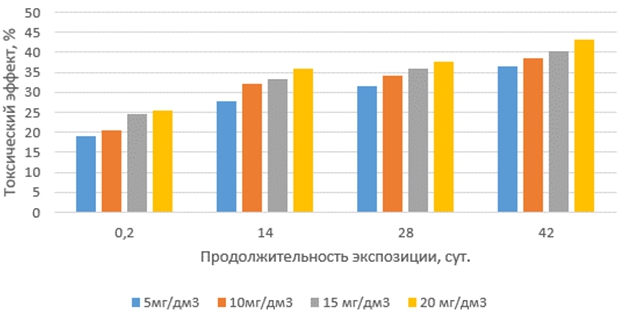
Токсические эффекты окситетрациклина на корни проростков редиса красного с белым кончиком по сравнению с другими антибиотиками проявляются наиболее сильно в растворах с минимальной продолжительностью экспозиции и далее слабо возрастают как с увеличением концентрации антибиотика, так и с ростом продолжительности экспозиции растворов (рис. 1).
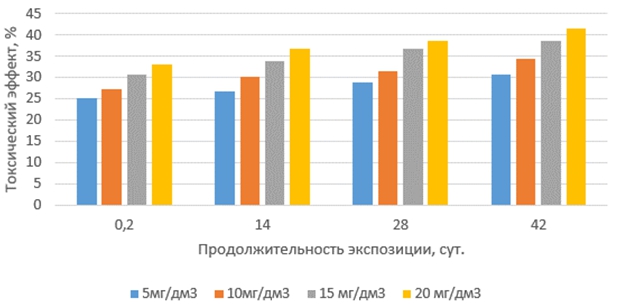
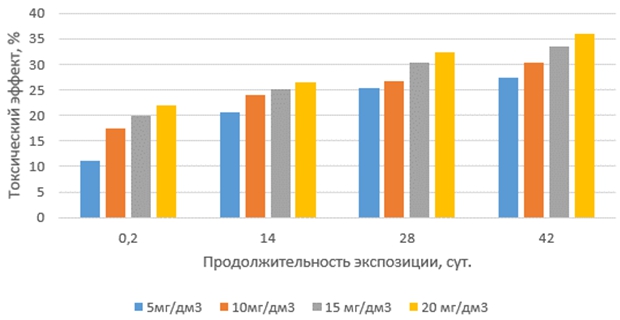
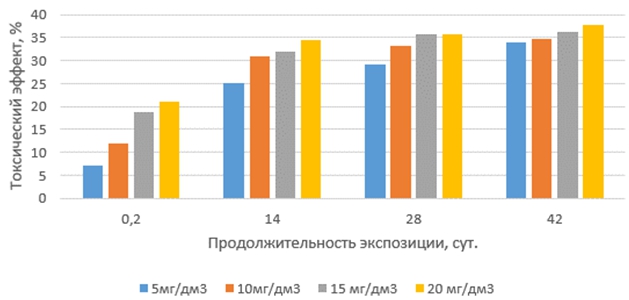
Токсические эффекты окситетрациклина на корни проростков маша (рис. 2), в интервале сроков экспозиции 14, 28 и 42 суток, незначительно выше, чем на корни проростков редиса. Однако, закономерности воздействия окситетрациклина на корни проростков маша и редиса в зависимости от концентрации и продолжительности экспозиции растворов антибиотика идентичны.
Рис. 1 – Токсические эффекты окситетрациклина на корни редиса при различных концентрациях и продолжительности экспозиции антибиотика в водной среде
Рис. 2 – Токсические эффекты окситетрациклина на корни маша при различных концентрациях и продолжительности экспозиции антибиотика в водной среде
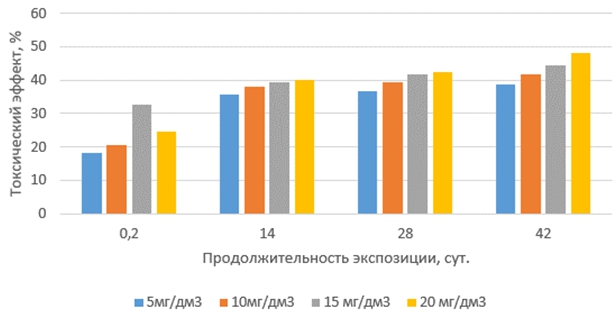
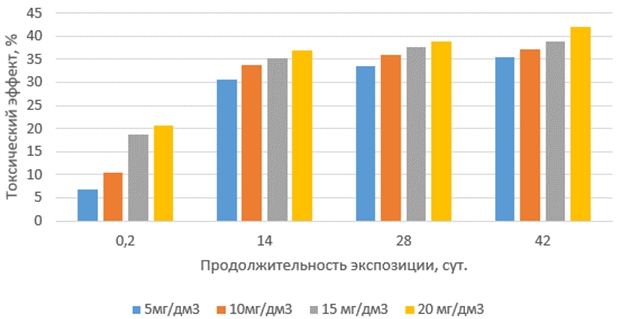
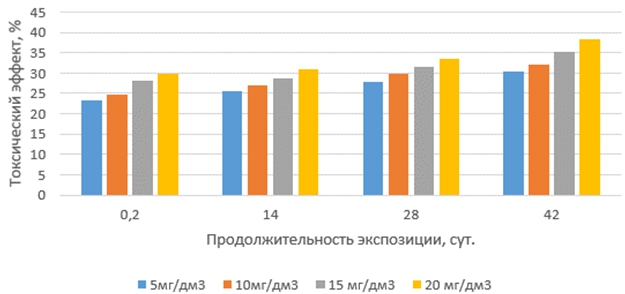
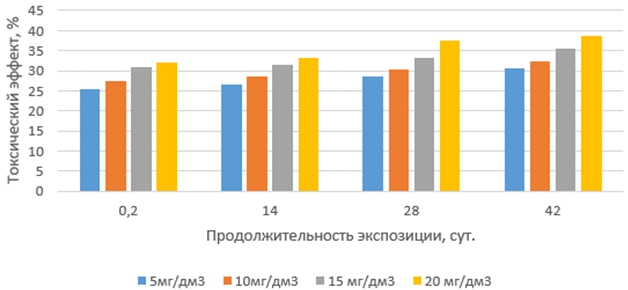
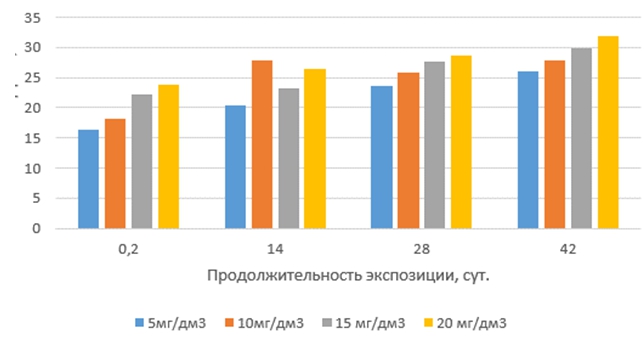
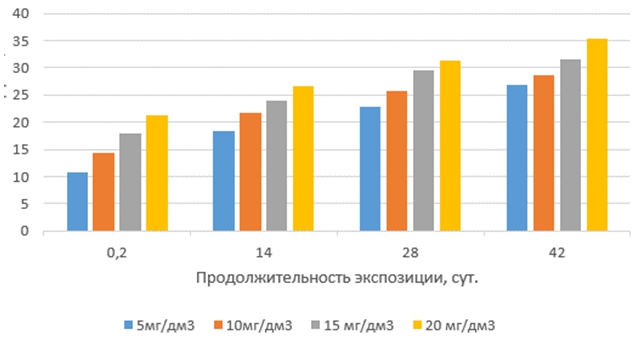
Токсические эффекты тилозина на корни проростков выбранных тест-организмов с увеличением продолжительности экспозиции растворов антибиотиков и их концентрации изменялись неравномерно (рис.3 и 4). Наиболее слабо они проявлялись в свежеприготовленных растворах (экспозиция 0,2 суток). Наибольший рост токсических эффектов был обнаружен в растворах с продолжительностью экспозиции 14 суток, далее они увеличивались плавно и незначительно. Наиболее чувствительными к тилозину оказались корни проростков редиса красного с белым кончиком.
Рис. 3 – Токсические эффекты тилозина на корни редиса при различных концентрациях и продолжительности экспозиции антибиотика в водной среде
Рис. 4 – Токсические эффекты тилозина на корни маша при различных концентрациях и продолжительности экспозиции антибиотика в водной среде
Цефтриаксон оказывал меньшие токсические эффекты на корни проростков редиса и маша по сравнению с тетрациклином и тилозином (рис.5 и 6). Более чувствительным тест-параметром для цефтриаксона оказались корни редиса красного с белым кончиком.
При минимальной продолжительности экспозиции растворов антибиотиков (0,2 суток) наиболее токсичным для корней и побегов редиса оказался окситетрациклин, а наименее токсичным – тилозин (рис.7-12). При сроках экспозиции растворов антибиотиков 14, 28 и 42 сутки по величине токсических эффектов на корни и побеги проростков редиса и маша исследованные антибиотики образовали ряд: тилозин – окситетрациклин – цефтриаксон. Исходя из рисунков 1-6 можно предположить, что токсические метаболиты тилозина образуются лишь после первых двух недель экспозиции растворов антибиотика, а процессы трансформации окситетрациклина и цефтриаксона даже в темноте начинались уже с первых часов после попадания в воду. Таким образом по устойчивости в водной среде, не содержащей микробиоценоза активного ила и гидроэкосистем (грибы, водоросли и бактерии), исследованные антибиотики расположились в ряд: тилозин – цефтриаксон – окситетрациклин. Окситетрациклин более устойчив в темноте, видимо, трансформацию его молекул ускоряют УФ-лучи. Обнаружено, что с увеличением продолжительности экспозиции у всех антибиотиков наблюдался заметный рост токсических эффектов, что свидетельствует об образовании в среде более токсичных метаболитов.
Рис. 5 – Токсические эффекты цефтриаксона на корни редиса при различных концентрациях и продолжительности экспозиции антибиотика в водной среде
Рис. 6 – Токсические эффекты цефтриаксона на корни маша при различных концентрациях и продолжительности экспозиции антибиотика в водной среде
Рис. 7 – Токсические эффекты окситетрациклина на побеги редиса при различных концентрациях и продолжительности экспозиции антибиотика в водной среде
Рис. 8 – Токсические эффекты окситетрациклина на побеги маша при различных концентрациях и продолжительности экспозиции антибиотика в водной среде
Рис. 9 – Токсические эффекты тилозина на побеги редиса при различных концентрациях и продолжительности экспозиции антибиотика в водной среде
Рис. 10 – Токсические эффекты тилозина на побеги маша при различных концентрациях и продолжительности экспозиции антибиотика в водной среде
Рис. 11 – Токсические эффекты цефтриаксона на побеги редиса при различных концентрациях и продолжительности экспозиции антибиотика в водной среде
Рис. 12 – Токсические эффекты цефтриаксона на побеги маша при различных концентрациях и продолжительности экспозиции антибиотика в водной среде
Выводы
В результате проведенных исследований нами установлено:
- методом биотестирования по величине токсических эффектов на проростки высших растений можно косвенно оценить устойчивость антибиотиков различных групп в водной среде при их высоких содержаниях;
- из использованных тест-организмов наиболее чувствительным к исследованным антибиотикам оказались проростки редиса красного с белым кончиком, а из тест-параметров – длина корней. Полученные нами данные хорошо согласуются с результатами других авторов;
- по устойчивости в водной среде, в отсутствии различных представителей гидробиоценоза и солнечной радиации исследованные антибиотики образовали ряд: тилозин – цефтриаксон – окситетрациклин. Окситетрациклин оказался более устойчив в темноте. По-видимому, трансформация его молекул ускоряется под воздействием УФ-излучения.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Баренбойм Г.М. Загрязнение природных вод лекарствами / Г.М. Баренбойм, М.А. . Чиганова М.: Наука, 2015. – 283 с.
- Водяницкий Ю.Н. Яковлев А.С. Загрязнение почв и почвенно-грунтовых вод новыми органическими микрополлютантами (обзор) / Ю.Н. Водяницкий, А.С. Яковлев // Почвоведение. – 2016. – №5. – С. 609-619.
- Терехова В.А. Распространение и биологические эффекты антибиотиков в водных экосистемах (обзор) / В.А. Терехова, И.И. Руднева, А.А. Поромов, А.И. Парамонова, К.А. Кыдралиева // Вода: химия и экология. – 2019. – № 3-6(119) –C. 92-112.
- Антибиотикорезистентность условно-патогенных микроорганизмов поверхностных водоемов г. Ростова-на-Дону. Евразийский союз ученых. –2015. – 5(14). – С. 10-13.
- Hui Gao Complex migration of antibiotic resistance in natural aquatic environments / Hui Gao, Linxiao Zhang, Zihao Lu, Chunming He, Qianwei Li, Guangshui Na. // Environmental Pollution. 2018. Vol. 232. p. 1-9.
- Брико Н.И., Покровский В.И. Экологические и медицинские проблемы биологической безопасности / Брико Н.И., В.И. Покровский // Биозащита и биобезопасность. – 2010. – №1(2). – С. 10-20.
- Брико Н.И. Инфекционные болезни в эпоху глобализации / Н.И. Брико // Медицинские новости. – 2014. – №12 (243). – С. 21-23.
- Садовникова Л.К. Экология и охрана окружающей среды при химическом загрязнении / Л.К. Садовникова, Д.С. Орлов, И.Н. Лозанская. Учеб. пособие. М.: Высшая школа, 2008. – 334 с.
- Мелехова О.П. Биологический контроль окружающей среды: биоиндикация и биотестирование / О.П. Мелехова, Е.И. Сарапульцева, Т.И. Евсеева и др.. М.: Изд. центр «Академия», 2008. – 288 с.
- Цой Р.М. Эффективность различных тест-систем в оценке мутагенной активности загрязненных вод / Р.М. Цой, И.В. Пак // Экология. – 1996. – №3. – С. 194-197.
- Власов Д.В. Биотестирование талых снеговых вод: возможности и ограничения / Д.В. Власов, Д.Л. Голованов, Д.С. Кошовский и др. // Биодиагностика в экологической оценке почв и сопредельных сред: Тезисы докладов Международной конференции. Москва 4-6 февраля 2013 г. – С. 33.
- Долгодворова А.П. Сопостовление различных форм и концентраций селена методом фототестирования / А.П. Долгодворова // Биодиагностика в экологической оценке почв и сопредельных сред: Тезисы докладов Международной конференции. Москва 4-6 февраля 2013 г. – С. 60.
- Ефремова К.В. Изучение влияния различных концентраций стероидного гормона (24-эпибрассинолида) на прорастание семян, рост корней и их морфометрию / К.В. Ефремова // Биодиагностика в экологической оценке почв и сопредельных сред: Тезисы докладов Международной конференции. Москва 4-6 февраля 2013 г. – С. 74.
- Трифонова Т.А. Оценка влияния антибиотиков ампициллина и тилозина на ферментативную активность дерново-подзолистой почвы и их фитотоксичность для культурных растений / Т.А. Трифонова, С.М. Чеснокова, А.Г. Космачева // Теоретическая и прикладная экология. – 2020. – №2. – С. 150-156.
- Arikan O. A. Degradation and metabolization of chlortetracycline during the anaerobic digestion of manure from medicamed calves / O. A. Arikan, J. Hazard // Mater. 2008. No. 158. Р. 485–490.
- Chelliapan S, Wilby T, Sallis P. J. Performance of an up-flow anaerobic stage reactor (UASA) in the treatment of pharmaceutical wastewater containing macrolide antibiotics. Water Res. 2006. No. 40. P. 506–516.
- Мащенко З. Е. Биодеградация цефтриаксона в процессе биологической очистки сточных вод / З. Е. Мащенко, Р. В. Шафигулин, И. Ф. Шаталаев // Известия Самарского научного центра РАН. – 2011. – №1-8. – C. 2070–2072.
- Blackwell P.A. Evaluation of a lower tier exposure assessment model for veterinary medicines / Blackwell P.A., Boxall A.B.A., Kay P., Noble H. // J Agric Food Chem. 2005. No. 53. P. 2192-2201.
- Heberer, T. Occurrence, fate, and removal of pharmaceutical residues in the aquatic environment: a review of recent research data / Heberer, T. // Toxicology Letters. 2002. No.131. P. 5-17.
- Удалова А.Ю., Дмитриенко С.Г., Апяри В.В. Методы выделения, концентрирования и определения антибиотиков тетрациклиновой группы / А.Ю. Удалова, С.Г. Дмитриенко, В.В. Апяри // Журнал аналитической химии. – 2015. – Т.70. – №6. – С. 577-593.
- Lach J. Antibiotics in the Environment as one of the Barriers to Sustainable Development / Lach J., Stepniak L., Ociep-Kubicko A. // Problems of sustainable development. 2018. Vol. 13. No 1. P. 197-207.
- Khasanov V.V. Sokolovich E.G. Dychko K.A. Determination of ceftriaxone in blood and tissues using ion-exchange chromatography / Khasanov V.V. Sokolovich E.G. Dychko K.A. // Pharmaceutical Chemistry Journal. 2006. Vol. 40. No. 2. P. 109-111.
- Егоров Н.С. Основы учения об антибиотиках / Н.С. Егоров. М.: Изд-во МГУ, 2004. – 528 с.
Список литературы на английском языке / References in English
- Barenbojm G.M. Zagrjaznenie prirodnyh vod lekarstvami [Pollution of Natural Waters with Medicines] / Barenbojm G.M., Chiganova M.A.. M.: Nauka, 2015. – 283 p. [in Russian].
- Vodjanickij Ju.N. Zagrjaznenie pochv i pochvenno-gruntovyh vod novymi organicheskimi mikropolljutantami (obzor)[ Contamination of soils and soil-ground waters by new organic micropollutants (review)]/ Vodjanickij Ju.N. Jakovlev A.S. // Pochvovedenie [Soil science]. – 2016. – №5. – P. 609-619. [in Russian].
- Terehova V.A. Rasprostranenie i biologicheskie jeffekty antibiotikov v vodnyh jekosistemah (obzor) [Distribution and biological effects of antibiotics in aquatic ecosystems (review)] / Terehova V.A., Rudneva I.I., Poromov A.A., Paramonova A.I., Kydralieva K.A. // Voda: himija i jekologija [Water: chemistry and ecology]. 2019. № 3-6(119), P. 92-112. [in Russian].
- Antibiotikorezistentnost' uslovno-patogennyh mikroorganizmov poverhnostnyh vodoemov g. Rostova-na-Donu. Evrazijskij sojuz uchenyh. 2015. 5(14). P. 10-13. [in Russian].
- Hui Gao Complex migration of antibiotic resistance in natural aquatic environments / Hui Gao, Linxiao Zhang, Zihao Lu, Chunming He, Qianwei Li, Guangshui Na // Environmental Pollution. 2018. Vol. 232. p. 1-9.
- Briko N.I. Jekologicheskie i medicinskie problemy biologicheskoj bezopasnosti [Environmental and health issues in biosafety] / Briko N.I., Pokrovskij V.I. //Biozashhita i biobezopasnost' [Biosecurity and biosafety]. – 2010. – №1(2). – P. 10-20. [in Russian].
- Briko N.I. Infekcionnye bolezni v jepohu globalizacii [Infectious diseases in the era of globalization] / Briko N.I. // Medicinskie Novosti [Medical News]. – 2014. – №12 (243). – P. 21-23. [in Russian].
- Sadovnikova L.K. Jekologija i ohrana okruzhajushhej sredy pri himicheskom zagrjaznenii. [Ecology and environmental protection in case of chemical pollution] / Sadovnikova L.K., Orlov D.S., Lozanskaja I.N. Ucheb. posobie. M.: Vysshaja shkola, 2008. – 334 p. [in Russian].
- Melehova O.P. Biologicheskij kontrol' okruzhajushhej sredy: bioindikacija i biotestirovanie [Biological control of the environment: bioindication and biotesting] / Melehova O.P., Sarapul'ceva E.I., Evseeva T.I. et al M.: Publishing house. centr «Akademija», 2008. – 288 p. [in Russian].
- Coj R.M. Jeffektivnost' razlichnyh test-sistem v ocenke mutagennoj aktivnosti zagrjaznennyh vod [The effectiveness of various test systems in assessing the mutagenic activity of contaminated waters] / Coj R.M., Pak I.V. //Jekologija [Ecology]. – 1996. – №3. – P. 194-197. [in Russian].
- Vlasov D.V. Biotestirovanie talyh snegovyh vod: vozmozhnosti i ogranichenija. [Biotesting of melted snow water: possibilities and limitations.] / Vlasov D.V., Golovanov D.L., Koshovskij D.S. et al. // Biodiagnostika v jekologicheskoj ocenke pochv i sopredel'nyh sred: Tezisy dokladov Mezhdunarodnoj konferencii [Biodiagnostics in the ecological assessment of soils and adjacent environments: Abstracts of the International Conference]. Moskva 4-6 fevralja 2013. – P. 33. [in Russian].
- Dolgodvorova A.P. Sopostovlenie razlichnyh form i koncentracij selena metodom fototestirovanija [Comparison of different forms and concentrations of selenium by testing method] / Dolgodvorova A.P. // Biodiagnostika v jekologicheskoj ocenke pochv i sopredel'nyh sred: Tezisy dokladov Mezhdunarodnoj konferencii [Biodiagnostics in the ecological assessment of soils and adjacent environments: Abstracts of the International Conference]. Moskva 4-6 fevralja 2013. – P. 60. [in Russian].
- Efremova K.V., Izuchenie vlijanija razlichnyh koncentracij steroidnogo gormona (24-jepibrassinolida) na prorastanie semjan, rost kornej i ih morfometriju [Study of the effect of different concentrations of steroid hormone (24-epibrassinolide) on seed germination, root growth and their morphometry.] / Efremova K.V. // Biodiagnostika v jekologicheskoj ocenke pochv i sopredel'nyh sred: Tezisy dokladov Mezhdunarodnoj konferencii [Biodiagnostics in the ecological assessment of soils and adjacent environments: Abstracts of the International Conference]. Moskva 4-6 fevralja 2013 g. – P. 74. [in Russian].
- Trifonova T.A. Ocenka vlijanija antibiotikov ampicillina i tilozina na fermentativnuju aktivnost' dernovo-podzolistoj pochvy i ih fitotoksichnost' dlja kul'turnyh rastenij [Assessment of the effect of antibiotics ampicillin and tylosin on the enzymatic activity of sod-podzolic soil and their phytotoxicity for cultivated plants] / Trifonova T.A., Chesnokova S.M., Kosmacheva A.G. // Teoreticheskaja i prikladnaja jekologija [Theoretical and Applied Ecology]. – 2020. – №2. – P. 150-156. [in Russian].
- Arikan O. A. Degradation and metabolization of Chlortetracycline during the anaerobic digestion of manure from medicamed calves / Arikan O. A., Hazard J. // Mater. 2008. No. 158. Р. 485–490.
- Chelliapan S. Performance of an up-flow anaerobic stage reactor (UASA) in the treatment of pharmaceutical wastewater containing macrolide antibiotics / Chelliapan S, Wilby T, Sallis P. J.. Water Res. 2006. No. 40. P. 506–516.
- Mashhenko Z. E. Biodegradacija ceftriaksona v processe biologicheskoj ochistki stochnyh vod [Biodegradation of ceftriaxone during biological wastewater treatment] / Mashhenko Z. E., Shafigulin R. V., Shatalaev I. F.// Izvestija Samarskogo nauchnogo centra RAN [Bulletin of the Samara Scientific Center of the Russian Academy of Sciences]. – 2011. – №1-8. – P. 2070–2072.
- Blackwell P.A. Evaluation of a lower tier exposure assessment model for veterinary medicines / Blackwell P.A., Boxall A.B.A., Kay P., Noble H. // J Agric Food Chem. 2005. No. 53. P. 2192–2201.
- Heberer, T. Occurrence, fate, and removal of pharmaceutical residues in the aquatic environment: a review of recent research data / Heberer, T. // Toxicology Letters. 2002. No.131. P.5-17.
- Udalova A.Ju. Metody vydelenija, koncentrirovanija i opredelenija antibiotikov tetraciklinovoj gruppy[Methods for the isolation, concentration and determination of antibiotics of the tetracycline group] / Udalova A.Ju., Dmitrienko S.G., Apjari V.V. // Zhurnal analiticheskoj himii [Journal of Analytical Chemistry]. – 2015. – Vol.70. – №6. – P. 577-593.
- Lach J. Antibiotics in the Environment as one of the Barriers to Sustainable Development / Lach J., Stepniak L., Ociep-Kubicko A. // Problems of sustainable development. 2018. Vol. 13. No 1. P. 197-207.
- Khasanov V.V. Determination of ceftriaxone in blood and tissues using ion-exchange chromatography / Khasanov V.V. Sokolovich E.G. Dychko K.A. // Pharmaceutical Chemistry Journal. 2006. Vol. 40. No. 2. P. 109-111.
- Egorov N.S. Osnovy uchenija ob antibiotikah [Antibiotic Fundamentals] / N.S. Egorov. M.: Publishing house MGU, 2004. – 528 p.