ИЗУЧЕНИЕ РЕГЕНЕРАЦИИ ПЕРЕДАВЛЕННОГО СЕДАЛИЩНОГО НЕРВА КРЫСЫ ПОСЛЕ ПРИМЕНЕНИЯ ЭКСПЕРИМЕНТАЛЬНОЙ КЛЕТОЧНОЙ ТЕРАПИИ
ORCID: 0000-0003-0972-8658, Кандидат биологических наук,
ФГБНУ «Институт экспериментальной медицины», Санкт-Петербург
ИЗУЧЕНИЕ РЕГЕНЕРАЦИИ ПЕРЕДАВЛЕННОГО СЕДАЛИЩНОГО НЕРВА КРЫСЫ ПОСЛЕ ПРИМЕНЕНИЯ ЭКСПЕРИМЕНТАЛЬНОЙ КЛЕТОЧНОЙ ТЕРАПИИ
Аннотация
Целью настоящего исследования явилось изучение регенерации нервных волокон поврежденного седалищного нерва крысы с помощью иммуногистохимического выявления периферина и оценка пролиферации нейролеммоцитов после повреждения и аллотрансплантации диссоциированных клеток эмбрионального спинного мозга. Показано, что число регенерирующих нервных волокон в поврежденном (наложение лигатуры, 40 с) нервном стволе крысы через 1 мес после субпериневрального введения взвеси нейральных клеток-предшественников возрастает более, чем в 1,5 раза по сравнению с контролем. Установлено, что стимуляция роста регенерирующих нервных волокон коррелирует с увеличением числа пролиферирующих нейролеммоцитов в нерве реципиента.
Ключевые слова: регенерация нерва, периферин, пролиферация нейролеммоцитов, нейротрансплантация.
Petrova E.S.
ORCID: 0000-0003-0972-8658, PhD in Biology,
FSBSI "Institute of Experimental Medicine," St. Petersburg
STUDY ON REGENERATION OF CRUSHED SCIATIC NERVE OF RAT AFTER USE OF EXPERIMENTAL CELL THERAPY
Abstract
The main goal of this study is to study the regeneration of nerve fibers of the damaged sciatic nerve of the rat using immunohistochemical detection of peripherin and evaluation of proliferation of neurolemmocytes after injury and allotransplantation of dissociated cells of the embryonic spinal cord. It is shown that the number of regenerating nerve fibers in a damaged (ligation, 40 s) nerve trunk of a rat after one month after subperineurial administration of a suspension of neural progenitor cells increases by more than 1.5 times in comparison with the control. It was established that the stimulation of the regenerating nerve fiber growth correlates with the increase in the number of proliferating neurolemmocytes in the recipient's nerve.
Keywords: nerve regeneration, peripherin, proliferation of neurolemmocytes, neurotransplantation.
Результаты многочисленных экспериментальных исследований показали, что клеточная терапия с применением различных стволовых клеток и клеток-предшественников может оказывать стимулирующее влияние на восстановление поврежденных периферических нервных проводников. Результаты экспериментальных исследований по этой проблеме обобщены в нескольких обзорах [1, С. 80], [2, С. 525], [3, С. 42], [4, С. 11], [5, С. 92]. Применяя физиологические методы исследования (поведенческие тесты и измерение скорости проводимости аксонов), а также морфометрическую оценку регенерирующих нервных волокон, многими авторами в эксперименте показано, что использование эмбриональных стволовых клеток, мезенхимных стволовых клеток, нейральных стволовых/прогениторных клеток, стволовых клеток волосяных фолликулов и др. может ускорять рост регенерирующих волокон поврежденного нерва реципиента. Однако механизм этого влияния изучен недостаточно. Целью настоящего исследования явилось изучение регенерации нервных волокон поврежденного седалищного нерва крысы с помощью иммуногистохимического выявления периферина и оценка пролиферации нейролеммоцитов после повреждения и аллотрансплантации диссоциированных клеток эмбрионального спинного мозга.
Материал и методы исследования
В настоящем исследовании использованы крысы Вистар массой 200-250 г (n=20). При работе с животными руководствовались “Правилами проведения работ с использованием экспериментальных животных” (приложение к приказу МЗ СССР № 755 от 12.08.1977г.). Трансплантацию клеток осуществляли по методике, описанной в предыдущих работах [6, С. 549] [7, С. 30]. Выделяли эмбриональные закладки спинного мозга 15-суточных эмбрионов крыс (Е15) в области шейного отдела, диссоциировали с помощью 0,2% химопсина, пипетировали, отмывали средой без химопсина и полученную взвесь клеток вводили в нерв взрослых животных субпериневрально. Перед пересадкой проводили тест на жизнеспособность клеток при помощи 0,2% раствора трипанового синего. Для трансплантации использовали суспензию клеток, если жизнеспособность последних была не менее 85%. Животным контрольной группы вводили 5 мкл среды, не содержащей клетки. Через 1 мес после операции у каждого животного выделяли фрагмент седалищного нерва размером 10 мм в области повреждения и фрагмент дистального конца нерва размером около 3 мм на расстоянии 7 мм от места наложения лигатуры. Осуществляли фиксацию материала в растворе цинк-этанол-формальдегида и после соответствующей обработки материал заливали в парафин. Для выявления регенерирующих нервных волокон использовали кроличьи поликлональные антитела к периферину (Abсam, Великобритания). Для оценки пролиферации нейролеммоцитов применяли мышиные моноклональные антитела к ядерному антигену пролиферирующих клеток PCNA (клон PC10, Dako, Дания). В качестве вторичных реагентов использовали реактивы из наборов Super Sensitive PolymerHRP Detection Kit HRP / Dab (BioGenex, США) и EnVision+System Labbeled Polymer-HRP Anti-Mouse (K4001) (Dako, Дания). При анализе поперечных срезов подсчитывали число периферин-иммунопозитивных волокон на площадь нервного ствола. Подсчет PCNA-содержащих клеток осуществляли на продольных срезах, докрашенных толуидиновым синим, на 1000 нейролеммоцитов, индекс пролиферации выражали в промилле. Различия оценивали по t- и U-критериям и считали значимыми при р<0,05. Количественный анализ проводили на изображениях, полученных с помощью микроскопа Leica DM 750 и цифровой камеры Leica ICC 50 при увеличениях х100 и х1000. Для подсчета использовали программу ImageJ (NIH, США).
Результаты и обсуждение
В настоящей работе в качестве экспериментальной клеточной терапии для поврежденного нерва были применены клетки эмбрионального спинного мозга крысы. В ранее выполненном исследовании [7, С. 30] была дана характеристика клеток полученной после диссоциации эмбрионального спинного мозга Е15 взвеси. Она состоит, главным образом, из нейральных клеток-предшественников, маркером которых является белок Musashi1. Ранее было установлено, что пересаженные клетки выживают в течение двух месяцев после операции и дифференцируются в нейроны и глиоциты [7, С. 30]. В настоящем исследовании мы изучали изменение репаративных процессов, происходящих в нерве реципиента после трансплантации полученной взвеси клеток.
С помощью иммуногистохимического выявления периферина было показано, что через 1 мес после операции на поперечных срезах через дистальный сегмент поврежденного нерва обнаруживаются регенерирующие нервные волокна. Иммуногистохимическая реакция на белок промежуточных филаментов - периферин, позволяет выявлять осевые цилиндры нервных волокон, а их миелиновые оболочки при этом не окрашиваются. Известно, что периферин в большом количестве содержится в осевых цилиндрах нервных волокон периферических нервных проводников [8, С. 1124] и может выступать в качестве нейрального маркера для исследования их регенерации [9, С. 789]. Его функция связана со стабилизацией диаметра аксона и обеспечением нормальной скорости проведения нервного импульса. Срок наблюдений (1 мес) был выбран в связи с тем, что дегенеративные и репаративные процессы в периферических нервных проводниках имеют ряд особенностей. Известно, что в ранние сроки после повреждения в дистальном конце нервного ствола происходит валлеровская дегенерация, сопровождающаяся распадом аксонов, процессами демиелинизации и увеличением фагоцитирующих клеток [10, С. 39]. Почти одновременно начинается формирование новых нервных волокон и их рост в дистальном направлении на периферию. Через 1 мес в дистальном сегменте поврежденного нерва практически отсутствуют продукты распада миелина, и анализ регенерирующих волокон легко осуществим.
Морфометрический анализ регенерирующих аксонов через нерв показал, что уже через 1 мес после наложения лигатуры в дистальном сегменте имеются содержащие периферин регенерирующие волокна разного диаметра (рис.1, б). Установлено, что в экспериментальной группе (с применением клеточной терапии) число периферин-содержащих волокон превышает контроль более, чем в 1,5 раза (таблица).
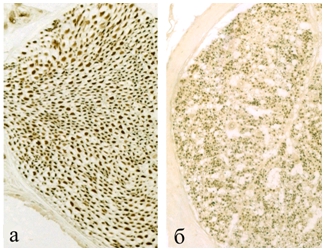
Рис. 1 – Нервные волокна в интактном (а) и поврежденном (б) нерве крысы. Иммуногистохимическая реакция на периферин. Ув.: х400
Таблица 1 – Изменение количества регенерирующих нервных волокон в дистальном сегменте нервного ствола седалищного нерва крысы после повреждения
| n/n | Эксперимент | Срок наблюдения | Число животных | Число нервных волокон |
| 1 | Наложение лигатуры | 1 мес | (n=5) | 3940,9±158,6 |
| 2 | Наложение лигатуры и введение нейральных клеток-предшественников | 1 мес | (n=5) | 6068,5±250,5* |
Одним из показателей структурно-функционального состояния нерва после повреждения является реакция нейролеммоцитов (шванновских клеток (ШК)). Нейролеммоциты - глиальные элементы периферической нервной системы, выполняющие ряд важнейших функций. Они являются основными миелин-образующими клетками нерва. Известно, что вместе с макрофагами нейролеммоциты принимают участие в уборке продуктов распада миелина после валлеровской дегенерации [10, С. 39]. Они участвуют в процессе ремиелинизации. Кроме того, они вырабатывают трофические и ростовые факторы и белки экстрацеллюлярного матрикса, способствуя регенерации нервных волокон [10, С. 39]. По литературным данным известно, что пролиферативная активность ШК в интактном нерве очень низкая. После травмы нерва она возрастает, достигает пика в первые несколько суток, а в дальнейшем постепенно снижается [11, С. 511], [12, С. 1136]. Количественный анализ PCNA-иммунопозитивных нейролеммоцитов показал, что число пролиферирующих нейролеммоцитов через 30 сут после операции составляет 6,5 ± 0,5‰. Содержащие PCNA ядра нейролеммоцитов, имеющие коричневый цвет, отчетливо выявляются среди непролиферирующих клеток, окрашенных толуидиновым синим (рис. 2). Оказалось, что после введения в поврежденный нервный ствол суспензии НСПК число пролиферирующих ШК увеличивается более, чем в полтора раза и составляет 12,5 ± 0,7‰(p<0,05). Учитывая большую значимость нейролеммоцитов для регенерации нервных волокон, можно заключить, что одним из механизмов благоприятного влияния на рост нервных волокон поврежденного нерва проведенной клеточной терапии является стимуляция пролиферации эндогенных шванновских клеток.
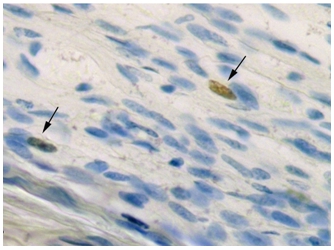
Рис. 2 – Пролиферирующие (стрелки) шванновские клетки в нервном стволе крысы. Иммуногистохимическая реакция на PCNA, докраска толуидиновым синим. Ув.: х1000
Полученные в настоящей работе данные о благоприятном влиянии трансплантации нейральных клеток-предшественников на регенерацию нерва согласуются с результатами исследований, выполненных с применением других методов [13, С. 17] [6, С. 549]. Отмеченный эффект может объясняться тем, что пересаженные клетки способны вырабатывать ряд ростовых и нейротрофических факторов [14, С. 115]. Известно, что эти факторы необходимы для регенерации и роста аксонов [15, С. 1]. Часть из них, как показали результаты данного исследования, могут выступать в качестве митогенов для шванновских клеток.
Таким образом, с помощью иммуногистохимического выявления белка промежуточных филаментов периферина установлено, что число регенерирующих нервных волокон в поврежденном нервном стволе крысы через 1 мес после субпериневрального введения диссоциированных клеток эмбрионального спинного мозга возрастает более, чем в 1,5 раза по сравнению с контролем (введением культуральной среды в том же объеме). Установлено, что стимуляция роста регенерирующих нервных волокон коррелирует с увеличением числа пролиферирующих нейролеммоцитов в нерве реципиента.
Автор выражает глубокую благодарность к.б.н. Е.Н. Исаевой (ФГУП "Гос.НИИ ОЧБ" ФМБА России) за помощь и консультации при осуществлении диссоциации эмбрионального материала.
Список литературы / References
- Walsh S. Use of stem cells to augment nerve injury repair / S.Walsh, R. Midha // –2009. – Vol. 65. – A80–86.
- Петрова Е. С. Применение стволовых клеток для стимуляции регенерации поврежденного нерва / Е. С. Петрова // Цитология. – 2012. – Т. 54. – № 7. – С. 525-540.
- Петрова Е. С. Восстановление поврежденного нерва с помощью клеточной терапии (фундаментальные аспекты) / Е. С.Петрова // Acta Naturae (русскоязычная версия). – 2015. – Т. 7. – № 3 (26). – С. 42-53.
- Fairbairn N. G. Augmenting peripheral nerve regeneration using stem cells: A review of current opinion / N.G. Fairbairn, A. V. Meppelink, J. Ng-Glazier et al. // World J. Stem. Cells. – 2015. – Vol. 7. – № 1. – P. 11–26.
- Щаницын И. Н. Cтимуляция регенерации периферического нерва: современное состояние, проблемы и перспективы / И. Н. Щаницын, А. Н. Иванов, С. П. Бажанов и др. // Успехи физиол. наук. – 2017. – Т. 48. – № 3. – С. 92-112.
- Петрова Е. С. Изучение влияния аллотрансплантатов эмбриональных закладок спинного мозга крыс на рост регенерирующих волокон нерва реципиента / Е. С. Петрова, Е. Н. Исаева // Известия РАН. Сер. биол. – 2014. – № 6. – С. 549-557.
- Петрова Е. С. Развитие диссоциированных клеток различных закладок ЦНС крысы в условиях пересадки в поврежденный нерв / Е. С.Петрова, Е. Н. Исаева, Д. Э. Коржевский // Морфология. – 2013. – Т. 143. – № 2. – С. 30-34.
- Portier M. M. Peripherin and neurofilaments: expression and role during neural development / M. Portier, M. Escurat, F. Landon et al. // C.R.Acad.Sci.III. – 1993. – Vol. 316. – P. 1124-1140.
- Петрова Е.С. Изучение регенерации седалищного нерва крысы после наложения лигатуры (иммуногистохимическое исследование) // Материалы XXIII съезда Физиологического общества имени И.П. Павлова. 18-22 сентября 2017 г. Воронеж. / Воронежский государственный медицинский университет им. Н. Н. Бурденко. – Воронеж, 2018. – С. 729-731.
- Zochodne D. W. Neurobiology of peripheral nerve regeneration. Cambridge university press / D. W. Zochodne. –Cambridge, New York, Melbourne, Madrid, Cape Town, Singapore, Sao Paulo: Cambridge University Press, 2008. – 276 p.
- Kobayashi M. Proliferating immature Schwann cells contribute to nerve regeneration after ischemic peripheral nerve injury/ М. Kobayashi, S. Ishibashi, H. Tomimitsu et al. // Neuropathol. Exp. Neurol. – 2012. – Vol. 71. – № 6. – Р. 511-519.
- Stewart H.J. Changes in DNA synthesis rate in the Schwann cell lineage in vivo are correlated with the precursor Schwann cell transition and myelination / H.J. Stewart, Morgan, K.R. Jessen et al. //Eur. J. Neurosci. – 1993. – V. 5. – № 9. – Р.1136-1144.
- Murakami T. Transplanted neuronal progenitor cells in a peripheral nerve gap promote nerve repair / T. Murakami, Y. Fujimoto, Y. Yasunaga et al. // Brain Res. – 2003. – Vol. 973. – P. 17-24.
- Lu P.Neural stem cells constitutively secrete neurotrophic factors and promote extensive host axonal growth after spinal cord injury/ P. Lu, L. L. Jones, E. Y. Snyder and others // Exp. Neurol. – 2003. – Vol.181. – P. 115-129.
- Terenghi G. Peripheral nerve regeneration and neurotrophic factors / G.Terenghi // J. Anat. – 1999. – Vol. – P. 1-14.
Список литературы на английском языке / References in English
- Walsh S. Use of stem cells to augment nerve injury repair / S. Walsh, R. Midha // Neurosurgery. -2009. - Vol. 65.-A80-86.
- Petrova E. S. Primeneniye stvolovykh kletok dlya stimulyatsii regeneratsii povrezhdennogo nerva [Use of Stem Cells to Stimulate Regeneration of Damaged Nerve] / E. S. Petrova // Cytology. – 2012. – V. 54. – No. 7. – P.525-540. [In Russian]
- Petrova E. S. Vosstanovleniye povrezhdennogo nerva s pomoshch'yu kletochnoy terapii (fundamental'nyye aspekty) [Restoration of Damaged Nerve with Help of Cellular Therapy (Fundamental Aspects)] / E. S. Petrova // Acta Naturae (Russian version). – 2015. – V. 7. – No. 3 (26). – P. 42-53. [In Russian]
- Fairbairn N. G. Augmenting peripheral nerve regeneration using stem cells: A review of current opinion / N. G. Fairbairn, A. V. Meppelink, J. Ng-Glazier et al. // World J. Stem. Cells. - 2015. - Vol. 7. - No. 1. - P. 11-26.
- Shchanitsyn I. N. Ctimulyatsiya regeneratsii perifericheskogo nerva: sovremennoye sostoyaniye, problemy i perspektivy [Stimulation of Peripheral Nerve Regeneration: Current Status, Problems and Perspectives] / I. N. Shchanitsyn, A. N. Ivanov, S.P. Bazhanov and others // Uspekhi fiziol. sciences. – 2017. – T. 48. – No. 3. – P. 92-112. [In Russian]
- Petrova E. S. A study of the effect of allografts of embryonic rat spinal cord inserts on the growth of regenerating nerve fibers of the recipient / E. S. Petrova, E. N. Isaeva // Proceedings of the Russian Academy of Sciences. Ser. Biol. - 2014. - No. 6. - P. 549-557.
- Petrova E.S. Razvitiye dissotsiirovannykh kletok razlichnykh zakladok TSNS krysy v usloviyakh peresadki v povrezhdennyy nerv [Development of Dissociated Cells of Various Rat CNS Inserts under Conditions of Transplantation into Damaged Nerve] / E.S. Petrova, E.N. Isaeva, D.E. Korzhevsky // Morphology. – 2013. – T. 143. – No. 2. – P. 30-34. [In Russian]
- Portier M. M. Peripherin and neurofilaments: expression and role during neural development / M. M. Portier, M. Escurat, F. Landon et al. // C.R.Acad.Sci.III. - 1993. - Vol. 316.-P. 1124-1140.
- Petrova E. S. Izucheniye regeneratsii sedalishchnogo nerva krysy posle nalozheniya ligatury (immunogistokhimicheskoye issledovaniye) [Study of Regeneration of Sciatic Nerve of Rats after Ligation (Immunohistochemical Examination)] // Materials of the XXIII Congress of the Physiological Society named after I.P. Pavlov. September 18-22, 2017 Voronezh. Voronezh State Medical University. N.N. Burdenko. – Voronezh, 2018. - P. 729-731. [In Russian]
- Zochodne D. W. Neurobiology of peripheral nerve regeneration. Cambridge university press / D. W. Zochodne. -Cambridge, New York, Melbourne, Madrid, Cape Town, Singapore, Sao Paulo: Cambridge University Press, 2008. - 276 p.
- Kobayashi M. Proliferating immature Schwann cells to nerve injury / M. Kobayashi, S. Ishibashi, H. Tomimitsu et al. J. Neuropathol. Exp. Neurol. - 2012. - Vol. 71. - No. 6. - P. 511-519.
- Stewart H. J. Changes in DNA synthesis rate in the Schwann cell lineage in vivo are correlated with the precursor. Schwann cell transition and myelination / H. J. Stewart, L. Morgan, K. R. Jessen et al. // Eur. J. Neurosci. - 1993. - V. 5. - No. 9. - P.1136-1144.
- Murakami T. Transplanted neuronal progenitor cells in a peripheral nerve gap promote nerve repair / T. Murakami, Y. Fujimoto, Y. Yasunaga et al. // Brain Res. - 2003. - Vol. 973. - P. 17-24.
- Lu P. Neural stem cells constitutively secrete neurotrophic factors and promote extensive host axonal growth after spinal cord injury / P. Lu, L. L. Jones, E. Y. Snyder and others // Exp. Neurol. - 2003. - Vol.181. - P. 115-129.
- Terenghi G. Peripheral nerve regeneration and neurotrophic factors / G. Terenghi // J. Anat. - 1999. - Vol. 194. - P. 1-14.
