ИЗУЧЕНИЕ ИММУНОГЕННОСТИ ХИМЕРНОГО БЕЛКА, ВКЛЮЧАЮЩЕГО ЭПИТОПЫ АНТИТЕЛ, НЕЙТРАЛИЗУЮЩИХ ШИРОКИЙ СПЕКТР ПЕРВИЧНЫХ ИЗОЛЯТОВ ВИЧ-1
Андреева Н.Б.1, Рудометов А.П.2, Бакулина А.Ю.3, Щербаков Д.Н.4
1ORCID: 0000-0002-1684-9071, аспирант, Федеральное бюджетное учреждение науки Государственный научный центр вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Кольцово, 2ORCID: 0000-0003-2808-4309, аспирант, Федеральное бюджетное учреждение науки Государственный научный центр вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Кольцово, 3ORCID: 0000-0002-4723-9225, Кандидат биологических наук, Федеральное государственное автономное образовательное учреждение высшего образования «Новосибирский национальный исследовательский государственный университет», Новосибирск, 4ORCID: 0000-0001-8023-4453, Кандидат биологических наук, Федеральное бюджетное учреждение науки Государственный научный центр вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Кольцово
ИЗУЧЕНИЕ ИММУНОГЕННОСТИ ХИМЕРНОГО БЕЛКА, ВКЛЮЧАЮЩЕГО ЭПИТОПЫ АНТИТЕЛ, НЕЙТРАЛИЗУЮЩИХ ШИРОКИЙ СПЕКТР ПЕРВИЧНЫХ ИЗОЛЯТОВ ВИЧ-1
Аннотация
Одним из интенсивно развивающихся направлений в области разработки вакцин является конструирование искусственных или химерных белков содержащих фрагменты антигенов, вызывающих образование протективного иммунного ответа. В области разработки вакцины против ВИЧ-инфекции приоритетным считается направление по созданию иммуногенов, способных обеспечить индукцию антител, нейтрализующих широкий спектр первичных изолятов ВИЧ-1. Первым этапом оценки любого иммуногена является изучение его безвредности для организма и иммунохимических свойств. В данной работе приведены результаты исследования иммунохимических и иммуногенных свойств химерного белка включающего фрагмент полипептида B. subtilis и участок gp41 ВИЧ-1 MPER. Было показано, что эпитопы широконейтрализующих антител, входящих в этот регион, распознаются соответствующими моноклональными антителами. Иммунизация лабораторных животных очищенным химерным белком показала, что он не токсичен для животных и обладает высокой иммуногенностью. Полученный иммуноген будет использован в дальнейших исследованиях, направленных на индукцию широконейтрализующих антител.
Ключевые слова: ВИЧ-1, иммуноген, эпитоп, MPER, широконейтрализующие антитела.
Andreeva N.B.1, Rudometov A.P.2, Bakulina A.Yu.3, Shcherbakov D.N.4
1ORCID: 0000-0002-1684-9071, Postgraduate student, Federal Budgetary Institution of Science State Research Center of Virology and Biotechnology VECTOR of the Federal Service for Surveillance in Consumer Rights Protection and Human Well-being , Koltsovo, 2ORCID: 0000-0003-2808-4309, Postgraduate student, Federal Budgetary Institution of Science State Research Center of Virology and Biotechnology VECTOR of the Federal Service for Surveillance in Consumer Rights Protection and Human Well-being , Koltsovo, 3ORCID: 0000-0002-4723-9225, PhD in Biology, Federal State Autonomous Educational Institution of Higher Education "Novosibirsk National Research University", Novosibirsk, 4ORCID: 0000-0001-8023-4453, PhD in Biology, Federal Budgetary Institution of Science State Research Center of Virology and Biotechnology VECTOR of the Federal Service for Surveillance in Consumer Rights Protection and Human Well-being , Koltsovo
STUDY OF THE IMMUNOGENICITY OF CHIMERIC PROTEIN COMPRISING EPITOPES OF ANTIBODIES NEUTRALIZING A WIDE RANGE OF PRIMARY ISOLATES OF HIV-1
Abstract
One of the intensively developing areas in the field of vaccine development is the construction of artificial or chimeric proteins containing fragments of antigens that cause the formation of protective immune response. In the field of developing a vaccine against HIV infection, the priority is to develop immunogens capable to provide induction of antibodies neutralizing a wide range of primary HIV-1 isolates. The first step in evaluating any immunogen is to study its harmlessness to the body and its immunochemical properties. In this paper, we present the results of a study of the immunochemical and immunogenic properties of a chimeric protein comprising a B. subtilis polypeptide fragment and an HIV-1 MPER gp41 site. It has been shown that the epitopes of broadly neutralizing antibodies included into this region are recognized by the corresponding monoclonal antibodies. Immunization of laboratory animals with purified chimeric protein showed that it is not toxic to animals and has high immunogenicity. The resulting immunogen will be used in further studies aimed at the induction of broadly neutralizing antibodies.
Keywords: HIV-1, immunogen, epitope, MPER, broadly neutralizing antibodies.
Общее число носителей ВИЧ-инфекции в мире на данный момент составляет 36,7 млн. Россия – одна из стран в мире, где число новых заражений ВИЧ-инфекцией и число смертей, связанных с ВИЧ/СПИД, продолжают возрастать. На 31 декабря 2016 года в России официально зарегистрировано 1 114 815 ВИЧ-инфицированных [1].
Вакцины, считаются одним из самых эффективных средств борьбы с инфекционными заболеваниями. Классическим примером может служить вакцина против натуральной оспы человека, которая позволила элиминировать данный вирус из популяции человека. В случае вируса иммунного дефицита человека классические подходы по созданию вакцины, такие как использование аттенуированного или инактивированного вируса оказались не эффективны. В связи с этим, разрабатываются альтернативные технологии создания вакцин. Так, в настоящее время основной концепцией эффективной вакцины против ВИЧ-1 считается создание иммуногена или комбинации иммуногенов, направленных на индукцию в организме антител, способных обеспечить защиту от широкого спектра вариантов первичных изолятов ВИЧ-1 [2, С. 635].
На сегодняшний день на основе репертуара антител ВИЧ-инфицированных пациентов были получены десятки человеческих моноклональных антител (monoclonal antibodies, mAbs), которые могут нейтрализовать широкое разнообразие генетических вариантов ВИЧ-1 [3, С. 138], [4, С. 1097]. Данные широко нейтрализующие антитела (broadly neutralizing antibodies, bnAbs) нацелены на несколько консервативных сайтов уязвимости на поверхности гликопротеина вирусной оболочки [5, C. 382], [6, C. 3]. Одной из таких мишеней является мембрано-проксимальная наружная область (membrane proximal external region, MPER), представляющая собой высококонсервативную область, состоящую из 22 аминокислотных остатков, расположенных на С-конце эктодомена gp41. Считается, что MPER играет решающую роль при слиянии вирусной и клеточной мембран [7, C. 6089], [8, C. 2469]. На MPER нацелены такие bnAbs, как 2F5, Z13e1, 4E10 и 10E8 [9, C. 406], [10, C. 1651]. Среди этих антител, наибольший интерес представляют 4E10 и 10E8, из-за их способности нейтрализовать ~ 98% тестируемых штаммов ВИЧ-1. Структура эпитопов этих антител была точно определена на основе данных рентгеноструктурного анализа и включает аминокислотные остатки (671NWFDITNWLWYIK683) [9, C. 406], [11, C. 1533].
Несмотря на то, что эти эпитопы имеют линейную структуру, попытки разработать вакцину, которая смогла бы индуцировать 4Е10/10E8-подобные bnAbs, оказались безуспешными [12, C. 17], [13 C. 187].
Одной из проблем в индукции нейтрализующих антител к MPER является то, что структура субъединицы gp41 является подвижной, так как данный участок претерпевает структурные изменения при слиянии вирусной и клеточной мембран [14, C. 111]. Таким образом, главной проблемой при разработке вакцины на основе MPER является разработка иммуногенов и/или разработка стратегий вакцинации, которые «заставят» иммунную систему концентрировать гуморальный ответ на область MPER, и также направлять созревание антител таким образом, чтобы зрелые антитела в большей степени связывались с регионами уязвимости.
Нами было решено сконструировать молекулу, на основе белка, позволяющего включать эпитопы MPER при сохранении их структуры в составе белка-носителя (белка-каркаса). Для этого был использован глобулярный белок B. subtilis YkuJ (номер PDB 2FFG.), с известной структурой, конформационная структура концевых участков которого наиболее близка к конформации нативного MPER ВИЧ-1 и позволяет включить одновременно два таких региона. Далее, была спроектирована нуклеотидная последовательность гена, кодирующая химерный рекомбинантный белок YkuJ-MPER. В состав гена YkuJ-MPER были заложены две нуклеотидные консенсусные последовательности MPER ВИЧ-1 субтипа B по N- и C концам. Последовательности MPER были фланкированы уникальными сайтами рестрикции для клонирования гена в составе плазмиды и возможности изменения нуклеотидной последовательности MPER на последовательности других субтипов. Помимо этого, в конструкцию YkuJ-MPER была введена полигистидиновая метка 6xHis, для возможности очищать белок с помощью металл-хелатной хроматографии.
Ген, кодирующий химерный белок YkuJ-MPER, был химически синтезирован и клонирован в составе плазмидного экспрессионного вектора pET21a (Novagen). Полученной плазмидой были трансформированы клетки E. coli штамма BL21 для наработки рекомбинантного белка.
Экспрессию гена, кодирующего белок-иммуноген, оценивали с помощью электрофоретического разделения лизата клеток E.coli BL21/ pYkuJ-MPER в 15% полиакриламидном геле (ПААГ) по стандартной методике, описанной Лэммли [15, C. 680]. Анализ электрофореграммы показал наличие полосы, по подвижности соответствующей теоретически рассчитанной молекулярной массе рекомбинантного белка YkuJ-MPER.
Очистку рекомбинантного белка YkuJ-MPER проводили с помощью металл-хелатной хроматографии. Было установлено, что белок находится в нерастворимой фракции, поэтому его выделяли и очищали из дебриса (осадок, формируемый в результате центрифугирования суспензии гомогенизированных клеток и содержащий полуразрушенные клетки). Для этого биомассу бактериальных клеток E. coli BL21/pYkuJ-MPER после индукции 1М ИПТГ дезинтегрировали с помощью ультразвукового дезинтегратора, клеточный дебрис отделяли от растворимой фракции с помощью центрифугирования. Полученный дебрис растворяли в 8 М мочевине, после чего наносили на хроматографическую колонку, содержащую Ni-агарозу, отмывали от не связавшихся примесных белков и элюировали с помощью буфера, содержащего 0.5 М имидазол. Рефолдинг белка, связавшегося с металл-хелатным сорбентом, проводили диализом против физиологического раствора.
Для подтверждения связывания белка YkuJ-MPER с моноклональными антителами, такими как 2F5, 4Е10 и 10E8, проводили вестерн-блот анализ. Он подтвердил, что эпитопы в составе химерного белка YkuJ-MPER распознаются МКА 2F5, 4Е10 и 10E8.
Для анализа иммуногенности химерного белка, очищенным препаратом YkuJ-MPER были иммунизированы мыши линии BALB/c и беспородные кролики. Степень очистки YkuJ-MPER используемого для иммунизации контролировали с помощью электрофореза в 15 % ПААГ. В конечном препарате чистота белка составляла более 98% (рис. 1).

Рис.1 – Очищенный препарат белка YkuJ-MPER для иммунизации. 1 – Компонент вакцины КомбиВИЧвак белок TBI, 2 – Препарат белка YkuJ-MPER, 3 – маркер молекулярной массы (14, 25, 45 и 66 кДа)
Для иммунизации были отобраны 20 мышей линии BALB/c – 10 из которых были трехкратно иммунизированы внутримышечно по схеме: первая иммунизация – 50 мкг препарата (на одну мышь) с полным адъювантом Фрейнда, вторая иммунизация – 50 мкг препарата с неполным адъювантом Фрейнда, третья иммунизация – 100 мкг чистым белком. Иммунизация проводилась с интервалом 2 недели. Второй группе мышей в количестве 10 особей служащей в качестве отрицательного контроля – вводился физиологический раствор, по той же схеме. По этой же схеме были иммунизированы два беспородных кролика, количество вводимого иммуногена было увеличено до 500 мкг на особь, в качестве отрицательного контроля служила сыворотка этих же кроликов взятая перед иммунизацией. Все животные содержались в питомнике согласно правилам лабораторной практики и получали должный уход.
Полученные сыворотки лабораторных животных после иммунизации были протестированы в иммуноферментном анализе для оценки иммуногенности химерного белка YkuJ-MPER [16, C. 134]. Было показано, что антитела из сывороток иммунизированных животных специфически взаимодействуют с рекомбинантным белком YkuJ-MPER. Титр сывороток иммунизированных животных в обоих случаях составил более 1:3 миллионов (рис. 2).
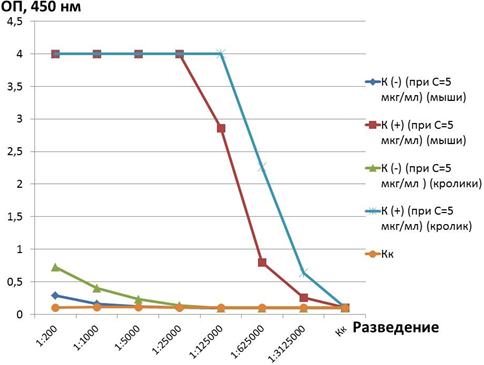
Рис. 2 – Результаты иммуноферментного анализа
В качестве антигена был сорбирован белок YkuJ-MPER. Синяя линия – отрицательный контроль (сыворотки мышей, иммунизированных физиологическим раствором); красная линия – сыворотки мышей, иммунизированных белком-иммуногеном YkuJ-MPER; зеленая линия – отрицательный контроль (сыворотки кроликов, взятые до иммунизации); голубая линия – сыворотки кроликов, иммунизированных белком-иммуногеном YkuJ-MPER; оранжевая линия – контроль коньюгата.
Таким образом, в ходе данного исследования проведен теоретический дизайн химерного белка-иммуногена, на основе белка B. subtilis YkuJ, и участка MPER gp41 ВИЧ-1. Получена генетическая конструкция, кодирующая химерный белок YkuJ-MPER, и рекомбинантный штамм E. coli BL21/pYkuJ-MPER, продуцирующий белок-иммуноген YkuJ-MPER. Проанализированы биохимические и иммуногенные свойства химерного белка YkuJ-MPER. С помощью иммуноблоттинга было показано, что эпитопы широконейтрализующих антител в составе YkuJ-MPER распознаются соответствующими МКА. Проведена оценка иммуногенности рекомбинантного белка YkuJ-MPER путем иммунизации лабораторных животных и оценка специфической активности полученных сывороток в ИФА. Показано, что химерный белок YkuJ-MPER не токсичен для животных и что антитела из сывороток иммунизированных животных специфически взаимодействуют с рекомбинантным белком YkuJ-MPER.
Список литературы / References
- Федеральный научно-методический Центр по профилактике и борьбе со СПИДом [Электронный ресурс]. – URL: http://www.hivrussia.ru/ (дата обращения: 20.07.2017).
- Burton D. R. Broadly neutralizing antibodies to HIV and their role in vaccine design / Burton D. R., Hangartner L. // Annual review of immunology. – 2016. – V. 34. – P.635–659. doi: 10.1146/annurev-immunol-041015-055515.
- Huang J. Broad and potent HIV-1 neutralization by a human antibody that binds the gp41–gp120 interface / Huang J., Kang B.H., Pancera M. et al. // Nature. – 2014. – V. 515. – P. 138–142. doi: 10.1038/nature13601.
- Pejchal R. A potent and broad neutralizing antibody recognizes and penetrates the HIV glycan shield / Pejchal R., Doores K.J., Walker L.M. et al. // Science. – 2011. – V. 334. – P. 1097–1103. doi: 10.1126/science.1213256.
- Georgiev I.S. Elicitation of HIV-1- neutralizing antibodies against the CD4-binding site / Georgiev I.S., Gordon Joyce M., Zhou T., Kwong P.D. // Current Opinion in HIV and AIDS. – 2013. – V. 8. – P. 382–392. doi: 10.1097/COH.0b013e328363a90e.
- Haynes B.F. Progress in HIV-1 vaccine development / Haynes B.F., Moody M.A., Alam M. et al. // Journal of Allergy and Clinical Immunology. – 2014. – V. 134. – P. 3–10. doi: 10.1016/j.jaci.2014.04.025.
- Muñoz-Barroso I. Role of the membrane-proximal domain in the initial stages of human immunodeficiency virus type 1 envelope glycoprotein-mediated membrane fusion / Muñoz-Barroso I., Salzwedel K., Hunter E., Blumenthal R. // Journal of Virology. – 1999. – V. 73. – P. 6089–6092.
- Salzwedel K. A conserved tryptophan-rich motif in the membrane-proximal region of the human immunodeficiency virus type 1 gp41 ectodomain is important for Env-mediated fusion and virus infectivity / Salzwedel K., West J.T., Hunter E. // Journal of Virology. – 1999. – V. – P. 2469–2480.
- Huang J. Broad and potent neutralization of HIV-1 by a gp41-specific human antibody / Huang J., Ofek G., Laub L., Louder M.K. et al. // Nature. – 2012. – V. 491. – № 7424. – P. 406–412. doi: 10.1038/nature11544.
- Purtscher M. A broadly neutralizing human monoclonal antibody against gp41 of human immunodeficiency virus type 1 / Purtscher M., Trkola A., Gruber G. et al. // AIDS Research and Human Retroviruses. – 1994. – V. 10. – P. 1651–1658. doi: 10.1089/aid.1994.10.1651.
- Cardoso R.M.F. Structural basis of enhanced binding of extended and helically constrained peptide epitopes of the broadly neutralizing HIV-1 antibody 4E10 / Cardoso R.M.F., Brunel F.M., Ferguson S. et al. // Journal of Molecular Biology. – 2007. – V. 365. – P. 1533–1544. doi:10.1016/j.jmb.2006.10.088.
- Banerjee S. Modulating immunogenic properties of HIV-1 gp41 membrane-proximal external region by destabilizing sixhelix bundle structure / Banerjee S., Shi H., Habte H.H., Qin Y., Cho M.W. // Virology. – 2016. – V. – P. 17–26. doi: 10.1016/j.virol.2016.01.002.
- Habte H.H. Immunogenic properties of a trimeric gp41-based immunogen containing an exposed membrane-proximal external region / Habte H.H., Banerjee S., Shi H., Qin Y., Cho M.W. // Virology. – 2015. – V. 486. – P. 187–197. doi: 10.1016/j.virol.2015.09.010.
- Melikyan G.B. Common principles and intermediates of viral protein-mediated fusion: the HIV-1 paradigm / Melikyan G.B. // Retrovirology. – 2015. V. 5. – P. 111. doi: 10.1186/1742-4690-5-111.
- Laemmli U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4 / Laemmli U.K. // Nature. – 1970. – V. 227. – P. 680–685. doi: 10.1038/227680a0.
- Егоров А.М. Теория и практика иммуноферментного анализа / А.М. Егоров. – М.: Высшая школа, 1991. – 288 с.
Список литературы на английском языке / References in English
- Federal'nyj nauchno-metodicheskij Centr po profilaktike i bor'be so SPIDom [Federal scientific and methodological center for AIDS prevention and control] [Electronic resource]. – URL: http://www.hivrussia.ru/ (accessed: 20.07.2017). [in Russian]
- Burton D. R. Broadly neutralizing antibodies to HIV and their role in vaccine design / Burton D. R., Hangartner L. // Annual review of immunology. – 2016. – V. 34. – P.635–659. doi: 10.1146/annurev-immunol-041015-055515.
- Huang J. Broad and potent HIV-1 neutralization by a human antibody that binds the gp41–gp120 interface / Huang J., Kang B.H., Pancera M. et al. // Nature. – 2014. – V. 515. – P. 138–142. doi: 10.1038/nature13601.
- Pejchal R. A potent and broad neutralizing antibody recognizes and penetrates the HIV glycan shield / Pejchal R., Doores K.J., Walker L.M. et al. // Science. – 2011. – V. 334. – P. 1097–1103. doi: 10.1126/science.1213256.
- Georgiev I.S. Elicitation of HIV-1- neutralizing antibodies against the CD4-binding site / Georgiev I.S., Gordon Joyce M., Zhou T., Kwong P.D. // Current Opinion in HIV and AIDS. – 2013. – V. 8. – P. 382–392. doi: 10.1097/COH.0b013e328363a90e.
- Haynes B.F. Progress in HIV-1 vaccine development / Haynes B.F., Moody M.A., Alam M. et al. // Journal of Allergy and Clinical Immunology. – 2014. – V. 134. – P. 3–10. doi: 10.1016/j.jaci.2014.04.025.
- Muñoz-Barroso I. Role of the membrane-proximal domain in the initial stages of human immunodeficiency virus type 1 envelope glycoprotein-mediated membrane fusion / Muñoz-Barroso I., Salzwedel K., Hunter E., Blumenthal R. // Journal of Virology. – 1999. – V. 73. – P. 6089–6092.
- Salzwedel K. A conserved tryptophan-rich motif in the membrane-proximal region of the human immunodeficiency virus type 1 gp41 ectodomain is important for Env-mediated fusion and virus infectivity / Salzwedel K., West J.T., Hunter E. // Journal of Virology. – 1999. – V. – P. 2469–2480.
- Huang J. Broad and potent neutralization of HIV-1 by a gp41-specific human antibody / Huang J., Ofek G., Laub L., Louder M.K. et al. // Nature. – 2012. – V. 491. – № 7424. – P. 406–412. doi: 10.1038/nature11544.
- Purtscher M. A broadly neutralizing human monoclonal antibody against gp41 of human immunodeficiency virus type 1 / Purtscher M., Trkola A., Gruber G. et al. // AIDS Research and Human Retroviruses. – 1994. – V. 10. – P. 1651–1658. doi: 10.1089/aid.1994.10.1651.
- Cardoso R.M.F. Structural basis of enhanced binding of extended and helically constrained peptide epitopes of the broadly neutralizing HIV-1 antibody 4E10 / Cardoso R.M.F., Brunel F.M., Ferguson S. et al. // Journal of Molecular Biology. – 2007. – V. 365. – P. 1533–1544. doi:10.1016/j.jmb.2006.10.088.
- Banerjee S. Modulating immunogenic properties of HIV-1 gp41 membrane-proximal external region by destabilizing sixhelix bundle structure / Banerjee S., Shi H., Habte H.H., Qin Y., Cho M.W. // Virology. – 2016. – V. – P. 17–26. doi: 10.1016/j.virol.2016.01.002.
- Habte H.H. Immunogenic properties of a trimeric gp41-based immunogen containing an exposed membrane-proximal external region / Habte H.H., Banerjee S., Shi H., Qin Y., Cho M.W. // Virology. – 2015. – V. 486. – P. 187–197. doi: 10.1016/j.virol.2015.09.010.
- Melikyan G.B. Common principles and intermediates of viral protein-mediated fusion: the HIV-1 paradigm / Melikyan G.B. // Retrovirology. – 2015. V. 5. – P. 111. doi: 10.1186/1742-4690-5-111.
- Laemmli U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4 / Laemmli U.K. // Nature. – 1970. – V. 227. – P. 680–685. doi: 10.1038/227680a0.
- Egorov A.M. Teorija i praktika immunofermentnogo analiza [Theory and practice of enzyme immunoassay] / A.M. Egorov. – M.: Vysshaja shkola, 1991. – 288 p. [in Russian]
