ИССЛЕДОВАНИЕ ЗАВИСИМОСТИ СКОРОСТИ СЕНСОМОТОРНОЙ ИНТЕГРАЦИИ ОТ МОМЕНТА ПРЕДЪЯВЛЕНИЯ СЕНСОРНОЙ ПОРОГОВОЙ СТИМУЛЯЦИИ, СИНХРОНИЗИРОВАННОЙ С ЗАДАННОЙ ФАЗОЙ ДОМИНИРУЮЩЕГО ФОНОВОГО РИТМА ЭЭГ ЧЕЛОВЕКА.
ИССЛЕДОВАНИЕ ЗАВИСИМОСТИ СКОРОСТИ СЕНСОМОТОРНОЙ ИНТЕГРАЦИИ ОТ МОМЕНТА ПРЕДЪЯВЛЕНИЯ СЕНСОРНОЙ ПОРОГОВОЙ СТИМУЛЯЦИИ, СИНХРОНИЗИРОВАННОЙ С ЗАДАННОЙ ФАЗОЙ ДОМИНИРУЮЩЕГО ФОНОВОГО РИТМА ЭЭГ ЧЕЛОВЕКА.
Научная статья
Пушкин А.А.1, *, Мелещенко Е.А.2
1 ORCID: 0000-0002-9412-9475;
2 ORCID: 0000-0002-9230-8293;
1, 2 Академия биологии и биотехнологии им. Д. И. Ивановского ЮФУ, Ростов-на-Дону, Россия
* Корреспондирующий автор (artyompushkin[at]yandex.ru)
АннотацияНа 22 практически здоровых обследуемых обоего пола показано, что фотостимуляция, синхронизованная с восходящими фазами альфа-волн, вызывает статистически значимое снижение мощности в альфа-частотном диапазоне по сравнению с фоном. Было установлено, что зрительные стимулы, подаваемые на нисходящей фазе альфа-волн, приводят к росту показателя мощности частот тета- и альфа–ритмов по сравнению с фоном. Показана зависимость латентного периода сенсомоторной реакции зависит от фазы потенциала альфа-волны.
Ключевые слова: фазозависимое влияние, сенсорная стимуляция, сенсомоторная интеграция, пейсмекерный альфа-ритм ЭЭГ.
RESEARCH OF DEPENDENCE OF SENSOMOTOR INTEGRATION SPEED ON PRESENTATION TIME OF TOUCH THRESHOLD STIMULATION SYNCHRONIZED WITH PRESENT PHASE OF HUMAN EEG BACKGROUND RHYTHM
Research article
Pushkin A.A.1, *, Meleshenko E.A.2
1 ORCID: 0000-0002-9412-9475;
2 ORCID: 0000-0002-9230-8293;
1, 2 Academy of Biology and Biotechnology named after D. I. Ivanovsky, SFU, Rostov-on-Don, Russia
* Corresponding author (artyompushkin [at] yandex.ru)
Abstract22 healthy subjects of both sexes showed that photostimulation synchronized with the ascending phases of alpha waves causes a statistically significant decrease in power in the alpha frequency range compared to the background. It was found that visual stimuli given in the descending phase of alpha waves lead to an increase in the power index of the frequencies of theta and alpha rhythms compared to the background. The dependence of the latent period of the sensorimotor reaction appeared to depend on the phase of the alpha-wave potential.
Keywords: phase-dependent effect, sensory stimulation, sensorimotor integration, pacemaker alpha-rhythm of the EEG.
ВведениеФаза ритмической составляющей электроэнцефалограммы (ЭЭГ) является одним из главных параметров биоэлектрической активности, определяющих общую интегративную деятельность головного мозга человека. В частности установлено, что фаза альфа-ритма, от которой зависит момент перцепции [1], [2], отражает цикличные флуктуации процесса возбуждения нейронных ансамблей [3], [4], [5].
Показано, что фаза альфа-ритма, т.е. цикл ЭЭГ [6], модулирует когнитивные процессы. Так, согласно литературным сведениям, осознание и идентификация подпороговых стимулов строго зависит от фазового параметра альфа-ритма [11], [12]. Экспериментально доказано, что от фазы альфа-волны также зависит распознавание формы геометрических фигур [12], букв алфавита [13], аудиальных стимулов [14], скорость простой сенсомоторной реакции [12], [14] и амплитуда потенциалов, связанных с событием [15], [16], [17].
Однако эти оригинальные работы имеют, с нашей точки зрения, ключевой методический недостаток, состоящий в организации синхронизации стимула с фазой α-волны сугубо лишь по достижению заданного экспериментатором амплитудного порога, что, в итоге, не может гарантировать подачу стимула строго в фазу волны выбранной частотной полосы. В связи с этим, отличительной особенностью настоящего исследования от вышеупомянутых является фактор частотно-фазовой синхронизации внешних стимулов с эндогенной активностью в α–частотной полосе, поскольку, как нам представляется, именно от него существенно зависят особенности постстимульных модификаций пластических изменений ритмической активности головного мозга.
Таким образом, задача настоящего исследования заключалась в изучении зависимости скорости сенсомоторной интеграции от момента предъявления сенсорной пороговой стимуляции, синхронизированной с заданной фазой доминирующего фонового ритма ЭЭГ человека.
Методы исследования
В электрофизиологическом исследовании приняли участие 22 добровольца в возрасте от 18 до 30 лет (14 мужчин и 8 женщин, средний возраст составил 24.40±6.23). Добровольцы отбирались по критерию представленности высокоамплитудных альфа-волн в окципитальных областях. В рамках экспериментальной парадигмы фазозависимой сенсомоторной реакции человека было выполнено 44 ЭЭГ-исследования.
Анализ влияния сенсорной афферентации, сопряженной в режиме “real time” с необходимыми, свойственными для конкретного добровольца, фазами альфа–потенциалов на процессы длительных перестроек фонового ритмогенеза головного мозга человека и скорость сенсомоторной реакции осуществлялся при одномоментном использовании двух усилителей биоэлектрической активности мозга человека. Для идентификации требуемого частотного диапазона и определения фазы для синхронизации визуального стимула в режиме “real time” применялся аналоговый восьмиканальный усилитель потенциалов «Биоскрипт БСТ-112» (Германия). Регистрирующиеся биопотенциалы с выхода БСТ-112 подавались на вход блока обработки параметров ЭЭГ и управления стимулирующими воздействиями (БОиУ).
Экзогенная афферентация подавалась в определенную фазу потенциала альфа-ритма, если БОиУ находил полное схождение характеристик (частота, амплитуда, фаза) потенциалов волн мозга с мгновенными значениями опорного синусоидального сигнала Баттерворда.
Регистрирующий электрод, используемый для регистрации фаз потенциалов альфа–ритма при управляемой от фазы сенсорной стимуляции (триггерной стимуляции), располагался над правой окципитальной областью (O2). Сенсорные экзогенные стимулы, представлявшие собой диффузные вспышки света продолжительностью в 50 мкс и с энергией 35 Дж, подавались на восходящей или нисходящей фазах биопотенциалов (в зависимости от этапа исследования), соответствующих индивидуально доминирующей частоте альфа–ритма. Необходимую частоту выявляли по результатам спектрального анализа 30-секундных эпох ЭЭГ, зафиксированных при помощи аналогового биоусилителя «БСТ-112». Далее сенсорный стимул подавался на восходящие или нисходящие фронты фаз потенциалов фоновых альфа–волн ЭЭГ человека с пороговым значением амплитуды альфа–волн не менее 100 мкВ. В итоге, каждому добровольцу предъявлялись порядка 100 стимулов с межстимульным интервалом не менее 2222 мс. В свою очередь, зрительные стимулы генерировались фотостимулятором «ФС-02», который размещался на уровне глаз добровольца, на расстоянии порядка 30 см, через подачу на вход последней пускового импульса от БОиУ, усиленного электростимулятором «ЭСЛ-2». Все исследования проводились в дневное время суток в слабо освещенной экранированной камере со звукоизоляцией. Все добровольцы во время регистрации электроэнцефалограммы находились в состоянии пассивного бодрствования с закрытыми глазами. Зрительные стимулы, представлявшие собой диффузные вспышки света длительностью 50 мкс и с энергией вспышки 35 Дж, предъявляли на восходящей или нисходящей фазах колебаний (в зависимости от этапа исследования), соответствующих индивидуально доминирующей частоте альфа–ритма. Задачей каждого добровольца являлось отреагировать на фазозависимый сенсорный стимул нажатием на кнопку.
При анализе электроэнцефалограмм, для каждого из отведений проводили спектральный анализ в диапазоне частот 0,5-35 Гц с шагом по частоте 4 Гц (спектральное окно 4 Гц) на основе алгоритма быстрого преобразования Фурье с целью вычисления абсолютных значений мощности (АЗМ) ритмов ЭЭГ для 3 функциональных проб: «фон» (состояние покоя с закрытыми глазами до стимуляции), «стимуляция» (на фоне стимуляции, синхронизированной с той или иной фазой альфа–волн), и «последействие» (состояние покоя после завершения стимуляции). В каждом из состояний анализировались 60-ти секундные эпохи, не содержащие артефактов физической и физиологической природы. Значения мощности частотных диапазонов (дельта–, тета–, альфа–, бета1–, бета2–), соответствующие пробам «стимуляция» и «последействие» сравнивались с аналогичными в состоянии «фон» по всем отведениям при помощи дисперсионного анализа one-way ANOVA (для проверки гипотез о различии между средними нескольких нормально распределенных случайных величин), с последующим применением апостериорных сравнений средних значений (критерий Тьюки) для анализа эффектов взаимодействий. Сравнение значений индексов мощности между пробами осуществляли по 1-факторной схеме, т.е. в качестве группирующего признака выступала функциональная проба (фон до стимуляции, стимуляция на восходящей или нисходящей фазе в отдельности, фон после). Все расчеты производились с использованием пакета прикладных программ Statistica 10.0. Результаты представлены в виде среднего арифметического значения и ошибки среднего (M±m).
Результаты исследований и их обсуждение
На начальном этапе обработки данных, полученных в ходе исследования влияния фазозависимой сенсорной стимуляции на параметры фонового ритмогенеза и скорость сенсомоторной реакции человека, нами осуществлялся мониторинг динамики показателей мощности ритмов ЭЭГ, регистрируемых во время состояние покоя до стимуляции, на фоне стимуляции, синхронизированной с восходящей фазой альфа–волны и в состоянии покоя после завершения стимуляции. Апостериорный сравнительный анализ средних значений мощности диапазонов показал, что, зрительные стимулы, синхронизированные с восходящей фазой альфа–волны, вызывали статистически значимое изменение мощности в альфа-частотном диапазоне по сравнению с фоном (Рис.1).
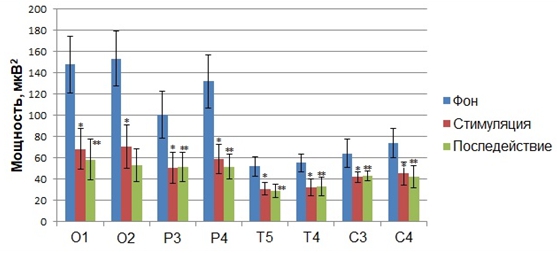
Рис. 1 – Статистически достоверные различия (p<0,05) значений (M±m) мощности альфа–ритма функциональных проб «стимуляция»* и «последействие»**, полученные в результате предъявления зрительных стимулов на восходящей фазе альфа–волн, по сравнению со значением мощности альфа–ритма «фона» до стимуляции
Примечание: по оси абсцисс обозначены отведения, в которых были зарегистрированы статистически достоверные различия значений мощности по сравнению с фоном до стимуляции
В частности, было установлено статистически достоверное снижение по сравнению с фоном показателя абсолютной мощности в альфа–частотном диапазоне электроэнцефалограмм всех обследуемых, зарегистрированных во время сенсорной стимуляции, подаваемой на восходящей фазе альфа–волн, в отведениях О1 (F(2, 63)=5,0293, p<0,00941), О2 (F(2, 63)=6,5900, p<0,00252), P3 (F(2, 63)= 6,5087, p<0,042887), P4 (F(2, 63)=6,0661, p<0,00390), Т4 (F(2, 63)= 5,8111, p<0,007887), T5 (F(2, 63)= 4,1202, p<0,039072), С3 (F(2, 63)=3,1921, p<0,032235), C4 (F(2, 63)= 3,7821, p<0,003502) (Рис. 6). Данный эффект сохранялся и после завершения сенсорной стимуляции на протяжении 1 минуты (Рис. 1).
Следующий этап обработки экспериментального материала заключался в сравнительном анализе показателей мощности ритмов ЭЭГ, зарегистрированных до стимуляции, с показателями мощности ритмов во время сенсорной стимуляции, синхронизированной с нисходящей фазой альфа–волны. Апостериорный сравнительный анализ средних значений мощности диапазонов показал, что кратковременные вспышки света, синхронизированные с нисходящей фазой альфа–волны, вызывали статистически значимые изменения мощности в тета- и альфа–частотных диапазонах по сравнению с фоном. В результате было установлено, что зрительные стимулы, подаваемые на нисходящей фазе альфа-волн, приводили к росту показателя мощности частот тета- и альфа–ритмов по сравнению с фоном.
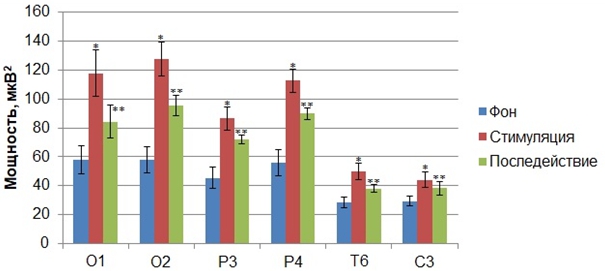
Рис. 2 – Статистически достоверные различия (p<0,05) значений (M±m) мощности альфа–ритма (Б) функциональных проб «стимуляция»* и «последействие»**, полученные в результате предъявления зрительных стимулов на нисходящей фазе альфа–волн, по сравнению со значением мощности альфа–ритма «фона» до стимуляции
Примечание: по оси абсцисс обозначены отведения, в которых были зарегистрированы статистически достоверные различия значений мощности по сравнению с фоном до стимуляции
Так, было установлено статистически достоверное увеличение по сравнению с фоном показателя абсолютной мощности в альфа–частотном диапазоне электроэнцефалограмм всех обследуемых, зарегистрированных во время сенсорной стимуляции, подаваемой на нисходящей фазе альфа–волн, в отведениях О1 (F(2, 63)=5,7239, p<0,00520), О2 (F(2, 63)=6,7702, p<0,00217), P3 (F(2, 63)=3,2374, p<0,04589), P4 (F(2, 63)=3,8227, p<0,02711), T6 (F(2, 63)=5,3853, p<0,00693), С3 (F(2, 63)=4,5024, p<0,024855)(Рис. 7). Данный эффект сохранялся и после завершения сенсорной стимуляции на протяжении 1 минуты (Рис. 2). В результате было установлено, что зрительные стимулы, подаваемые на нисходящей фазе альфа-волн, приводили к снижению мощности частот тета-ритма в электрограммах мозга, зарегистрированных во время стимуляции по сравнению с фоновыми показателями мощности. Статистически значимым это снижение было в отведениях С4 и T3. При этом значения мощности, зарегистрированные во время сенсорной стимуляции, подаваемой на нисходящей фазе альфа–волн, статистически достоверно снижались по сравнению с фоном. В частности данный рост мощности был зафиксирован в отведениях С4 (F(2, 63)=2,510, p<0,027124) (39,61±3,77) и Т3 (F(2, 63)= 6,522 p<0,028218) (20,93±1,890) по сравнению с фоновыми показателями в отведениях С4 (28,80±2,61) и Т3 (15,46±1,50).
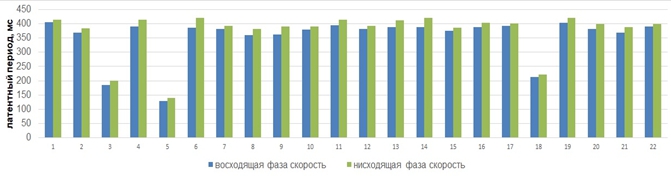
Последующий этап обработки экспериментального материала заключался в сравнительном анализе показателей латентных периодов сенсомоторных реакций добровольцев в ответ на фазозависимую фотовспышку. В наших исследованиях было установлено, что более длительный латентный период сенсомоторной реакции человека коррелирует с нисходящей фазой потенциала альфа-волны (Рис. 3).
Рис. 3 – Латентные периоды сенсомоторной реакции всех добровольцев, включенных в группу анализа, в зависимости от фазы предъявления стимула
В частности, было установлено, что латентный период сенсомоторной реакции зависит от фазы потенциала альфа-волны. Латентный период сенсомоторной реакции человека короче, если экзогенный стимул предъявляется в восходящую фазу альфа-волны (рис.4) по сравнению с реакцией в ответ на стимул, подаваемый в нисходящую фазу потенциала альфа-волны (T (2,079614)= -10,3252, df=21) (Рис.4).
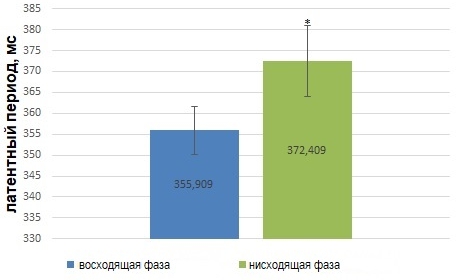
Рис. 4 – Статистически достоверные различия (p<0,05) значений (M±m) латентного периода сенсомоторной реакции в ответ на фазозависимую сенсорную стимуляцию
Примечание:по оси абсцисс обозначены фаза альфа-волны, в которую были поданы фотостимулы; * - статистически дотоверные отличия группового показателя латентного периода сенсомоторной реакции в ответ на подачу стимула в нисходящую фазу альфа-волны, по сравнению с латентным периодом сенсомоторной реакции в ответ на стимул, предъявленный в нисходящую фазу
Результаты настоящего исследования показали наличие фазозависимого влияния сенсорной стимуляции, синхронизованной с восходящей или нисходящей фазами индивидуально доминирующих альфа-колебаний, на выраженность в ЭЭГ частот альфа- и тета-диапазонов. При этом синхронизация кратковременного сенсорного стимула с восходящей фазой альфа-волны приводит к снижению по сравнению с фоном показателя абсолютной мощности в альфа–частотном диапазоне электроэнцефалограмм всех обследуемых в париетально-окципитальных и темпарально-центральных отделах коры (Рис.1). Наконец, стимуляция, синхронизованная с нисходящей фазой фоновых альфа-волн, приводит к повышению в ЭЭГ мощности альфа-ритма (Рис.2) и одновременно – понижению мощности тета–ритма. Важно отметить, что подача стимула в нисходящую фазу альфа-волны примечательна тем, что эффект после такого рода стимуляции является пролонгированным и наблюдается не только на фоне редко (с интервалами 2 с и более) подаваемых зрительных стимулов, но и в течение десятков секунд и минут после прекращения стимуляции. Установленная в наших исследованиях зависимость латентного периода сенсомоторной реакции человека от фазы потенциала альфа-волны согласуется с данными [18], [19]. Согласно результатам нашего исследования, короткий латентный период сенсомоторной реакции человека коррелирует с восходящей фазой потенциала альфа-волны.
Таким образом, различное фазозависимое влияние сенсорной стимуляции на параметр мощности фонового альфа-ритма очевидно свидетельствует об его пейсмекерном кортикальном происхождении. На это дополнительно указывает еще и тот факт, что динамика мощности, зависимая от фазы предъявления стимула, не находит своего логического объяснения в рамках парадигмы нейросетевой синаптической организации альфа-активности. Кроме того, наши исследования доказывают зависимость эффективности обработки сенсорной информации в головном мозге от фазы эндогенного альфа-ритма, которая соответствует активности тех или иных катионных мембранных каналов пейсмекерных корковых нейронов. Так, стимул, приходящийся на восходящую фазу колебаний эндогенного потенциала пейсмекерного нейрона, с учетом времени [19] (30-50 мс) прохождения импульса от рецептора к корковому представительству, приходится на фазу «открытых» низкопороговых Ca2+ и, в последующем – Na+-каналов пейсмекерных клеток. Последнее тормозит пейсмекерную активность нейронов, что приводит к «срыву» альфа-ритма. Напротив, стимул, приходящийся на нисходящую фазу колебаний эндогенного потенциала пейсмекерного нейрона, т.е. на фазу «открытых» K+-каналов, которые активируются гиперполяризацией нейронной мембраны пейсмекеров, приводит, в конечном итоге, к повышению мощности альфа-ритма в период стимуляции и развитию пролонгированного эффекта последействия, длящегося минуты.
Следовательно, от состояния мембранных H-каналов нейронов зависит процесс обработки сенсорной информации, т.к. именно этот класс ионных каналов обеспечивает как дендритную интеграцию, фасилитацию синаптической трансмиссии, так и генерацию ритмической активности на уровне той или иной структуры [21], [22].
Резюмируя все вышесказанное, можно заключить, что разработанный нами метод синхронизации сенсорной стимуляции с разными фазами потенциалов фоновой ритмической активности позволяет, во-первых, исследовать нейрофизиологические механизмы обработки информации мозгом, во-вторых, организовать целенаправленное управление амплитудно-частотными параметрами активности мозга, а значит, его функциональным состоянием, что является чрезвычайно важным с биомедицинской точки зрения.
| Финансирование Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-315-00201. | Funding The reported study was funded by RFBR according to the research project № 18-315-00201. |
| Конфликт интересов Не указан. | Conflict of Interest Not specified. |
Список литературы / References
- VanRullen R. Is perception discrete or continuous? / VanRullen R., Koch C. // Trends Cogn. Sci. 2003.V.7. P. 207–213.
- VanRullen R. Perceptual echoes at 10 Hz in the human brain / VanRullen R., Macdonald J. Curr. Biol. 2012. V. 22. P. 995–999.
- Bishop G. Cyclic changes in excitability of the optic pathway of the rabbit / Bishop G. J. Physiol. 1933. V. 103. P. 213.
- Lakatos P. Entrainment of neuronal oscillations as a mechanism of attentional selection / Lakatos P. Science. 2008. V. 320. P. 110–113.
- Klimesch W. Alpha-band oscillations, attention, and controlled access to stored information / Klimesch W. // Trends in Cognitive Sciences. 2012. V. 16. № 12. P. 606-617.
- Surwillo W. W. The relation of decision time to brain wave frequency and to age. Electroenceph. clin. Neurophysiol / Surwillo W. W. 1964. 16. Р. 510–514.
- Bartley S.H. Some factors in brightness discrimination / Bartley S.H. // Psychol. Rev. 1939. 46. Р. 337-358.
- Boddy J. The relationship of reaction time to brain wave period: a re-evaluation. Electroenceph. clin. Neurophysiol / Boddy J.1971. 30. Р. 229-235.
- Dugue L. The phase of ongoing oscillations mediates the causal relation between brain excitation and visual perception / Dugue L. J. Neurosci. 2011. V. 31. P. 11889–11893.
- Romei V. Sounds reset rhythms of visual cortex and corresponding human visual perception / Romei V., Gross J., Thut G. Curr. Biol. 2012. V. 22. P. 807–813.
- Mathewson K.E. To see or not to see: prestimulus alpha phase predicts visual awareness / Mathewson K.E., Gratton G., Fabiani M. et al. J. Neurosci. 2009. 29. Р. 2725–2732.
- Naruse Y. Phase shifts in alpha-frequency rhythm detected in electroencephalograms influence reaction time / Naruse Y. Takiyama K. Okada M. et al. // Neural Networks. 2015 V. 62. P. 47–51.
- Шевелев И.А. Волновые процессы в зрительной коре. Природа / Шевелев И.А. 2001. №12. C. 28-35.
- Dustman R.E. Phase of alpha brain waves, reaction-time and visually evoked potentials. Electroenceph. / Dustman R.E., Beck E.C. Сlin. Neurophysiol. 1965. 18. Р. 433-440.
- Neuling T. Good vibrations: Oscillatory phase shapes perception NeuroImage / Neuling T., Rach S., Wagner S. et al. 2012. V. 63. P. 771–778.
- Kruglikov S. Y.Interplay of Electroencephalogram phase and auditory-evoked neural activity / Kruglikov S. Y., Schiff S.J. // The journal of Neuroscience. 2003. V. 23. P. 10122.
- Barry R.J. Age and gender effects in EEG coherence. I. Developmental trends in normal children. / Barry R.J., Clarke A.R., Mc Carthy R. et al. // Clinical Neurophysiology. 2004. 115. Р. 2252–2258.
- Callaway E.I. Relationship between reaction time and electroencephalographic alpha phase / Callaway E.I., Yeager C.L.// Science. 1960. V. 132. №. 3441. P. 1765–1766.
- Drewes J. This is the rhythm of your eyes: the phase of ongoing electroencephalogram oscillations modulates saccadic reaction time / Drewes J., VanRullen R. // J. Neurosci. 2011. V. 31. №. 12. P. 4698–4708.
- Гусельников В.И. Электрофизиология головного мозга / Гусельников В.И. М: Высшая школа. – 423 с. [in Russian]
- Сухов А.Г. Особенности посттетанической модификации синаптической передачи в таламо-кортикальном входе соматосенсорной коры крыс / Сухов А.Г., Бездудная Т.Г., Медведев Д.С. Журн. высш. нерв. деят. 2003. 53 (5): 622-632. [in Russian]
- Biel M. Hyperpolarization-Activated Cation Channels: From Genes to Function. Physiol / Biel M., Wahl-Schott C., Michalakis S., Zong X. 2009. 89: 847–885.
Список литературы на английском языке / References in English
- VanRullen R. Is perception discrete or continuous? / VanRullen R., Koch C. // Trends Cogn. Sci. 2003.V.7. P. 207–213.
- VanRullen R. Perceptual echoes at 10 Hz in the human brain / VanRullen R., Macdonald J. Curr. Biol. 2012. V. 22. P. 995–999.
- Bishop G. Cyclic changes in excitability of the optic pathway of the rabbit / Bishop G. J. Physiol. 1933. V. 103. P. 213.
- Lakatos P. Entrainment of neuronal oscillations as a mechanism of attentional selection / Lakatos P. Science. 2008. V. 320. P. 110–113.
- Klimesch W. Alpha-band oscillations, attention, and controlled access to stored information / Klimesch W. // Trends in Cognitive Sciences. 2012. V. 16. № 12. P. 606-617.
- Surwillo W. W. The relation of decision time to brain wave frequency and to age. Electroenceph. clin. Neurophysiol / Surwillo W. W. 1964. 16. Р. 510–514.
- Bartley S.H. Some factors in brightness discrimination / Bartley S.H. // Psychol. Rev. 1939. 46. Р. 337-358.
- Boddy J. The relationship of reaction time to brain wave period: a re-evaluation. Electroenceph. clin. Neurophysiol / Boddy J.1971. 30. Р. 229-235.
- Dugue L. The phase of ongoing oscillations mediates the causal relation between brain excitation and visual perception / Dugue L. J. Neurosci. 2011. V. 31. P. 11889–11893.
- Romei V. Sounds reset rhythms of visual cortex and corresponding human visual perception / Romei V., Gross J., Thut G. Curr. Biol. 2012. V. 22. P. 807–813.
- Mathewson K.E. To see or not to see: prestimulus alpha phase predicts visual awareness / Mathewson K.E., Gratton G., Fabiani M. et al. J. Neurosci. 2009. 29. Р. 2725–2732.
- Naruse Y. Phase shifts in alpha-frequency rhythm detected in electroencephalograms influence reaction time / Naruse Y. Takiyama K. Okada M. et al. // Neural Networks. 2015 V. 62. P. 47–51.
- Shevelev I.A. Volnovye processy v zritel'noj kore. Priroda [Wave processes in the visual cortex. Nature] / Shevelev I.A. 2001. No. 12. P. 28-35. [in Russian]
- Dustman R.E. Phase of alpha brain waves, reaction-time and visually evoked potentials. Electroenceph. / Dustman R.E., Beck E.C. Сlin. Neurophysiol. 1965. 18. Р. 433-440.
- Neuling T. Good vibrations: Oscillatory phase shapes perception NeuroImage / Neuling T., Rach S., Wagner S. et al. 2012. V. 63. P. 771–778.
- Kruglikov S. Y.Interplay of Electroencephalogram phase and auditory-evoked neural activity / Kruglikov S. Y., Schiff S.J. // The journal of Neuroscience. 2003. V. 23. P. 10122.
- Barry R.J. Age and gender effects in EEG coherence. I. Developmental trends in normal children. / Barry R.J., Clarke A.R., Mc Carthy R. et al. // Clinical Neurophysiology. 2004. 115. Р. 2252–2258.
- Callaway E.I. Relationship between reaction time and electroencephalographic alpha phase / Callaway E.I., Yeager C.L.// Science. 1960. V. 132. №. 3441. P. 1765–1766.
- Drewes J. This is the rhythm of your eyes: the phase of ongoing electroencephalogram oscillations modulates saccadic reaction time / Drewes J., VanRullen R. // J. Neurosci. 2011. V. 31. №. 12. P. 4698–4708.
- Guselnikov V.I. Elektrofiziologiya golovnogo mozga [Electrophysiology of the brain] / Guselnikov V.I. M: High school. - 423 p. [in Russian]
- Sukhov A.G. Osobennosti posttetanicheskoj modifikacii sinapticheskoj peredachi v talamo-kortikal'nom vhode somatosensornoj kory krys [Features of post-tetanic modification of synaptic transmission in the thalamo-cortical inlet of rat somatosensory cortex] / Sukhov A.G., Bezdudnaya T.G., Medvedev D.S. Zhurn. higher nerve. activist 2003.53 (5): 622-632. [in Russian]
- Biel M. Hyperpolarization-Activated Cation Channels: From Genes to Function. Physiol / Biel M., Wahl-Schott C., Michalakis S., Zong X. 2009. 89: 847–885.