ИММУНОХРОМАТОГРАФИЧЕСКИЙ АНАЛИЗ ДЛЯ ВЫЯВЛЕНИЯ СТАФИЛОКОККОВОГО ЭНТЕРОТОКСИНА ТИПА В С ИСПОЛЬЗОВАНИЕМ БИФУНКЦИОНАЛЬНЫХ НАНОЧАСТИЦ ЗОЛОТА
ИММУНОХРОМАТОГРАФИЧЕСКИЙ АНАЛИЗ ДЛЯ ВЫЯВЛЕНИЯ СТАФИЛОКОККОВОГО ЭНТЕРОТОКСИНА ТИПА В С ИСПОЛЬЗОВАНИЕМ БИФУНКЦИОНАЛЬНЫХ НАНОЧАСТИЦ ЗОЛОТА
Научная статья
Третьяков С.И.1, *, Ярков С.П.2
1, 2 Государственный научно-исcледовательский институт биологического приборостроения Федерального медико-биологического агентства, Москва, Россия
* Корреспондирующий автор (diasol[at]dol.ru)
АннотацияЦелью исследования явилось изучение возможности повышения чувствительности иммунохроматографического анализа (ИХА), используя для этого бифункциональные конъюгаты наночастиц коллоидного золота (НКЗ), способные связываться с антигенными эпитопами аналита и вступать в реакцию биотин-стрептавидин.
Экспериментально изучена возможность применения бифункциональных конъюгатов НКЗ в ИХА для выявления стафилококкового энтеротоксина типа В (СЭБ). Исследованы варианты повышения заметности аналитической зоны теста, а, следовательно, и чувствительности выявления аналита, за счет образования агрегатов конъюгатов НКЗ. Использовали бифункциональный конъюгат НКЗ и моноклональных биотинилированных антител (НКЗ-S222-биотин), а также дополнительные конъюгаты со стрептавидином (НКЗ-стрептавидин), и биотином (НКЗ-БСА-биотин). Конъюгаты НКЗ-S222-биотин, избирательно связываются с антигенными эпитопами СЭБ, образуя иммунные комплексы, а дополнительные конъюгаты, за счет взаимодействия биотин-стрептавидин, образуют агрегаты НКЗ большого размера, которые усиливают заметность аналитической зоны иммунохроматографического теста.
Вывод. Чувствительность выявления СЭБ при применении дополнительного коньюгата НКЗ со стрептавидином составила 2,5 нг/мл при приборной регистрации, и 12,5 нг/мл при визуальной, что в 2,0 и 1,3 раза выше по сравнению с обычным тестом, не использующим взаимодействие биотин-стрептавидин. Компоновка мембран с нанесенными реагентами и помещенными в стандартную оправу для иммунохроматографических тестов обеспечивает одностадийный анализ, длительностью 25 мин, без внесения дополнительных реагентов.
Ключевые слова: иммунохроматография, увеличение чувствительности, бифункциональные наночастицы коллоидного золота, стафилококковый энтеротоксин типа В.
LATERAL FLOW TEST FOR THE DETECTION OF STAPHYLOCOCCAL ENTEROTOXIN TYPE B USING BIFUNCTIONAL GOLD NANOPARTICLES
Research article
Tretyakov S.I.1, *, Yarkov S.P.2
1, 2 State Research Institute of Biological Instrumentation of the Federal Medical and Biological Agency, Moscow, Russia
* Corresponding author (diasol[at]dol.ru)
AbstractThe aim of the study was to examine the possibility of increasing the sensitivity of the lateral flow test (LFT) using bifunctional conjugates of colloidal gold nanoparticles (CGN) capable of binding to antigenic epitopes of the analyte and undergo the biotin-streptavidin reaction.
The article examines the possibility of using bifunctional conjugates of bifunctional conjugates of colloidal gold nanoparticles in LFT for the detection of staphylococcal enterotoxin type B (SEB). The variants of increasing the visibility of the analytical zone of the test, and, consequently, the sensitivity of detecting the analyte, due to the formation of aggregates of CGN conjugates are investigated. The study uses a bifunctional conjugate of CGN and monoclonal biotinylated antibodies (CGN-S222-biotin), as well as additional conjugates with streptavidin (CGN-streptavidin), and biotin (CGN-BSA-biotin). CGN-S222-biotin conjugates selectively bind to SEB antigenic epitopes forming immune complexes, while the additional conjugates, due to the interaction of biotin-streptavidin, form large-sized CGN aggregates that enhance the visibility of the analytical zone of the lateral flow test.
Conclusion. The sensitivity of SEB detection when using an additional CGN conjugate with streptavidin was 2.5 ng/ml for instrument registration, and 12.5 ng/ml for visual registration, which is 2.0 and 1.3 times higher compared to the usual test that does not use the biotin-streptavidin interaction. The arrangement of membranes with reagents applied and placed in a standard frame for LFT provides a one-stage analysis, lasting 25 minutes, without adding additional reagents.
Keywords: Immunochromatography, sensitivity enhancement, bifunctional colloidal gold nanoparticles, staphylococcal enterotoxin type B.
ВведениеИммунохроматографический анализ является эффективным решением как для обнаружения веществ-маркеров для диагностики заболеваний, так и для выявления патогенных микроорганизмов и токсинов во внешней среде, поскольку позволяет получить результаты анализа за 15-25 мин и проходит в одну стадию. За счет простоты процедуры ИХА легко адаптируется для внелабораторных (полевых) анализов, позволяя проводить его лицам без специального медико-биологического образования.
Зачастую аналиты присутствуют в исследуемых пробах в концентрациях, выходящих за пределы чувствительности традиционного формата ИХА, что не позволяет их обнаружить. Это побуждает исследователей искать пути повышения чувствительности анализа, сохраняя его положительные свойства – малое время проведения и относительную простоту процедуры. Приемами увеличения чувствительности ИХА тестов являются: увеличение полезного сигнала за счет использования НКЗ большого размера (45 нм), применения аутометаллографии для увеличения размеров НКЗ за счет осаждения атомов серебра или золота на сформировавшихся иммунных комплексах, либо увеличение количества окрашенных маркерных частиц в иммунных комплексах, формирующихся в аналитической зоне иммунохроматографического теста [1], [2], [3]. Почти всегда это требует дополнительных стадий при проведении анализа. Увеличение размера и количества маркерных частиц обычно увеличивает чувствительность теста [4], [5]. Использование в анализе конъюгатов НКЗ с биотинилированными иммуноглобулинами и стрептавидин-биотинового взаимодействия приводит к созданию пространственных структур (агрегатов НКЗ) большого размера, что также увеличивает чувствительность ИХА теста, как это было показано на примере ИХА для выявления прокальцитонина [6].
В работе [7] предложено использовать НКЗ, конъюгированные с биотин-меченными специфическими иммуноглобулинами к белку прокальцитонину, а также два дополнительных конъюгата НКЗ, первый- с биотиновыми молекулами на поверхности частиц золя, второй - с молекулами стрептавидина. Комбинация этих конъюгатов приводит к образованию агрегатов НКЗ и, следовательно, к усилению интенсивности окрашивания аналитической зоны теста. Дизайн теста позволяет располагать все конъюгаты в сухом виде на подложках, тем самым обеспечивая проведение анализа в одну стадию без внесения дополнительных реагентов и дополнительных манипуляций. Показано 30-кратное повышение чувствительности выявления прокальцитонина при фотометрической детекции и 10-кратное увеличение при визуальной, по сравнению с традиционным форматом иммунохроматографических тестов на прокальцитонин. Авторами было высказано предположение, что подобный подход является универсальным и позволит увеличить чувствительность иммунохроматографических тестов для других аналитов.
Представило интерес проверить универсальность подхода, предложенного в работе [7], на других аналитах, в частности при выявлении белкового токсина - стафилококкового энтеротоксина типа В, являющегося маркером при диагностике пищевых отравлений.
Материалы и принципы исследования
При проведении экспериментов использовали нитроцеллюлозные мембраны CNPE-SN12 (MDI, Индия) с эффективным диаметром пор 10 мкм. Применяли моноклональные антитела S643 и S222 к СЭБ производства АО «ВНЦМДЛ» (Россия), поликлональные антитела (ПКА) козы против иммуноглобулинов мыши получали от ООО «Имтек» (Россия). Препарат СЭБ был получен из ГНЦ ПМиБ Роспотребнадзора.
На мембрану CNPE-SN12 в аналитическую зону наносили МКА S643 против СЭБ в концентрации 3,3 мг/мл с нагрузкой 0,08 мкл/мм, в контрольную зону мембраны наносили поликлональные ПКА козы против иммуноглобулинов мыши, в концентрации 2,0 мг/мл с нагрузкой на мембрану 0,08 мкл/мм.
Для синтеза всех конъюгатов НКЗ с белками использовали золь золота, полученный цитратным восстановлением золотохлористоводородной кислоты [8], [9]. Длина волны в максимуме спектра поглощения препарата золя λ=519 нм.
Биотинилирование МКА S222. Для биотинилирования МКА S222 производили замену буфера хранения антител на 1 М карбонат-бикарбонатный буфер (КББ) рН 9,6 с помощью концентратора Vivaspin, (Sartorius VS0101 кат № Z614025-25EA). Условия центрифугирования - х10 000g. Проводили 3 сеанса центрифугирования по 10 мин, каждый раз добавляя 400-500 мкл свежего КББ. В реакцию брали 1 мл МКА S222 в концентрации 1 мг/мл в 1М КББ рН 9,6. В качестве биотинилирующего агента использовали 3 мг/мл раствор в ДМСО биотинамидогексановой кислоты N-гидроксисукцинимидного эфира (Sigma-Aldrich, кат. № В2643). Реакцию биотинилирования проводили при постоянном перемешивании, внося 66 мкл раствора биотинилирующего агента в ДМСО к 1 мл раствора антител в КББ. Внесение раствора биотинилирующего агента осуществляли порциями по 5 мкл, с интервалами 20-30 с. Реакционную смесь оставляли при комнатной температуре и перемешивании на 4 ч. Затем заменяли КББ в реакционной смеси на 0,05М ФБ рН 7,2 при помощи концентратора Vivaspin, центрифугируя при х10 000g 3 раза по 10 мин, каждый раз добавляя 400-500 мкл свежего 0,05М фосфатного буфера) ФБ рН 7,2.
Биотинилирование БСА. Реакцию биотинилирования БСА проводили аналогично биотинилированию МКА S222. Навеску 10 мг БСА (Sigma-Aldrich, кат. № А3059) растворяли в КББ рН 9,6, затем разбавляли до концентрации 1,0 мг/мл. Далее процесс биотинилирования проводили, как описано выше.
Получение конъюгатов. Все конъюгаты НКЗ с белками получали согласно рекомендациям Hermanson [10]. При получении конъюгата с МКА S222, (НКЗ-S222) нагрузка по антителам, определенная из кривой флокулляции золя, составила 15 мкг/мл золя, OD= 1,5 е.о.п. Далее конъюгат наносили на конъюгатную подложку из расчета 60 мкл/см.
Конъюгат НКЗ с биотинилированными антителами МКА S222 (НКЗ-S222-биотин) получали аналогично конъюгату НКЗ с нативными МКА S222.
Конъюгат НКЗ со стрептавидином получали с нагрузкой 10 мкг стрептавидина на 1 мл золя золота. Использовали рекомбинантный стрептавидин (ООО «Имтек», Россия, кат. № E. Avs).
Получение конъюгата НКЗ с биотином. Поскольку биотин, как низкомолекулярное вещество, не может быть конъюгирован с НКЗ напрямую, вначале биотинилировали БСА как описано выше, а затем получали конъюгат (НКЗ-БСА-биотин) аналогично получению конъюгатов НКЗ-S222 и НКЗ-S222-биотин. Нагрузка белка на золь составила 6,0 мкг/мл.
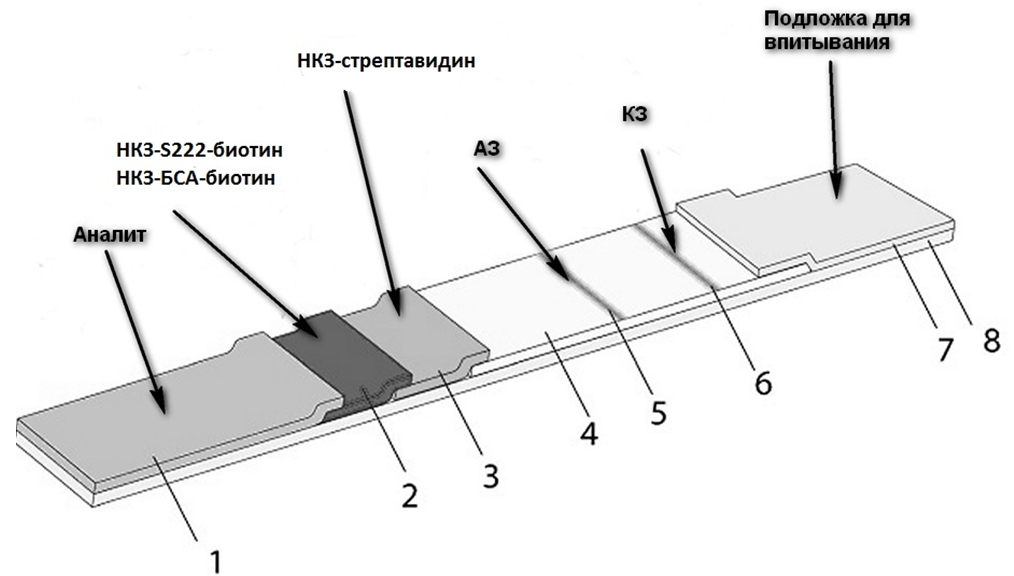
Получение мультимембранного композита и проведение анализа. На рисунке 1 приведена схема мультимембранного композита для выявления СЭБ методом ИХА. Собранный мультимембранный композит помещали в стандартную пластиковую оправу (MDI, Индия) с отверстиями для наблюдения результата и внесения анализируемого образца.
Анализ проводили при комнатной температуре. Объем анализируемого раствора СЭБ в буфере анализа составлял 140 мкл. В качестве буфера анализа использовали 0,1 ФБ рН 7,8, содержащий 0,25% БСА и 0,4% Твин-20. Регистрировали результаты спустя 25 мин. Связывание метки в аналитической зоне теста регистрировали визуально и с помощью видеоцифрового анализатора иммунохроматограмм Рефлеком (Россия, Синтэко-комплекс). Минимальная концентрация аналита, при которой было заметно глазом окрашивание полосы в аналитической зоне, принималась за чувствительность теста при визуальной регистрации, что соответствовало 0,6 усл. ед. показаний анализатора иммунохроматограмм. Для построения зависимостей сигнала прибора от концентрации аналита брали среднее из пяти измерений. За чувствительность теста при приборной регистрации принимали концентрацию аналита, при которой интенсивность окрашивания аналитической зоны в три раза превышала стандартное отклонение для величины «холостого» опыта в отсутствие аналита.
Рис. 1 – Схема тест-полоски для выявления СЭБ:
1 – подложка для нанесения (впитывания) образца; 2 – стекловолоконная подложка для нанесения конъюгатов НКЗ с иммунокомпонентами; 3 – стекловолоконная подложка для нанесения конъюгатов НКЗ-стрептавидин; 4 – нитроцеллюлозная аналитическая мембрана; 5 – аналитическая зона теста с нанесенными МКА S643; 6 – контрольная зона теста с козьими антителами против антител мыши; 7 – впитывающая подложка; 8 – полимерная подложка, обеспечивающая жесткость сборки
Основные результатыВзаимную проверку реакционной способности конъюгата НКЗ со стрептавидином и МКА S222-биотин осуществляли, пропуская раствор конъюгата по аналитической мембране, на которую предварительно наносили точки, объемом 0,5 мкл биотинилированных МКА S222-biotin в концентрации 1,5 мг/мл. Мембрану сушили 12 ч при комнатной температуре. Затем на мембрану апплицировали подложку с конъюгатом НКЗ-стрептавидин и OD=1,0 е.о.п. Сборку мембран в вертикальном положении помещали в лунку планшета для иммуноферментного анализа, содержащего 200 мкл буфера анализа (БА). По мере продвижения фронта жидкости на мембране наблюдалось яркое окрашивание нанесенных точек антител за счет образования комплекса НКЗ-стрептавидин и биотинилированных антител. Аналогично контролировали эффективность биотинилирования БСА, при получении комплекса БСА-биотин. При этом на мембрану наносили точку, объемом 0,5 мкл раствора стрептавидина в концентрации 1,0 мг/мл.
Сохранение иммунохимических свойств МКА S222-биотин по связыванию с СЭБ, доказывали, получив конъюгат НКЗ-S222-биотин (OD=2,0 е.о.п.) и небиотинилированные конъюгаты НКЗ-S222 (OD=1,5 е.о.п.) с одинаковой нагрузкой - 15 мкг/мл золя. Конъюгаты наносили и высушивали на стекловолоконных подложках и затем собирали мультимембранный композит. В обоих случаях при анализе раствора с концентрацией 30 нг/мл СЭБ интенсивность окрашивания полосы в аналитической зоне составляла 0,7 и 1,1 усл. ед., через 25 мин с начала анализа.
Рассматривались три варианта построения иммунохроматографической тест-системы:
Вариант I. Обычный тест на СЭБ в «сэндвич» формате, свойства которого описаны нами ранее в работе [3];
Вариант II. Тест c НКЗ-стрептавидин, в котором на мембрану 2 теста (рисунок 1) наносили конъюгаты НКЗ-S222-биотин, а на мембрану 3 конъюгат НКЗ-стрептавидин.
Вариант III. Тест c НКЗ-стрептавидин, в котором на мембрану 2 (рисунок 1) дополнительно к НКЗ-S222-биотин наносили конъюгат НКЗ-БСА-биотин. Состав исследуемых тестов представлен в таблице 1.
Таблица 1 – Состав тестов для выявления СЭБ
| Обозначе-ние варианта теста | Наименование конъюгатов НКЗ | Оптическая плотность конъюгата (OD), е.о.п. | Нагрузка золя НКЗ по белку, мкг/мл | Соотно-шение конъюгатов НКЗ | Чувствительность*, нг/мл |
| Вариант I | НКЗ-S222 | 1,5 | 15,0 | - | 16,0/5,0 |
| Вариант Iа | НКЗ-S222-биотин | 2,0 | 15,0 | - | 25,0/5,0 |
| Вариант II | НКЗ-S222-биотин НКЗ-стрептавидин | 2,0 0,25 | 15,0 10,0 | 1:0,125 | 12,5/2,5 |
| Вариант III | НКЗ-S222- биотин НКЗ-БСА-биотин НКЗ-стрептавидин | 1,0 1,0 0,25 | 15,0 6,0 10 | 1:1:0,250 | 30/12,5 |
| Вариант III | НКЗ-S222-биотин НКЗ-БСА-биотин НКЗ-стрептавидин | 2,0 2,0 0,25 | 15,0 6,0 0,25 | 1:1:0,125 | 30/12,5 |
Зависимость интенсивности окрашивания аналитической зоны тестов от концентрации СЭБ при сочетании различных конъюгатов приведены на рисунках 2 и 3.
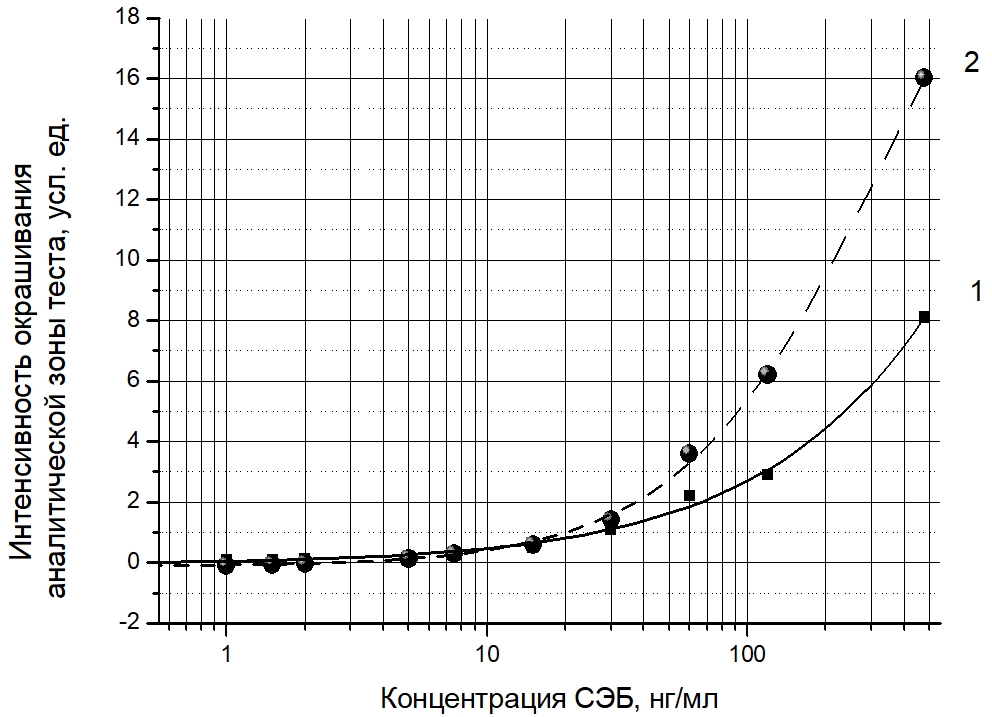
Рис. 2 – Графики зависимости интенсивности окрашивания аналитической зоны теста от концентрации СЭБ:
1 – тест с использованием конъюгата НКЗ-S222; 2 – тест с использованием конъюгатов НКЗ-S222-биотин и НКЗ-стрептавидин
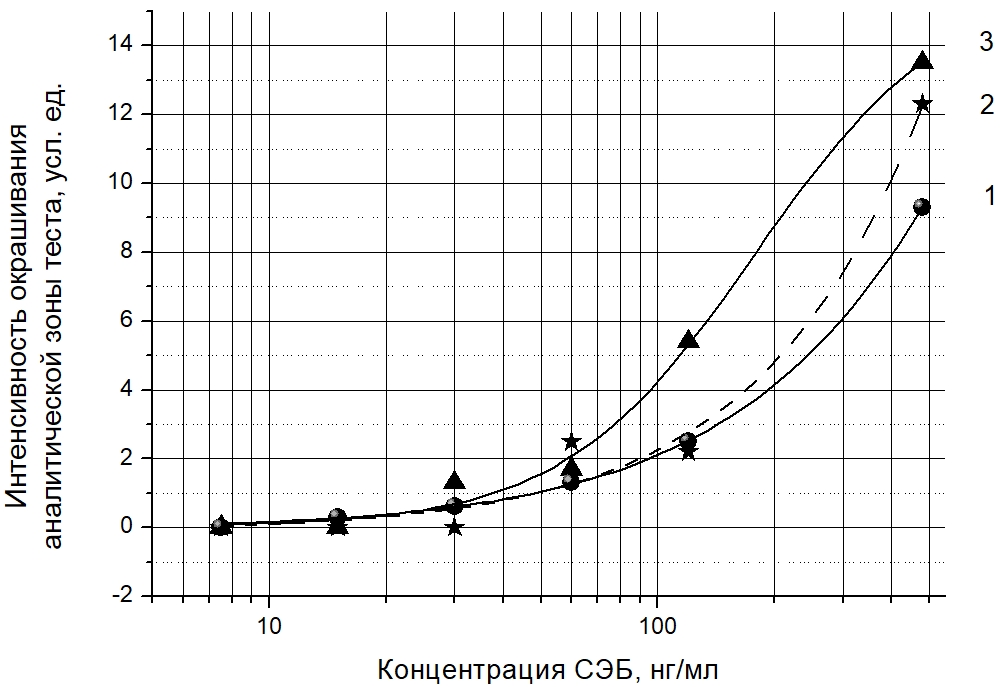
Рис. 3 – Графики зависимости интенсивности окрашивания аналитической зоны теста от концентрации СЭБ:
1 – тест с использованием конъюгата НКЗ-S222-биотин; 2, 3 – тесты с использованием конъюгата НКЗ-S222-биотин, в присутствии дополнительных конъюгатов НКЗ-БСА-биотин, НКЗ-стрептавидин
Примечание: кривая 2 - соотношение компонентов 1:1:0,250, кривая 3 - соотношение компонентов 1:1:0,125
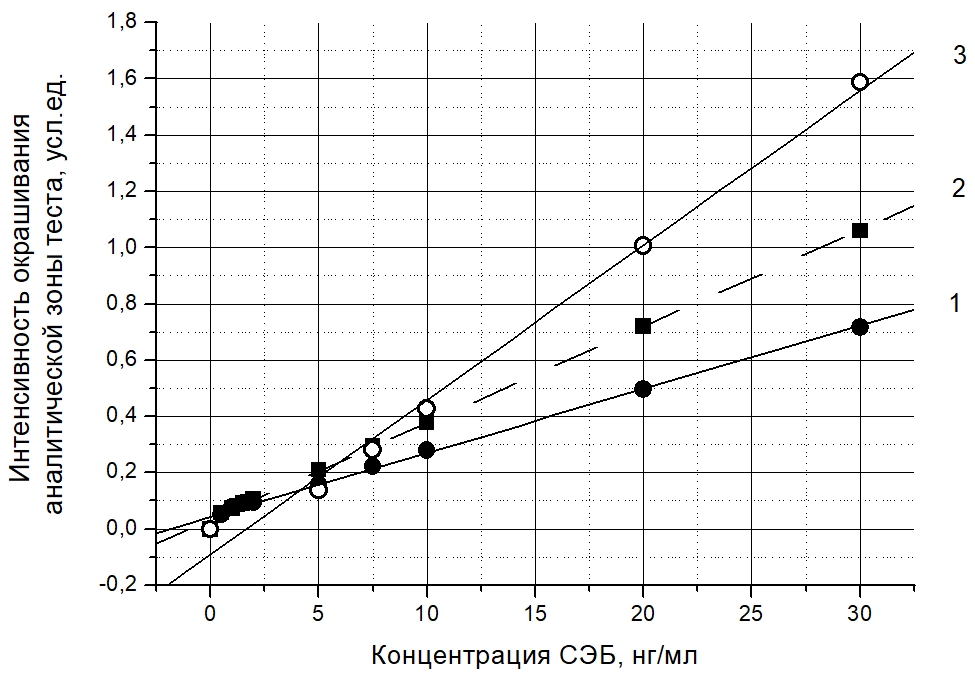
В области малых концентраций (˂ 30 нг/мл) графики зависимостей, близки к линейным (рисунок 4).Рис. 4 – Графики зависимости интенсивности окрашивания аналитической зоны теста от концентрации СЭБ при использовании сочетаний конъюгатов НКЗ в области малых концентраций:
1 – тест с использованием конъюгата НКЗ-S222-биотин; 2 – тест с использованием конъюгата НКЗ-S222; 3 – тест с использованием конъюгатов НКЗ-S222-биотин, НКЗ-стрептавидин
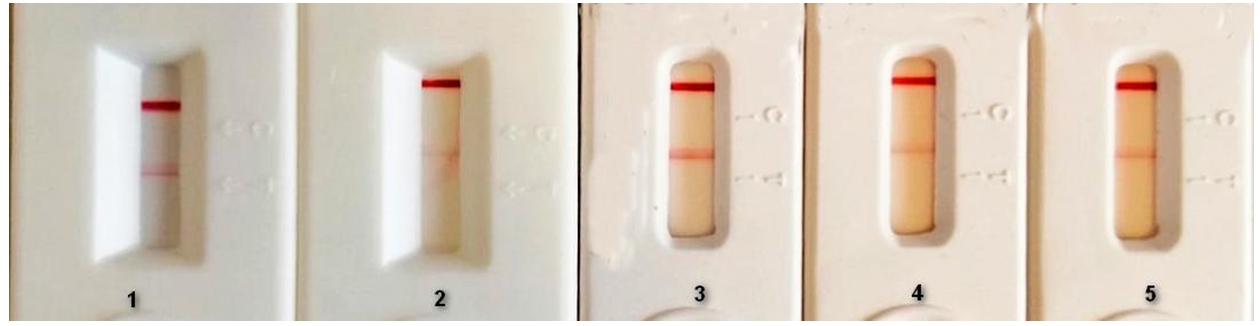
Внешний вид иммунохроматограмм СЭБ приведен на рисунке 5.Рис. 5 – Внешний вид иммунохроматограмм СЭБ при использовании различных сочетаний конъюгатов НКЗ, в скобках приведено значение оптической плотности конъюгата в е.о.п.:
1 – НКЗ-S222 (OD=1,5); 2 – НКЗ-S222-биотин (OD=2,0); 3 – НКЗ-S222-биотин+НКЗ-БСА-биотин (OD=2,0) каждого + НКЗ-стрептавидин (OD=0,25); 4 – НКЗ-S222-биотин+НКЗ-БСА-биотин(OD=4,0) + НКЗ-стрептавидин (OD=0,25); 5 – НКЗ-S222-биотин+НКЗ-БСА-биотин (OD=4,0) каждого + НКЗ-стрептавидин (OD=0,5)
Примечание: концентрация СЭБ во всех анализируемых образцах 120 нг/мл
ОбсуждениеЦелью настоящего исследования явилось изучение возможности повышения чувствительности ИХА, используя бифункциональный конъюгат НКЗ, способный связываться с антигенными эпитопами аналита и вступать в реакцию биотин-стрептавидин.
Для достижения указанной цели были синтезированы конъюгаты НКЗ-S222, НКЗ-S222-биотин, НКЗ-БСА-биотин и НКЗ-стрептавидин. Были изучены зависимости графики зависимости «сигнал-концентрация аналита» для различных вариантов сочетаний конъюгатов, используемых при построении иммунохроматографического теста.
Анализ графиков зависимости «сигнал-концентрация аналита» в полулогарифмических координатах показывает, что они хорошо аппроксимируются сигмоидной функцией с коэффициентом ковариации R2 близкой к 0,99 (рисунок 2 и 3). При этом можно разделить графики зависимости на два участка. Первый участок - область концентраций аналита 0-20 нг/мл, в которых сигнал рефлектометрического анализатора иммунохроматограмм для различных вариантов тестов принимает близкие значения и участок концентраций ≥ 30 нг/мл, где графики зависимостей расходятся.
Варианты I и Ia. Иммунохроматографическая тест-система, в которой использовали формат «сэндвич-анализа» содержала конъюгат НКЗ-S222 и МКА S643 в аналитической зоне, проявила чувствительность 16,0 нг/мл, при визуальной регистрации и 5,0 нг/мл при приборной. Применение конъюгата биотинилированных антител НКЗ-S222-биотин уменьшило чувствительность теста при визуальной регистрации до 25,0 нг/мл. Вероятно, это произошло из-за того, что биотинилирование иммуноглобулинов влияет на константу устойчивости KD комплексов антиген-антитело по сравнению с нативными антителами.
Вариант II. Введение дополнительного конъюгата со стрептавидином в состав теста привело к повышению визуальной чувствительности теста до 12,5 нг/мл СЭБ и 2,5 нг/мл при приборной регистрации. Конъюгаты НКЗ-S222-биотин взаимодействовали с СЭБ и далее образовывали агрегаты с конъюгатом НКЗ-стрептавидин. Образовавшийся комплекс фиксировался в аналитической зоне теста МКА S643 в виде агрегата. В нашем случае наблюдается значительное усиление окрашивания аналитической зоны по сравнению с обычным тестом (рисунок 2, кривая 2, рисунок 4, зависимость 3) за счет образования агрегатов НКЗ. Ранее, в работе [7] методом динамического светорассеяния было показано образование агрегатов наночастиц различного размера состоящих из конъюгатов НКЗ функционализированных специфическими биотинилированными антителами и НКЗ конъюгированных со стрептавидином. Было зафиксировано два пика светорассеяния, связанных с образованием агрегатов. Гидродинамические диаметры агрегатов НКЗ достигали 86 нм и 576 нм. Данные по динамическому светорассеянию отражают суммарный размер частиц конъюгата, включая иммобилизованные белки и гидратационую оболочку наночастицы. Гидродинамические диаметры являются информативными характеристиками агрегатов наночастиц и помогают понять механизм процессов при проведении ИХА.
Образование агрегатов НКЗ в результате реакции биотин-стрептавидин было также отмечено ранее в работе [11], что было использовано для усиления сигнала аналитической системы.
На рисунке 4 приведены графики линейных регрессий в области концентраций СЭБ ˂30 нг/мл, отражающие зависимости сигнала (показаний рефлектометрического анализатора иммунохроматограмм) от концентрации СЭБ. Чувствительность выявления СЭБ при применении дополнительного коньюгата НКЗ со стрептавидином составила 2,5 нг/мл при приборной регистрации, и 12,5 нг/мл при визуальной, что в 2,0 и 1,3 раза выше по сравнению с обычным тестом, не использующим взаимодействие биотин-стрептавидин.
Вариант III. В качестве дополнительного реагента использовали конъюгат НКЗ-БСА-биотин, который наносили на мембрану 2 (рисунок 1), совместно с конъюгатом с биотинилированными специфическими антителами НКЗ-S222-биотин. При этом подложка с конъюгатом НКЗ-стрептавидин в тесте сохранялась. Как показано методом динамического светорассеяния в работе [7], введение дополнительного конъюгата НКЗ-БСА-биотин способствовало образованию более крупных агрегатов всех конъюгатов и белкового аналита, за счет уменьшения стерических препятствий при взаимодействии функционализированных наночастиц с образованием кросс-сшивок между ними. При этом наблюдали агрегаты с гидродинамическими диаметрами 139±24 нм, 452±87 нм, 4657±380 нм. Схематически состав такого агрегата может выглядеть следующим образом: [(НКЗ-БСА-биотин)m-(НКЗ-стрептавидин)p-(НКЗ-S222-биотин-аналит)n]
Как видно из таблицы 1 для указанной тест-системы рассматривали соотношения конъюгатов наночастиц с биотинилированными специфическими антителами, биотином и стрептавидином 1:1:0,250 и 1:1:0,125. О количестве конъюгатов судили по оптической плотности препаратов НКЗ, предполагая, что фунционализированные наночастицы имеют равные параметры светорассеяния и коэффициенты экстинкции, поскольку были приготовлены из одной партии золя. Внешний вид иммунохроматограмм СЭБ в этом варианте анализа приведен на рисунке 5. Вид графиков зависимостей «сигнал-концентрация аналита» изменялся от соотношения количества конъюгатов в тест-полоске (рисунок 3). Видно, что в области концентраций СЭБ≥40 нг/мл, при соотношении конъюгатов 1:1:0,250 наклон кривой 2 меньше, чем наклон кривой 3 при соотношении 1:1:0,125. Это явление объясняется тем, что более высокая доля конъюгатов со стрептавидином, реагируя с биотином, частично ингибирует образование конечного продукта, способного связаться в аналитической зоне с МКА S643. Очевидно также, что и слишком малая концентрация конъюгата со стрептавидином не приведет к образованию агрегатов золотых наночастиц и не вызовет усиления интенсивности окрашивания. Тем не менее, как следует из сравнения кривых 2 и 3 на рисунке 3, введение конъюгатов НКЗ-БСА-биотин, в качестве второго усиливающего конъюгата, дает эффект усиления окрашивания аналитической зоны по сравнению с обычной тест-системой, где в качестве конъюгата использовался НКЗ-S222-биотин (рисунок 3, кривая 1). Однако введение дополнительного конъюгата НКЗ-БСА-биотин в различных соотношениях не дало в нашем случае выигрыша в чувствительности (таблица 1) по сравнению с обычным тестом на СЭБ.
Заключение
Как показывают собственные и литературные данные чувствительность ИХА в обычном варианте и вариантах с использованием в качестве бифункционального реагента биотинилированных специфических иммуноглобулинов, для синтеза иммунохроматографического конъюгата, и дополнительных конъюгатов НКЗ-стрептавидин и НКЗ-БСА-биотин зависит белковой нагрузки на конъюгат, молярного соотношения иммунореагентов.
Основными выводами исследования явилось то, что использование при построении иммунохроматографического теста конъюгатов НКЗ c функционализированными биотином специфическими моноклональными иммуноглобулинами против антигенов СЭБ (НКЗ-S222-биотин) и дополнительных конъюгатов НКЗ-стрептавидин показало повышение чувствительности выявления СЭБ до 2,5 нг/мл при приборной регистрации, и 12,5 нг/мл при визуальной. Эта чувствительность в 2,0 и 1,3 раза выше по сравнению с обычным тестом, где взаимодействие биотин-стрептавидин отсутствует. Повышение чувствительности объясняется образованием агрегатов наночастиц, которые повышают «заметность» аналитической зоны теста. Сравнение ИХА тестов для выявления СЭБ с применением бифункциональных конъюгатов и тестов применением солей серебра [3] показало определенные преимущества первых. Преимущества заключаются в уменьшении времени анализа с 45 мин до 25 мин, отсутствии необходимости после стадии иммунохроматографии вносить в тест свежеприготовленный усиливающий раствор гидрохинона и нитрата серебра, отсутствие фоточувствительности реакции.
Применение второго конъюгата НКЗ-БСА-биотин, в сочетании конъюгатом НКЗ-стрептавидин также показало наличие эффекта усиления окрашивания аналитической зоны теста, особенно в области концентраций аналита ≥40 нг/мл, но не привело к увеличению чувствительности теста.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Rodriguez, M.O. Silver and gold enhancement methods for lateral flow immunoassays / M.O. Rodriguez // Talanta.- 2016. –V.148.- P. 272-278.
- Zhang, K. Hollow nanogold microsphere-signalized lateral flow immunodipstick for the sensitive determination of the neurotoxin brevetoxin B. / K. Zhang et al.// Microchimica Acta. --2014. – V.181. -№11.- P. 1447-1454.
- Ярков С.П. Повышение чувствительности иммунохроматографических тестов для выявления возбудителя сибирской язвы и стафилококкового энтеротоксина типа В на основе усиления серебром и инструментальной регистрации./ С.П. Ярков, С.И. Третьяков, Е.К. Шаулина и др. // Медицина экстремальных ситуаций.- 2019.- Т. 21.- №3.- С.455-463.
- Zhong Y. Gold nanoparticles based lateral flow immunoassay with largely amplified sensitivity for rapid melamine screening./ Y. Zhong, Y. Chen, L. Yao // Microchim Acta. -2016-V.183.- № 6.- P. 1989–1994 . DOI: 10.1007/s00604-016
- Shen G.Y. Lateral flowimmunoassay with the signal enhanced by gold nanoparticle aggregates based on polyamidoamine dendrimer./ Shen G.Y. , Xu H., Gurung A.S. et al. //Anal. Sci.- 2013.- V. 29.- №8.- P. 799–804. DOI: 10.2116/analsci.29.799
- Серебренникова К. В. Повышение чувствительности латерального проточного иммуноанализа с помощью системы биотин–стрептавидин. / К. В. Серебренникова, Ж.В. Самсонова, А.П. Осипов // Вестн. Моск. Ун-та. Сер. 2., Химия. -2018.- Т.59.- №3.- С.230-233.
- Taranova N. A. Bifunctional gold nanoparticles as an agglomeration-enhancing tool for highly sensitive lateral flow tests: a case study with procalcitonin / N. A. Taranova, A. E. Urusov, E. Sadykhov, et al. //Microchimica Acta. - 2017.- V. 184. -№10.- P.4189-4195 DOI: 10.1007/s00604-017-2355-4.
- Frens G. Controlled nucleation for the regulation of particle size in monodisperse gold suspension / G. Frens // Nat. Phys. Sci. - 1973. -V. 241.- P. 20–22.
- Бызова Н.А. Сравнительная характеристика наночастиц коллоидного золота разного диаметра как носителей и маркеров в иммунохроматографическом анализе. / Н.А. Бызова, И.В. Сафенкова, А.В. Жердев и др. // Естественные и технические науки.-2012.- № 1.- C. 62-71.
- Hermanson G.T. Bioconjugate Techniques / Hermanson G.T. Bioconjugate Techniques- 2nd Edition. - San Diego: Elsevier / Academic Press, 2008.- 1323 P.
- Cho, I.-H. In-situ immuno-gold nanoparticle network ELISA biosensors for pathogen detection./ Cho, I.-H., Irudayaraj, J.// International Journal of Food Microbiology.- 2013.- V.164.- №1.-P.70–75. DOI:.1016/ j.ijfoodmicro.2013.02.025.
Список литературы на английском языке / References in English
- Rodriguez, M.O. Silver and gold enhancement methods for lateral flow immunoassays / M.O. Rodriguez // Talanta.- 2016. –V.148.- P. 272-278.
- Zhang, K. Hollow nanogold microsphere-signalized lateral flow immunodipstick for the sensitive determination of the neurotoxin brevetoxin B. / K. Zhang et al.// Microchimica Acta. --2014. – V.181. -№11.- P. 1447-1454.
- Yarkov S.P.Povyshenie chuvstvitel'nosti immunohromatograficheskih testov dlja vyjavlenija vozbuditelja sibirskoj jazvy i stafilokokkovogo jenterotoksina tipa V na osnove usilenija serebrom i instrumental'noj registracii. [Increasing the sensitivity of immunochromatographic tests to identify the causative agent of anthrax and staphylococcal enterotoxin type B based on silver amplification and instrumental registration] / Yarkov S.P., Tretyakov S.I., Shaulina E.K., et al. // Medicina jekstremal'nyh situacij. [Medicine of extreme situations.] - 2019.- V. 21.- №3.- P.455-463. [in Russian]
- Zhong Y. Gold nanoparticles based lateral flow immunoassay with largely amplified sensitivity for rapid melamine screening./ Y. Zhong, Y. Chen, L. Yao // Microchim Acta. -2016-V.183.- № 6.- P. 1989–1994 . DOI: 10.1007/s00604-016
- Shen G.Y. Lateral flowimmunoassay with the signal enhanced by gold nanoparticle aggregates based on polyamidoamine dendrimer./ Shen G.Y. , Xu H., Gurung A.S. et al. //Anal. Sci.- 2013.- V. 29.- №8.- P. 799–804. DOI: 10.2116/analsci.29.799
- Serebrennikova K. V. Povyshenie chuvstvitel'nosti lateral'nogo protochnogo immunoanaliza s pomoshh'ju sistemy biotin–streptavidin. [Increasing the sensitivity of lateral flow immunoassay using the biotin-streptavidin system]. / Serebrennikova K. V., Samsonova Zh.V., Osipov A.P. // Vestn. Mosk. Un-ta. Ser. 2., Khimija [Vestn. Moscow University. Ser. 2., Chemistry]. -2018.- Vol.59.- №3.- P.230-233. [in Russian]
- Taranova N. A. Bifunctional gold nanoparticles as an agglomeration-enhancing tool for highly sensitive lateral flow tests: a case study with procalcitonin / N. A. Taranova, A. E. Urusov, E. Sadykhov, et al. //Microchimica Acta. - 2017.- V. 184. -№10.- P.4189-4195 DOI: 10.1007/s00604-017-2355-4.
- Frens G. Controlled nucleation for the regulation of particle size in monodisperse gold suspension / G. Frens // Nat. Phys. Sci. - 1973. -V. 241.- P. 20–22.
- Byzova N.A. Sravnitel'naja harakteristika nanochastic kolloidnogo zolota raznogo diametra kak nositelej i markerov v immunohromatograficheskom analize.[Comparative characteristics of colloidal gold nanoparticles of different diameters as carriers and markers in immunochromatographic analysis]. / Byzova N.A., Safenkova I.V., Zherdev A.V., et al. // Estestvennye i tehnicheskie nauki [Natural and technical sciences].-2012.- № 1.- P. 62-71. [in Russian]
- Hermanson G.T. Bioconjugate Techniques / Hermanson G.T. Bioconjugate Techniques- 2nd Edition. - San Diego: Elsevier / Academic Press, 2008.- 1323 P.
- Cho, I.-H. In-situ immuno-gold nanoparticle network ELISA biosensors for pathogen detection./ Cho, I.-H., Irudayaraj, J.// International Journal of Food Microbiology.- 2013.- V.164.- №1.-P.70–75. DOI:.1016/ j.ijfoodmicro.2013.02.025.