АДАПТИВНЫЕ ВОЗМОЖНОСТИ ГЛАДКИХ МИОЦИТОВ МУСКУЛЬНОГО ОТДЕЛА ЖЕЛУДКА УТОК ВОКРУГ ПОЛИМЕРНОГО ИМПЛАНТАТА
АДАПТИВНЫЕ ВОЗМОЖНОСТИ ГЛАДКИХ МИОЦИТОВ МУСКУЛЬНОГО ОТДЕЛА ЖЕЛУДКА УТОК ВОКРУГ ПОЛИМЕРНОГО ИМПЛАНТАТА
Научная статья
Созыкин А.А.1, *, Куличенко О.О.2
1, 2 Ростовский государственный медицинский университет Минздрава России, Ростов-на -Дону, Россия
* Корреспондирующий автор (aleks_sozykin[at]mail.ru)
АннотацияЦелью экспериментального исследования было выявление адаптивных морфологических ультраструктурных особенностей в гладких миоцитах мышечной ткани мускульного отдела желудка, у птиц domesticis anatis после хирургически внедренного в него полимера – политетрафторэтилена.
У 25 самок годовалых уток, вокруг имплантата из тетрафторэтилена, на глубину в 1 мм, на 3, 5, 30, 90-е сутки эксперимента (по 5 особей на срок, и 5 особей в контрольной группе) исследовалась приспособительная ультраструктурная реорганизация органелл общего назначения и элементов сократительного аппарата в «прикапсульных» лейомиоцитах циркулярного слоя - аналога пилорического сфинктера желудка у млекопитающих и человека. Для оценки полученного биологического материала применялись методы: классической гистологии, прицельной просвечивающей электронной микроскопии, иммуногистохимии, морфометрии.
Полученные результаты убеждают, что клеточные посттравматические изменения, вблизи импланта из политетрафторэтилена, протекают в пределах асептического воспаления. Отмечена кооперация клеток лейкоцитарного ряда, тканевых базофилов, а также пролиферативная и синтетическая активность фибробластов. Установлено, что в гладких миоцитах около импланта, переживших травму и сохранивших межклеточные взаимодействия компартменты цитоплазмы, занятые сократительным аппаратом, замещаются элементами синтетического. К крайним срокам наблюдения - 90-е сутки, вблизи наружного слоя капсулы, окружающей имплант обнаруживался «сократительно-синтетический" фенотип лейомиоцитов, составивший, в среднем, 18-19% от всей гладкомышечной популяции циркулярного слоя мускульного отдела желудка.
Проведенное нами исследование позволяет утверждать, что имплантированный в мускульный отдел желудка птиц полимер, в 100% случаях, изолируется волокнистым коллагеновым каркасом. Адаптивные морфологические перестройки в лейомиоцитах вокруг соединительнотканной капсулы наблюдаются на протяжении всего срока эксперимента, а ультраструктура 18-19% из них претерпевает фенотипическую трансформацию, закрепляющуюся, возможно, на весь оставшийся срок жизни особей.
Ключевые слова: полимер, сфинктер, регенерация, гладкие миоциты.
ADAPTIVE CAPABILITIES OF SMOOTH MYOCYTES OF THE DUCK GIZZARD AROUND THE POLYMER IMPLANT
Research article
Sozykin A.A.1, *, Kulichenko O.O.2
1, 2 Rostov State Medical University, Rostov-on-Don, Russia
* Corresponding author (aleks_sozykin[at]mail.ru)
AbstractThe aim of the experimental study was to identify adaptive morphological ultrastructural features in smooth muscle myocytes of the gizzard in domesticis anatis after surgically implanted polymer - polytetrafluoroethylene.
Adaptive ultrastructural reorganization of general-purpose organelles and elements of the contractile apparatus in the "capsule" leiomyocytes of the circular layer - an analogue of the pyloric stomach sphincter in mammals and humans - was studied in 25 female one-year-old ducks, around a tetrafluoroethylene implant, to a depth of 1 mm, on the 3rd, 5th, 30th, 90th day of the experiment (5 for a period, and 5 for the control group). To evaluate the obtained biological material, the following methods were used: classical histology, targeted transmission electron microscopy, immunohistochemistry, morphometry.
The results obtained prove that cellular post-traumatic changes near the polytetrafluoroethylene implant occur within the limits of aseptic inflammation. The cooperation of leukocyte cells, tissue basophils, as well as proliferative and synthetic activity of fibroblasts was noted. The study establishes that in smooth myocytes near the implant that survived trauma and retained intercellular interactions, cytoplasmic compartments occupied by the contractile apparatus are replaced by synthetic elements. By the final dates of observation: the 30th, 90th day, a "contractile-synthetic" phenotype of leiomyocytes was detected near the outer layer of the capsule surrounding the implant, which averaged 18-19% of the entire smooth muscle population of the circular layer of the gizzard.
The research suggests that the polymer implanted in the gizzard of birds, in 100% of cases, is isolated by a fibrous collagen framework. Adaptive morphological rearrangements in leiomyocytes around the connective tissue capsule are observed throughout the entire duration of the experiment, and the ultrastructure of 18-19% of them undergoes a phenotypic transformation, which is fixed, possibly, for the rest of the life of birds.
Keywords: polymer, sphincter, regeneration, smooth myocytes.
ВведениеПолимеры различных видов, еще с середины прошлого века, достаточно широко применяется почти во всех отраслях деятельности человека, в том числе и медицине [1], [2], [3]. За последние десятилетие совместными усилиями биоинженеров и биофизиков, биохимиков и врачей различных специальностей создано большое разнообразие как искусственных, так и биополимерных материалов, успешно применяемых в реконструктивной хирургии, травматологии, стоматологии, и др. Структура полимерных материалов постоянно совершенствуются, приближаясь к требованиям, позволяющим им оптимально соответствовать характерным свойствам тканей для коррекции или замены органов человеческого организма. Одно из ряда базовых требований, применяемых к полимерам, это длительное сохранение основных физико-механических свойств при разрушительном действии токсичных и ферментативных систем живого организма. Однако, исследования структуры тканей, окружающей имплант, приспособительные реакции в ответ на внедрение полимеров различных классов в эксперименте проводятся зачастую недостаточно объективно и не комплексно. Актуальность нашего экспериментального исследования обусловлена поиском и применением материалов, являющихся, по сути, искусственно созданными, но «биосовместимыми» с тканями организма птиц и млекопитающих [4], [5], [6]. Однако, реактивность гладкой мышечной ткани, в ответ на внедрение и длительное внутритканевое присутствие в ней полимеров, изучена недостаточно.
Целью проведенного экспериментального исследования было выявление и анализ адаптивных морфологических ультраструктурных особенностей в гладких миоцитах мышечной ткани мускульного отдела желудка, у птиц domesticis anatis после хирургически внедренного в него полимера – политетрафторэтилена.
Материал и методы исследованияПолитетрафторэтилен – фрагмент протеза сосуда MAXIFLOTM, изготовленного компанией Vascutek., размерами 1х0,41мм. хирургически имплантировался в циркулярный слой гладкой мышечной ткани мускульного отдела желудка 20 домашним уткам (10 особям женского пола; 10 особям мужского пола) возрастом 1 год. Для этого, под наркозом препаратом «Рометар» 0,01мл., каждой из птиц экспериментальной группы в стерильных условиях, после подготовки операционного поля, малым глазным скальпелем поочередно рассекались: кожа, мышцы передней брюшной стенки и, через лапароскопический доступ 1,5 см., задняя часть желудка выводилась наружу. Затем, на границе анатомического заднего отдела «мускульного желудка» и тонкого кишечника, под увеличением в 40 раз, наружная часть мышечной оболочки рассекались на длину 1 см. глубиной 3мм. и имплант погружался в область разреза на его «дно». Рана на желудке, также как и мышечный, и кожные слои ушивалась викрилом послойно наглухо. Материал забирался на 3,5,30,90-е сутки у 4 птиц (2 самца; 2 самки) на каждый срок. Контролем служил тот же участок циркулярного слоя гладкомышечных клеток мускульной части желудка, забранный от 4-х интактных уток того же возраста и пола. На работу с животными получено разрешение локального этического комитета РостГМУ. В качестве наркоза и при выведении животных из опыта использовался препарат «Рометар» в эмпирически подобранной дозе 0,5 мл. Из эксперимента животные выводились соблюдением требований Европейской конвенции по защите позвоночных (Страсбург,1986).
Для оценки различных структур в гладких миоцитов вокруг импланта использовались методы: классической световой микроскопии, просвечивающей электронной микроскопии. Для световой микроскопии материал фиксировался в жидкости Карнуа. Серийные парафиновые срезы, толщиной 5-7мкм., окрашивались по общепринятой гистологической методике гематоксилином–эозином, и селективно, для выявления структур мышечной и соединительной тканей, по Малори. Микросъемку гистологических препаратов производили на микроскопе “Axiolab” с фотонасадкой фирмы «Carl Zeiss».
Материал для электронномикроскопического исследования фиксировали в 1% растворе тетраокиси осмия - OsO4 (G. Palade, 1952) на фосфатном буфере при pH 7,2- 7,4 (G. Millonig 1961) c префиксацией в 2,5% растворе глутаральдегида. Отмывка материала проводилась раствором фосфатного буфера при температуре 0-40С, обезвоживание - в спиртах восходящей концентрации и в абсолютном ацетоне с последующей заливкой в аралдит (А.М. Glauert. R.H. Glauert, 1958). Для прицельной микроскопии на микротоме УПТМ-3М изготавливались полутонкие срезы, которые окрашивались метиленовым синим и азуром-11 на 1%-ном растворе тетраборнокислого натрия при температуре +600С в течение 5 минут. Ультратонкие срезы (500-700А), полученные на ультрамикротоме LKB-8800, контрастировали 2,5% раствором уранилацетата (Watson M. L .1958), 0,3 % раствором цитрата свинца (Venable J.H., Goggeshall R.,1965) и просматривали в микроскопе JEM-100S. Методом внутриклеточной стереоморфометрии определялись относительные объёмы, занимаемые в цитоплазме органеллами общего значения: митохондриями, эндоплазматическим ретикулюмом, рибосомами (полисомами), а также элементами сократительного аппарата.
Иммунногистохимический метод применялся соответственно для выявления интенсивности пролиферации Ki-67 и гибели апоптозом P-53 клеточных элементов в области установки импланта на 5,30,90-е сутки эксперимента. Реакция проведена с помощью набора моноклональных антител и реактивов для визуализации фирмы SIGMA США.; материал заливался в парафиновые блоки. Индекс пролиферации и индекс апоптоза высчитывали по формуле ИП=(n+/N) х 100%; n+ количество ядер с положительной (окрашенной) экспрессией белка Ki-67; P-53. Статистический анализ результатов исследования осуществлялся с использованием программы STATISTICA-10. Вычислялась средняя арифметическая ошибка, а значимыми считались различия между средним показателями при p ≤ 0.05.
Результаты и их обсуждение
На 3-5 сутки после эксперимента диапазон посттравматических изменений, непосредственно вокруг политетрафторэтилена, протекает в пределах асептического воспаления. Отмечены взаимодействия лейкоцитов, появление единичных лимфоцитов, тканевых базофилов, активация фибробластов. Вокруг импланта идет формирование богатой сосудами микроциркуляции грануляционной соединительной ткани, трансформирующейся затем в плотную волокнистую оформленную. Лейомиоциты, не утратившие интеграционные взаимодействия и не задетые хирургическим повреждением, имеют внутриклеточные признаки активации, связанные с восстановлением элементов сократительного аппарата: крупное ядро до 9,7±0,5%. расширенные цистерны ЭПС до 2,4±0,5%, больший объём, занимаемый митохондриями 3,8±0,7% и меньший, чем в контроле, объём сократительных элементов - 61,4 ± 0,9%.
С 30-х по 90-е сутки возле наружного слоя коллагеновых фибрилл сформировавшейся капсулы располагаются группы гладких миоцитов, интегрированных базальной мембраной, а в участках свободных от неё, межклеточными контактами десмосомального и щелевидного типов. Среди них 18-19±0,4% имеют отличные от контрольных объёмы ядра 8,2±0,5%; внутриклеточные объёмы органелл общего: эндоплазматической сети 1,9±0,3; митохондрий 2,9±0,3%; и специального назначения: сократительных структур (миофиламентов и плотных телец) 74 ±0,7%.
К 30-м суткам эксперимента политетрафторэтилен уже полностью окружен капсулой – «футляром» толщиной 0,1 мм., состоящим из неоформленной плотной волокнистой соединительной ткани, представленной пластинами плотно прилежащих друг к другу разноориентированных коллагеновых фибрилл. Кровеносные сосуды и нервные окончания в ней отсутствуют. В непосредственной близости от соединительнотканного футляра, окружающего имплантат, в основном обнаруживаются фиброциты и, реорганизованные в «сократительно-синтетический» фенотип [7], [8], группы контактирующих между собой лейомиоцитов. Рис.1,2.
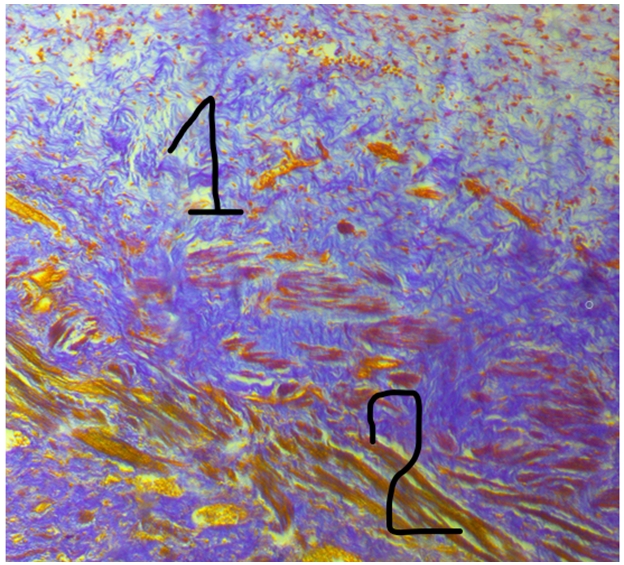
Рис. 1 – Мускульная часть желудка утки (аналог пилорического сфинктера млекопитающих) утки, 30-е сутки эксперимента:
1 – коллагеновые фибриллы капсулы; 2 – пучки жизнеспособных гладких миоцитов
Примечание: окраска по Малори об.40; ок.10.
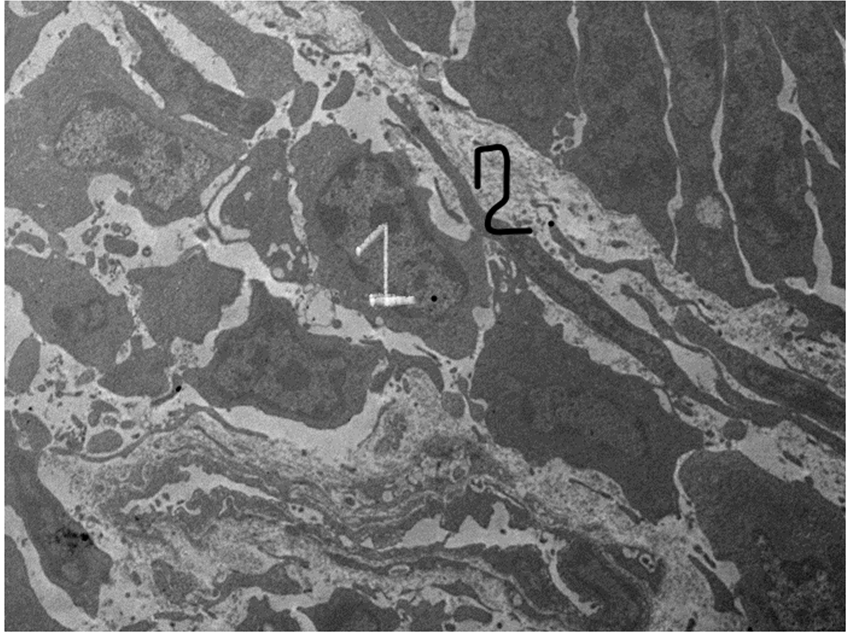
Рис. 2 – Мускульная часть желудка утки, 30-е сутки эксперимента:
1 – «прикапсульный» лейомиоцит; 2 – коллагеновые структуры капсулы вокруг импланта из тетрафторэтилена
Примечание: электронная микрофотография ув. х7500
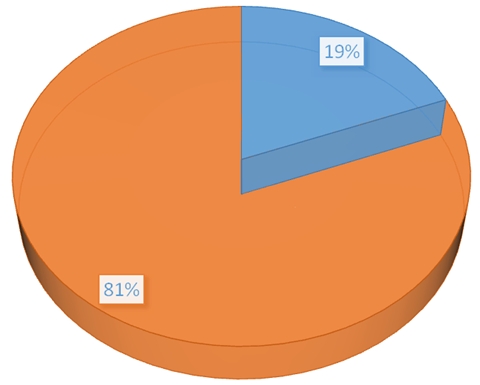
Рис. 3 – Процентное содержание миоцитов «сократительно-синтетического» фенотипа в мускульном отделе желудка уток на 90-е сутки эксперимента в области установки импланта из тетрафторэтилена:
оранжевый – процентное содержание лейомиоцитов «сократительного» фенотипа; синий – процентный состав лейомиоцитов «сократительно-синтетического» фенотипа
К 90-м суткам после «установки» импланта в близлежащих к капсуле гладких миоцитах до 19%±0,4 их, имеют увеличенное ядерно-цитоплазматическое отношение 0,8-1,2±0,5. В их цитоплазме, статистически достоверно, по сравнению с контролем, увеличены относительные объемы ядра до 7,1±0,4; элементов гранулярной эндоплазматической сети до 1,2±0,3; митохондрий до 3,1±0,3. Объемы, занимаемые элементами сократительного аппарата, снижены до 76±0,4. Рис. 3, 4, 5.
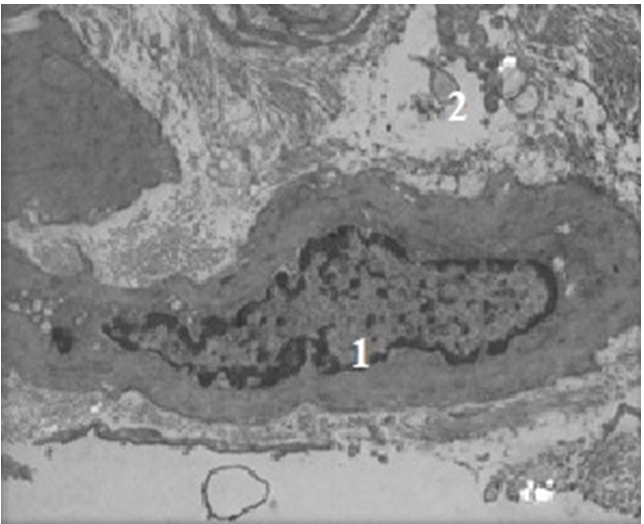
Рис. 4 – Мускульная часть желудка утки, 90-е сутки эксперимента:
1 – тетрафторэтиленовый имплант; 2 – группы гладких миоцитов возле импланта
Примечание: электронная микрофотография ув. х6000
Рис. 5 – Задний, мускульный отдел желудка утки, 90-сутки эксперимента
1 – гладкий миоцит «сократительно-синтетического» фенотипа; 2 – структуры межклеточного вещества
Примечание: электронная микрофотография ув. х8000
Экспрессия ядерного антигена Ki-67 была интенсивно выражена на 3-и и 5-е сутки эксперимента. Апоптотический маркер P-53 в прикапсульных клеточных элементах выявлялся незначительно лишь на 3,5-е сутки эксперимента.
ЗаключениеТаким образом, лейомиоциты гладкой мышечной ткани уток вокруг капсулы, окружающей политетрафторэтилен, имплантированный в циркулярный слой мускульного отдела желудка птиц (аналог пилорического сфинктера млекопитающих), к 90-м суткам эксперимента, судя по преобладающим элементам ультраструктуры, продолжают выполнять сократительную функциональную нагрузку. По нашему мнению, сохранение здесь 18-19±0.4% лейомиоцитов «сократительно-синтетического» фенотипа обнаруженных также при регенерации и развитии гладкой мышечной ткани в дыхательной и выделительной системах в [9], [10], [11], позволяет предположить их участие, наряду с контрактильной функцией, еще и обновлении межклеточного вещества вокруг импланта.
| Конфликт интересов Не указан. | Conflict of Interest None declared. |
Список литературы / References
- Аронов, А. М. Биокомпозиты на основе сополимера тетрафторэтилена с винилиденфторидом, наполненного гидроксиапатитом, и возможность их применения в качестве покрытия для интрамедуллярных имплантатов / А. М. Аронов, Е. Н. Больбасов, В. В. Гузеев // Медицинские технологии. — 2010. — № 3. — С. 5-13.
- Попков А. В. Биосовместимые имплантаты в травматологии и ортопедии / А. В. Попков // Гений ортопедии. — 2014. — № 3.
- Борзенок С. А. Обоснование выбора биополимерных материалов для конструирования 3D-матрицы искусственной роговицы / С. А. Борзенок, А. А. Желтоножко, Ю. А. Комах // Вестник офтальмологии. – 2015. – № 131 (4). – С. 94–96.
- Морфологическая характеристика реакций мягких тканей при имплантации титановых имплантов для краниоластики. Экспериментальное исследование / С. В. Мишинов, Н. А. Копорушко, П. М. Ларионов [и др.]. // Современные проблемы науки и образования. — 2020. — № 4.
- Биодеградируемые импланты становление и развитие. Преимущества и недостатки / Л. А. Якимов, Л. Ю. Слиняков, Д. С. Бобров [и др.]. // Кафедра травматологии. — 2017. — № 1 (21). — С. 44-49.
- Филатов, И. Ю. Электроформование волокнистых материалов на основе полимерных микро- и нановолокон. История, теория, технология, применение / И. Ю. Филатов, Ю. Н. Филатов, М. С. Якушкин.// Вестник МИТХТ им. М. В. Ломоносова. — 2008. — № 3(5). — С. 3-5.
- Середа Е. В. Современные методы восстановления и регенерации тканей скелетных мышц / Е. В. Середа, С. Е. Балицкий, Г. А. Юнси. // Международный студенческий вестник. — 2018. — № 6. — С. 44.
- Зашихин, А. Л. Механизмы реактивной трансформации гладкой мускулатуры различных 23 висцеральных органов / А. Л. Зашихин, О. А. Бармина. — // Материалы X международного симпозиума. — Архангельск: Б.И., 2008. — С. 5-8.
- Endothelialization of a non-woven silk fibroin net for use in tissue engineering: growth and gene regulation of human endothelial cells / R. E. Unger, K. Peters, M. Wolf et al. // Biomaterials. – 2004. – Vol. 25, № 21. – P. 5137–5146.
- Мишинов С.В. Морфологическая характеристика реакций мягких тканей при имплантации титановых имплантов для краниопластики. Экспериментальное исследование / С.В. Мишинов, Н.А. Копорушко, П.М. Ларионов и др. // Современные проблемы науки и образования. – 2020. – № 4. – С. 109-109.
- Ambrose C. G. Bioabsorbable implants: review of clinical experience in orthopedic surgery / C. G. Ambrose, T. O. Clanton //Annals of biomedical engineering. – 2004. – Vol. 32. – No. 1. – P. 171-177.
- Eglin D. Degradable polymeric materials for osteosynthesis: tutorial / D. Eglin, M. Alini // European Cells and Materials. -2008. Vol. 16. -P 80 91.
Список литературы на английском языке / References in English
- Aronov, A. M. Biokompozity na osnove sopolimera tetraftorjetilena s vinilidenftoridom, napolnennogo gidroksiapatitom, i vozmozhnost' ih primenenija v kachestve pokrytija dlja intramedulljarnyh implantatov [Biocomposites based on a copolymer of tetrafluoroethylene with vinylidene fluoride, filled with hydroxyapatite, and the possibility of their use as a coating for intramedullary implants] / A. M. Aronov, E. N. Bolbasov, V. V. Guzeev // Medicinskie tehnologii [Medical technology]. - 2010. - No. 3. - P.5-13. [in Russian]
- Popkov A. V. Biosovmestimye implantaty v travmatologii i ortopedii [Biocompatible implants in traumatology and orthopedics / A. V. Popkov // Genij ortopedii [The genius of orthopedics]. - 2014. - No. 3. [in Russian]
- Borzenok S. A. Obosnovanie vybora biopolimernyh materialov dlja konstruirovanija 3D-matricy iskusstvennoj rogovicy [Rationale for the choice of biopolymer materials for designing a 3D-matrix of an artificial cornea] / S. A. Borzenok, A. A. Zheltonozhko, Yu. A. Komakh // Vestnik oftal'mologii [Bulletin of Ophthalmology]. - 2015. - No. 131 (4). - P.94–96. [in Russian]
- Morfologicheskaja harakteristika reakcij mjagkih tkanej pri implantacii titanovyh implantov dlja kraniolastiki. Jeksperimental'noe issledovanie [Morphological characteristics of soft tissue reactions during the implantation of titanium implants for craniolastics. Experimental research] / S. V. Mishinov, N. A. Koporushko, P. M. Larionov et al. // Sovremennye problemy nauki i obrazovanija [Modern problems of science and education]. - 2020. - No. 4. [in Russian]
- Biodegradiruemye implanty stanovlenie i razvitie. Preimushhestva i nedostatki / [Biodegradable implants formation and development. Advantages and disadvantages] / L. A. Yakimov, L. Yu. Slinyakov, D. S. Bobrov et al. // Kafedra travmatologii [Department of Traumatology]. - 2017. - No. 1 (21). - P.44-49. [in Russian]
- Filatov, I. Ju. Jelektroformovanie voloknistyh materialov na osnove polimernyh mikro- i nanovolokon. Istorija, teorija, tehnologija, primenenie [Electroforming of fibrous materials based on polymer micro- and nanofibers. History, theory, technology, application] / I. Yu. Filatov, Yu. N. Filatov, M. S. Yakushkin // Vestnik MITHT im. M. V. Lomonosova [Bulletin of MITHT im. M.V. Lomonosov]. - 2008. - No. 3 (5). - P.3-5. [in Russian]
- Sereda E. V. Sovremennye metody vosstanovlenija i regeneracii tkanej skeletnyh myshc [Modern methods of restoration and regeneration of skeletal muscle tissues] / E. V. Sereda, S. E. Balitsky, G. A. Yunsi. // Mezhdunarodnyj studencheskij vestnik [International student bulletin]. - 2018. - No. 6. - P.44. [in Russian]
- Zashihin, A. L. Mehanizmy reaktivnoj transformacii gladkoj muskulatury razlichnyh 23 visceral'nyh organov ][Mechanisms of reactive transformation of smooth muscles of various 23 visceral organs] / A. L. Zashikhin, O. A. Barmina // Materialy X mezhdunarodnogo simpoziuma [Materials of the X International Symposium]. - Arkhangelsk: B.I., 2008. - P.5-8.
- Endothelialization of a non-woven silk fibroin net for use in tissue engineering: growth and gene regulation of human endothelial cells / R. E. Unger, K. Peters, M. Wolf et al. // Biomaterials. – 2004. – Vol. 25, № 21. – P. 5137–5146.
- Mishinov S.V. Morfologicheskaja harakteristika reakcij mjagkih tkanej pri implantacii titanovyh implantov dlja kranioplastiki. Jeksperimental'noe issledovanie [Morphological characteristics of soft tissue reactions during implantation of titanium implants for cranioplasty. Experimental research] / S.V. Mishina, N.A. Koporushko, P.M. Larionov, et al. // Sovremennye problemy nauki i obrazovanija [Modern problems of science and education]. - 2020. - No. 4. - pp. 109-109. [in Russian]
- Ambrose C. G. Bioabsorbable implants: review of clinical experience in orthopedic surgery / C. G. Ambrose, T. O. Clanton //Annals of biomedical engineering. – 2004. – Vol. 32. – No. 1. – P. 171-177.
- Eglin D. Degradable polymeric materials for osteosynthesis: tutorial / D. Eglin, M. Alini // European Cells and Materials. -2008. Vol. 16. -P 80 91.