ПРОФИЛАКТИКА И КОРРЕКЦИЯ КОСТНЫХ МИНЕРАЛЬНЫХ НАРУШЕНИЙ ПРИ СИНДРОМЕ ГИПЕРМОБИЛЬНОСТИ СУСТАВОВ
Санеева Г.А.
Кандидат медицинских наук, доцент, ФГБОУ ВО Ставропольский государственный медицинский университет
ПРОФИЛАКТИКА И КОРРЕКЦИЯ КОСТНЫХ МИНЕРАЛЬНЫХ НАРУШЕНИЙ ПРИ СИНДРОМЕ ГИПЕРМОБИЛЬНОСТИ СУСТАВОВ
Аннотация
У 146 пациентов с синдромом гипермобильности суставов (СГМС) изучены показатели костного минерального обмена и уровни основных регулирующих гормонов. Среди пациентов с СГМС отмечена достоверно высокая по сравнению с контролем распространенность гипокальциемии и дефицита витамина D. Выявленные отклонения в микроэлементном гомеостазе и уровнях гормональных регуляторов обусловливают необходимость исследования показателей костного метаболизма у пациентов с СГМС для своевременного выявления недостаточности витамина D и кальция с адекватным восполнением.
Ключевые слова: синдром гипермобильности суставов, костный минеральный обмен.Saneyeva G.A.
MD, Associate professor, Stavropol State medical University
THE PREVENTION AND CORRECTION OF BONE MINERAL DISORDERS IN PATIENTS WITH JOINT HYPERMOBILITY SYNDROME
Abstract
The article presents the results of the study of indicators of bone mineral metabolism and bone remodeling hormones in 146 patients with joint hypermobility syndrome (JHS). The prevalence of hypocalcaemia and vitamin D deficiency was significantly higher in patients with JHS compared to control. Identified deviations in mineral homeostasis and levels of hormonal regulators are requiring the investigating of indicators of bone metabolism in patients with JHS. It is necessary for early detection of vitamin D and calcium insufficiency with adequate replenishment of.
Keywords: joint hypermobility syndrome, bone mineral metabolism.Нарушения минерального гомеостаза широко распространены при различных формах дисплазии соединительной ткани, приобретая важное клинико-патогенетическое значение. Ряд эссенциальных макроэлементов, в первую очередь, кальций, фосфор и магний, поддерживают активность ферментов и механическую прочность соединительнотканных структур [1, 5]. С учетом данного обстоятельства мероприятия по целенаправленному установлению и своевременной коррекции гипоэлементозов ‒ прежде всего гипокальциемии и гипомагнезиемии, включены в современные рекомендации по наследственным соединительнотканным нарушениям. Кость представляет собой один из основных субтипов соединительной ткани с максимальной подверженностью патологическому влиянию элементной недостаточности. Отклонения в минеральном гомеостазе отрицательно влияют на качественные характеристики костной ткани, обусловливают формирование остеопенического синдрома. Кальций является строительным материалом для костной ткани, основным участником кальций-фосфорного обмена. Дополнительным фактором, нарушающим минерализацию костного матрикса за счет неадекватного включения солей кальция и фосфора, является неполноценность коллагена 1 типа, характерная для дисплазии соединительной ткани [6].
Особое значение проблема нарушений гомеостаза остеотропных минералов приобретает при синдроме гипермобильности суставов (СГМС) – одном из частых проявлений дисплазии соединительной ткани с облигатными качественными и/или формативными изменениями опорно-двигательного аппарата. При этом у пациентов с СГМС роль кальция – ведущего эссенциального элемента, участвующего в формировании структуры костной ткани, не ограничивается процессами остеогенеза. Немаловажным представляется участие кальция в модуляции нейро-мышечной передачи и обеспечении сократимости скелетной мускулатуры [1, 2], а функциональная способность и стабильность внутрисуставных элементов во многом зависят от тонуса и силы периартикулярных мышц. Снижение мышечно-тонических функций, нарушение чувства суставно-мышечной проприоцепции предрасполагают к формированию осложнений гипермобильного синдрома ‒ подвывихов и вывихов, имеющих часто упорный и рецидивирующий характер.
Целью исследования явилось определение параметров костного минерального обмена с оценкой основных регулирующих его гормонов у пациентов с синдромом гипермобильности суставов.
Материал и методы. У 146 пациентов (94 мужчин и 52 женщин) с СГМС в возрасте от 18 до 34 лет (средний возраст 23,19±4,01 года) проведено исследование показателей фосфорно-кальциевого обмена (кальций и фосфор крови, суточная кальций- и фосфатурия). Диагноз СГМС устанавливали по Брайтонским критериям с использованием шкалы суставного счета Р. Beighton согласно действующим рекомендациям [5]. Критериями исключения из исследования считали наличие классифицируемых моногенных заболеваний. Контрольная группа состояла из 40 человек, сопоставимых по полу и возрасту (средний возраст 22,3±3,6 лет), без гипермобильного синдрома и других фенотипических проявлений дисплазии соединительной ткани. С помощью иммунохимического метода исследовали уровни гормонов, регулирующих обмен основных остеотропных макроэлементов: паратиреоидного гормона (ПТГ), витамина D (25(ОН)D). Подсчет суточного потребления кальция осуществляли по пищевым таблицам на основании дневника питания с самостоятельным документированием характера, количества и частоты потребления продуктов питания в течение не менее трех дней.
Полученные результаты статистически обработаны. Количественные данные представлены в виде средней и стандартной ошибки средней (M±m). Достоверность межгрупповых различий устанавливали с помощью t-критерия Стьюдента. Достоверность различий качественных признаков оценивали с помощью критерия χ2. Достоверными считали различия при p≤0,05.
Результаты и обсуждение. Наиболее часто ‒ в 43,8% случаев у пациентов с СГМС показатель суставной гипермобильности соответствовал 5 баллам по шкале Beighton, у каждого пятого суставной счет составил 3 балла, у 26,2% ‒ 4 балла. Значительные степени гипермобильности ‒ по 7 и 9 баллов выявлены соответственно у 2,5 и 7,5% лиц исследуемой группы.
Установленные у больных с СГМС особенности соотношения элементов костного минерального обмена демонстрировали низконормальные или незначительно сниженные показатели общего кальция крови при средне-референсном значении фосфатемии. Гипокальциемия отмечена более, чем у 23% (χ2=4,016, р=0,045) пациентов с гипермобильным синдромом (рис. 1).
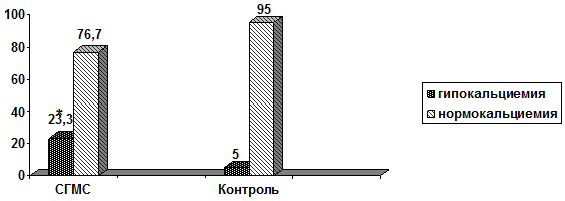 *р<0,05
*р<0,05
Рис. 1 - Распространенность гипокальциемии (%) у пациентов с СГМС и лиц контрольной группы
Нарушение минерализации скелета за счет хронической недостаточности основных остеотропных минералов и персистирующей гипокальциемии с ухудшением минеральной плотности костной ткани относят к достоверным факторам риска развития остеопороза и переломов в старшем возрасте. Высказывание Чарльза Э. Дента: «старческий остеопороз – это педиатрическое заболевание» (1973 г.) получило множество доказательств и в более поздних работах, как зарубежных, так и отечественных авторов, позиционируясь в виде детских истоков остеопороза у взрослых [7, 11]. Таким образом, профилактика остеопороза должна начинаться в детстве, одновременно с построением скелета, а богатая кальцием диета обеспечивает полноценное достижение максимальной массы костной ткани к возрасту 25 лет [4, 8]. В период пикового набора костной плотности скелетные ткани более всего подвержены неблагоприятным воздействиям, таким как нутритивно-дефицитные состояния, а коррекционные метаболические мероприятия, восполняющие недостаточность остеотропных минералов, потенциально имеют наибольшую эффективность в молодом возрасте.
Основным источником кальция в организме являются продукты питания, в основном молочные продукты. Суточное потребление кальция традиционно рассчитывается по следующей формуле [4]:
Суточное потребление кальция (мг) = кальций молочных продуктов (мг) + 350 мг.
Правила рационального питания, включающие адекватное возрасту потребление кальция с пищей, целесообразны для массового применения в целях поддержания остеогенетических процессов, сохранения здоровой костной ткани и ранней профилактики остеопороза и переломов. Однако особую значимость подобные рекомендации приобретают при повышенном риске развития метаболической патологии костей, например, различных клинико-фенотипических вариантах соединительнотканной дисплазии.
Современные пищевые стереотипы, в частности, лиц молодого возраста, характеризуются избытком в ежедневном рационе продуктов быстрого приготовления с большим содержанием сахара, поваренной соли, а также фитатов, снижающих всасывание кальция и других минеральных веществ, но с недостаточным потреблением молочных продуктов, зеленых овощей и фруктов. Оценка среднесуточного потребления кальция путем анализа дневников питания в обеих группах обследованных ‒ пациентов с гипермобильностью и в контрольной, продемонстрировала более чем двукратное его снижение ‒ 448±56 мг/сутки и 424±45 мг/сутки соответственно ‒ по отношению к рекомендуемым возрастным нормам не менее 1000 мг в сутки [3, 4].
Обращало внимание, что при сопоставимом привычном кальций-дефицитном питании распространенность гипокальциемии у больных с гипермобильным синдромом была достоверно выше, чем в контрольной группе (р<0,05). Это может свидетельствовать о дезадаптации регуляции костного минерального гомеостаза при соединительнотканной недостаточности и требует адекватного восполнения, включая добавки кальция для обеспечения суточной потребности в этом элементе и целенаправленное консультирование по вопросам питания.
При достоверно большей по сравнению с контролем распространенности случаи гипокальциемии в группе СГМС чаще имели умеренно выраженный характер (рис. 2).
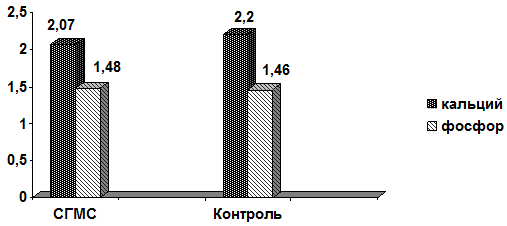
Рис. 2 - Показатели костного метаболизма: средние уровни кальция и фосфора крови (ммоль/л)
Раздельный анализ показателей кальция крови у пациентов с СГМС в зависимости от степени гипермобильности особенностей также не выявил: 2,06±1,9 ммоль/л у обследуемых с показателями суставного счета в 3-4 балла, 2,1±0,16 ммоль/л – 5 баллов и 2,04±0,16 ммоль/л при существенной (7-9 баллов) гипермобильности. Параметры фосфатемии были нормативными при минимальных межгрупповых различиях ‒ 1,48±0,12 ммоль/л в группе СГМС и 1,46±0,18 ммоль/л в контрольной.
Редкой, но требующей исключения причиной нарушения кальциевого гомеостаза является повышенная элиминация макроэлемента с мочой. Анализ суточной кальций- и фосфатурии не установил каких-либо отклонений по сравнению, как с контролем (2,01±1,98 ммоль/л/сутки и 16,74±7,74 ммоль/л/сутки соответственно), так и референсными показателями. Таким образом, форсированная почечная экскреция электролитов у пациентов с СГМС не относилась к непосредственным причинам развития гипокальциемии.
Одной из основных причин персистирующей гипокальциемии, как известно, является дефицит витамина D ‒ основного регулятора фосфорно-кальциевого обмена, стимулирующего его активное кишечное всасывание и почечную канальцевую реабсорбцию [8, 9]. Так при гиповитаминозе D даже адекватное поступление кальция с пищей не всегда обеспечивает нормальное содержание данного макроэлемента в крови [1, 12]. Исследование сывороточного уровня 25(ОН)D продемонстрировало тенденцию к снижению средних показателей: 23,64±8,3 нг/мл при гипермобильном синдроме vs 27,07±6,93 нг/мл в контрольной группе (р>0,05). При современных оптимальных целевых критериях 25(ОН)D свыше 30 нг/мл это не соответствовало статусу адекватного насыщения ни у больных СГМС, ни в контроле [3, 10]. Полученные данные характеризуют широкую распространенность гиповитаминоза D в общей популяции с повышением риска D-дефицита при наличии соединительнотканной патологии. Распространенность дефицита D среди пациентов с СГМС оказалась достоверно высокой по сравнению с 4% в группе контроля (χ2=3,782, р=0,048). Показатели 25(ОН)D менее 20 нг/мл (cut-off D-дефицитного состояния) установлены у 28,8% пациентов с гипермобильностью, а тяжелый – менее 10 нг/мл дефицит отмечен у 4,1% больных.
Наиболее исследован отрицательный эффект D-дефицита на остеогенетические процессы с ухудшением качественных и количественных характеристик костной ткани. Однако роль 25(ОН)D при СГМС гораздо шире, что обусловлено участием его минорных фракций и некоторых промежуточных метаболитов в ремоделировании элементов хрящевой ткани, а также подтвержденным наличием рецепторов к кальцидиолу на хондроцитах [1, 8].
Распространенность гиповитаминоза D с достоверным повышением частоты случаев выраженного D-дефицита у пациентов с СГМС актуализирует вопрос целенаправленной оценки статуса витамина D и адекватного восполнения его недостаточности в указанной группе.
Исследование ПТГ ‒ другого важнейшего гормонального регулятора, действие которого также направлено на удержание адекватного уровня кальциемии, продемонстрировало его достоверное снижение. Средний показатель ПТГ у пациентов с СГМС составил 18,4±4,5 по сравнению с 37,3±9,4 пг/мл в группе контроля (р<0,05), не отклоняясь однако из референсного диапазона в обеих группах обследованных.
Заключение. В современной медицине вектор воздействий при многих патологических состояниях смещается от активных лечебных стратегий к профилактическим программам. Как известно, знание и исключение факторов риска позволяет избежать многих хронических заболеваний. Особое внимание уделяется программам профилактики социально значимых заболеваний, в том числе остеопороза и остеопоретических переломов. Таким образом, распространенность гипокальциемии и недостаточности витамина D у пациентов с синдромом гипермобильности суставов диктует необходимость исследования показателей фосфорно-кальциевого гомеостаза и его основных гормональных регуляторов для целенаправленной коррекции и стабилизации костного минерального обмена.
Литература
- Ершова О.Б., Белова К.Ю., Назарова А.Н. Кальций и витамин D: все ли мы о них знаем? // РМЖ.- 2011.- №12 (19). – С. 719-724.
- Захарова, И.Н. Остеопения у подростков: фокус на элементный гомеостаз / И.Н. Захарова, Т.М. Творогова, А.С. Воробьева // Русский медицинский журнал. ‒ ‒ Том 17. ‒ № 1.‒ С. 45-49.
- Клинические рекомендации Российской ассоциации эндокринологов по диагностике, лечению и профилактике дефицита витамина D / Под ред. И.И. Дедова, Г.А. Мельниченко. – Ярославль: Литерра, 2015.‒ 77 с.
- Лесняк, О.М. Остеопороз / Под ред. О.М. Лесняк, Л.И. Беневоленской.- 2-е изд.- М.: ГЭОТАР-Медиа, 2012. ‒ 272 с.
- Национальные рекомендации Российского научного медицинского общества терапевтов по диагностике, лечению и реабилитации пациентов с дисплазиями соединительной ткани // Медицинский вестник Северного Кавказа. –- № 1 (11). – С. 2-76.
- Спивак Е.М., Комракова С.А. Минеральная плотность кости и особенности ее метаболизма при синдроме недифференцированной дисплазии соединительной ткани у детей // Вестник Ивановской медицинской академии. ‒ 2010. ‒ Т.15, №1. ‒ С. 36-38.
- Щеплягина, Л.А. Истоки остеопороза взрослых лежат в детском возрасте / Л.А. Щеплягина, И.В. Круглова, Т.Ю. Моисеева // Лечение и профилактика. ‒ 2013. ‒ №1 (5). ‒ С. 5-11.
- Bartl R. Osteoporose / Georg Thieme Verlag KG, Stuttgart, 2008.- 287 p.
- Bone C., Einhorn T. Overview of osteoporosis: pathophysiology and determinants of bone strength // Eur. Spine J. ‒ ‒Vol. 12. ‒ P. 90-96.
- Hollis B.W. Circulating 25 hydroxyvitamin D levels indicative of vitamin D sufficiency: implication for establishing a new effective dietary intake recommendation for vitamin D // D. J. Nutr. ‒ 2005; 135: 317.
- Javaid M.K., Cooper C. Prenatal and childhood influences on osteoporosis. Best Pract Res // J Clin Endocrinol Metab. ‒ ‒ 16: 349-367.
- Rizzoli R., Boonen S., Brandi M.L. et al. The role of calcium and vitamin D in the management of osteoporosis // Bone. ‒ 2008. ‒ № 42. ‒ 246-249.
References
- Ershova O.B., Belova K.YU., Nazarova А.N. Kal'tsij i vitamin D: vse li my o nikh znaem? // Russkij meditsinskij zhurnal.‒ Russian medical journal. ‒ 2011; 12 (19): 719-724.
- Zakharova, I.N. Osteopeniya u podrostkov: fokus na ehlementnyj gomeostaz / I.N. Zakharova, T.M. Tvorogova, А.S. Vorob'eva // Russkij meditsinskij zhurnal. ‒ Russian medical journal. ‒ 2009; 1 (17): 45-49.
- Dedov I.I., Melnichenko G.A. Klinicheskiye rekomendatsii Rossiyskoy assotsiatsii endkrinologov po diagnostike, lecheniyu i profilaktike defitsita vitamina D. Yaroslavl: Literra; 2015. ‒ 77 р.
- Lesnyak O.M., Benevolenskaya I. Osteoporos.- M.: GEOTAR-Media, 2012. ‒ 272 p.
- Natsionalnye rekomendatsii Rossiyskogo nauchnogo meditsinskogo obschestva terapevtov po diagnostike, lecheniyu i reabilitatsii patsientov s displasiyami soyedinitelnoy tkani. Meditsinskiy Vestnik Severnogo Kavkaza – Medical News of North Caucasus. 2016; 1 (11): 2-76.
- Spivak E.M., Komrakova S.А. Mineral'naya plotnost' kosti i osobennosti ee metabolizma pri sindrome nedifferentsirovannoj displazii soedinitel'noj tkani u detej // Vestnik Ivanovskoj meditsinskoj akademii. ‒ Bulletin of Ivanov Medical State Academy. ‒ 2010; 1 (15): 36-38.
- SHHeplyagina, L.А. Istoki osteoporoza vzroslykh lezhat v detskom vozraste / L.А. SHHeplyagina, I.V. Kruglova, T.YU. Moiseeva // Lechenie i profilaktika. ‒ Treatment and prevention. ‒ 2013; 1 (5): 5-11.
- Bartl R. Osteoporose / Georg Thieme Verlag KG, Stuttgart, 2008.- 287 p.
- Bone C., Einhorn T. Overview of osteoporosis: pathophysiology and determinants of bone strength // Eur. Spine J. ‒ ‒Vol. 12. ‒ P. 90-96.
- Hollis B.W. Circulating 25 hydroxyvitamin D levels indicative of vitamin D sufficiency: implication for establishing a new effective dietary intake recommendation for vitamin D // D. J. Nutr. ‒ 2005; 135: 317.
- Javaid M.K., Cooper C. Prenatal and childhood influences on osteoporosis. Best Pract Res // J Clin Endocrinol Metab. ‒ ‒ 16: 349-367.
- Rizzoli R., Boonen S., Brandi M.L. et al. The role of calcium and vitamin D in the management of osteoporosis // Bone. ‒ 2008. ‒ № 42. ‒ 246-249.
