ИЗМЕНЕНИЯ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ФОЛЛИКУЛЯРНЫХ ТИРОЦИТОВ КРЫС, ПОДВЕРГАВШИХСЯ ВОЗДЕЙСТВИЮ НИЗКИХ ДОЗ ДДТ С ПЕРВЫХ ДНЕЙ ПОСТНАТАЛЬНОГО РАЗВИТИЯ
Яглова Н.В.1, Следнева Ю.П.2, Назимова С.В. 3
1Доктор медицинских наук, ФГБНУ «НИИ морфологии человека»;
2аспирант, ФГБНУ «НИИ морфологии человека»; 3 кандидат медицинских наук,
ФГБНУ «НИИ морфологии человека»
ИЗМЕНЕНИЯ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ФОЛЛИКУЛЯРНЫХ ТИРОЦИТОВ КРЫС, ПОДВЕРГАВШИХСЯ ВОЗДЕЙСТВИЮ НИЗКИХ ДОЗ ДДТ С ПЕРВЫХ ДНЕЙ ПОСТНАТАЛЬНОГО РАЗВИТИЯ
Аннотация
Изучено влияние постнатального воздействия низких доз эндокринного дисраптора дихлордифенилтрихлорэтана (ДДТ) на функциональную активность фолликулярных тироцитов крыс. Определение тиреоидного статуса и иммуноферментное и иммуногистохимическое определение синтеза протеинов, обеспечивающих поступление йодидов и их органификацию в фолликулярных тироцитах, показывают, что дисрапторное действие ДДТ обусловливает развитие гипотиреоза и заключается в снижении синтеза натрий-йодного симпортера в периферической, а затем в центральной зоне долей щитовидной железы, что вызывает реактивное усиление синтеза тиреопероксидазы в пубертатном периоде с последующем ее снижением.
Ключевые слова: эндокринные дисрапторы, ДДТ, натрий-йодный симпортер, тиреопероксидаза, щитовидная железа.
Yaglova N.V.1, SlednevaY.P.2, Nazimova S.V.3
1MD, Research Institute of Human Morphology, 2 postgraduate student, Research Institute of Human Morphology,
3PhD in Medicine, Research Institute of Human Morphology
CHANGES IN FUNCTIONAL ACTIVITY OF RAT THYROID FOLLICULAR CELLS AFTER LOW-DOSE EXPOSURE TO DDT IN POSTNATAL DEVELOPMENT
Abstract
Thyroid follicular cells function after long-term exposure to low doses of dichlorodiphenyltrichloroethane (DDT) during postnatal development was studied. Evaluation of thyroid hormone profile, immunohistochemical examination and serum quantification of proteins mediating iodine supply and organification in thyroid cells showed that DDT-induced hypothyreosis is caused by downregulation of sodium-iodide symporter first in peripheral and than in central parts of thyroid lobes in puberty followed by enhanced expression of thyroid peroxidase and its further downregulation.
Keywords: endocrine disrupting chemicals, DDT, sodium-iodide symporter, thyroid peroxidase, thyroid gland.
Введение
В последние годы в развитых странах отмечается увеличение числа заболеваний щитовидной железы (ЩЖ) в том числе у детей и подростков [6], что, по мнению ряда специалистов может быть обусловлено воздействием на организм эндокринных дисрапторов [8]. Одним из наиболее распространенных на планете дисрапторов является дихлордифенилтрихлорэтан (ДДТ). Ранее проведенные нами исследования показали, что воздействие низких доз ДДТ на половозрелых крыс приводит к изменению секреторной активности фолликулярных тироцитов, связанной со снижением экспрессии натрий-йодного симпортера [3]. В научной литературе имеются сведения, что эффекты эндокринных дисрапторов могут отличаться в зависимости от возраста, в котором началось воздействие, однако эта проблема мало изучена [7].
Цель исследования – оценка показателей функциональной активности фолликулярных тироцитов крыс, подвергавшихся воздействию низких доз ДДТ с первых дней постнатального развития, в пубертатном и постпубертатном периодах.
Материалы и методы
Эксперимент выполнен на новорожденных самцах (n=24) крыс линии Вистар. Моделировали воздействие низких доз ДДТ аналогичное, потреблению его у человека: в подсосном периоде новорожденные крысы опытной группы (n=12) потребляли ДДТ с молоком матери, получавшей вместо воды растворы о,п-ДДТ (“Sigma”, США) с концентрацией 20мкг/л, а затем самостоятельно аналогичный раствор ДДТ. Животных умерщвляли через 6 (пубертатный период) и 10 (постпубертатный период) недель после рождения передозировкой золетила. Потребляемую дозу ДДТ рассчитывали согласно требованиям к определению низких доз для ДДТ и максимально допустимым уровням содержания ДДТ в продуктах питания в России [1]. Потребление ДДТ крысами составило 3,71±0,15мкг/кг/сут. Животные контрольной группы (n=12) получали водопроводную воду. В сыворотке крови иммуноферментным методом определяли концентрации общего тироксина (Т4) и общего трийодтиронина (Т3) (“Monobind”, США), тиреотропного гормона (ТТГ), рецепторов к ТТГ, натрий-йодного симпортера (НЙС) и тиреопероксидазы (ТПО) (“Cusabio”, Китай). Экспрессию НЙС и ТПО в ЩЖ определяли иммуногистохимическим методом с помощью моноклональных антител (“Abcam”, “Santa Cruz Biotechnology”, США) с визуализацией тест-системой «Ultravision LP Detection System» (“Thermo Fisher Scientific”, США). Определяли процентное количество клеток с высокой, умеренной и низкой экспрессией антигена с учетом региональных различий по отдельности в центральных и периферических зонах долей ЩЖ, составляющих одну треть и две трети доли [2]. Полученные данные подвергали статистическому анализу с помощью программы Statistica 7.0 (Statsoft Inc., США). Статистически значимыми различия считались при р<0,01.
Результаты и их обсуждение
У крыс опытной группы в периоде полового созревания выявлено уменьшение концентрации Т4, повышение содержания ТТГ и рецепторов к ТТГ, по сравнению со значениями контрольной группы, что свидетельствует о развитии гипотиреоза (табл.). Концентрация НЙС в сыворотке крови у крыс данной группы была статистически значимо меньше в среднем на 16%, а ТПО – больше на 13% по сравнению со значениями контрольной группы (табл.).
Таблица 1 – Изменения показателей функциональной активности фолликулярных эпителиоцитов щитовидной железы при воздействии низких доз эндокринного дисраптора ДДТ с первых дней постнатального развития (M±m)
| Группы и сроки воздействия Показатель | 6 недель | 10 недель | ||
| Контрольная группа | ДДТ | Контрольная группа | ДДТ | |
| Т4, мкг/дл | 2,54±0,19 | 2,07±0,18* | 2,25±0,16 | 2,36±0,16 |
| Т3, нг/мл | 0,86±0,05 | 0,94±0,04 | 1,07±0,06# | 0,94±0,03* |
| ТТГ, мкМЕ/мл | 0,68±0,03 | 0,93±0,04* | 0,65±0,03 | 1,38±0,06*# |
| Рецептор ТТГ, МЕ/л | 2,97±0,13 | 5,16±0,23* | 2,17±0,12# | 3,40±0,15*# |
| НЙС, пг/мл | 3,02±0,11 | 2,54±0,10* | 2,27±0,12# | 1,92±0,08*# |
| ТПО, нг/мл | 3,05±0,11 | 3,44±0,07 | 3,77±0,16# | 3,31±0,14* |
Примечания: * – статистически значимые отличия от значений контрольной группы, # – от предыдущего срока исследования.
У контрольных животных экспрессия НЙС в фолликулярном эпителии была высокой и имела региональные различия. В периферической зоне долей процент клеток, обильно экспрессирующих НЙС, был выше, чем в центральной (рис. 1а,б). Доля клеток с очень низким уровнем НЙС была мала и не имела отличий в периферических и центральных зонах долей.
У крыс, потреблявших ДДТ в низких дозах с первого дня постнатального развития, экспрессия НЙС в фолликулярных тироцитах не имела региональных различий (рис. 1а,б). По сравнению с контрольной группой отмечалось статистически значимое снижение процента клеток с высокой экспрессией НЙС в периферической зоне долей. В центральной зоне долей, наоборот, отмечалось усиление экспрессии НЙС, но оно не достигло статистической значимости.
У крыс контрольной группы в периферических и центральной зонах долей ЩЖ фолликулярный эпителий характеризовался высокой экспрессией ТПО (рис. 2а,б).
У крыс, подвергавшихся воздействию ДДТ, выявлено увеличение доли клеток с высокой экспрессией ТПО в периферической и особенно в центральной зонах долей (рис. 2а,б).
После наступления половой зрелости у крыс контрольной группы выявлены увеличение продукции Т3 и снижение синтеза рецепторов к ТТГ (табл.). Отмечалось статистически значимые снижение концентрации НЙС в сыворотке крови в среднем на 25% (табл.) и увеличение концентрации ТПО в сыворотке крови в среднем на 25% (табл.).
У крыс, подвергавшихся воздействию низких доз ДДТ, уровень Т4 в системном кровотоке нормализовался, но не наблюдалось повышения Т3 в отличие от контрольной группы, вследствие чего содержание Т3 в сыворотке крови было более низким. Соответственно, уровень ТТГ также повысился. Продукция рецепторов к ТТГ уменьшилась, но сохранялась на повышенном уровне (табл.). Наблюдалось уменьшение концентрации НЙС на 25% по сравнению с предыдущим сроком исследования. Концентрация НЙС была статистически значимо ниже, чем в контрольной группе аналогичного возраста (табл.). Также выявлено статистически незначимое уменьшение концентрации ТПО по сравнению с предыдущим сроком исследования. Таким образом, по сравнению с контрольными значениями у крыс, подвергавшихся воздействию дисраптора, содержание ТПО в крови было статистически значимо меньшим (табл.).
В фолликулярных эпителиоцитах периферической зоны долей ЩЖ крыс контрольной группы в постпубертатном периоде экспрессия НЙС не изменялась по сравнению с предыдущим сроком исследования (рис. 1а). В центральной зоне долей экспрессия НЙС была менее выраженной по сравнению с периферической зоной. По сравнению с предыдущим сроком исследования выявлено статистически значимые уменьшение доли клеток с высокой экспрессией и увеличение доли клеток с низкой экспрессией НЙС (рис. 1б).
После достижения половой зрелости у крыс опытной группы в периферических зонах долей не выявлено существенных изменений экспрессии НЙС, но отмечалось появление участков массивной гибели эпителия и деструкции фолликулов. По сравнению со значениями контрольной группы аналогичного возраста выявлено статистически значимое уменьшение высоко экспрессирующих НЙС фолликулярных тироцитов (рис. 1а). В центральных зонах долей отмечалось уменьшение экспрессии НЙС по сравнению с предыдущим сроком исследования, как и в контрольной группе, но оно было значительно более выраженным, вследствие чего доля клеток с высокой экпрессией НЙС была в 2,5 раза меньше значений контрольной группы (рис. 1б).
У крыс контрольной группы в постпубертатном периоде отмечалось статистически значимое уменьшение экспрессии ТПО в фолликулярном эпителии периферической зоны долей и увеличение в центральной зоне долей по сравнению с предыдущим сроком исследования (рис. 2а,б).
У крыс, подвергавшихся воздействию дисраптора, в постпубертатном периоде в участках паренхимы без деструктивных изменений выявлено статистически значимое снижение доли клеток, активно синтезирующих ТПО, и в периферических и в центральных зонах долей. В центральной зоне этот показатель был статистически значимо ниже контрольных значений (рис. 2а,б).
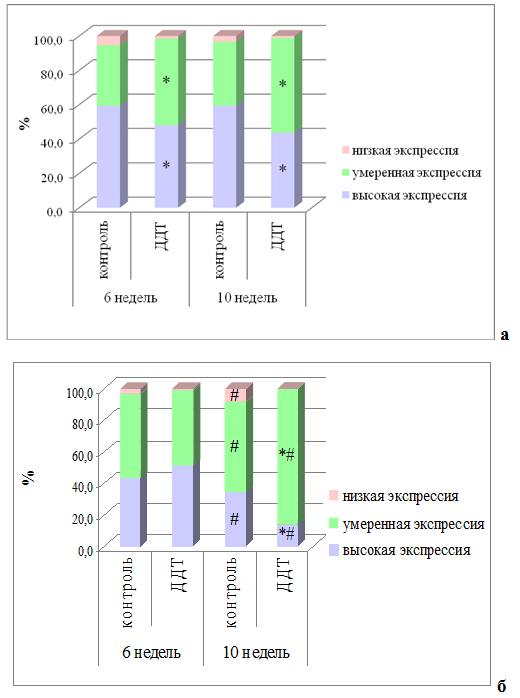
Рис. 1 – Выраженность экспрессии натрий-йодного симпортера в фолликулярных тироцитах периферической и центральной зон долей щитовидной железы у самцов крыс, подвергшихся воздействию низких доз ДДТ, и контрольной группы в постпубертатном периоде.
Примечания: * – статистически значимые отличия от значений контрольной группы, # – от предыдущего срока исследования
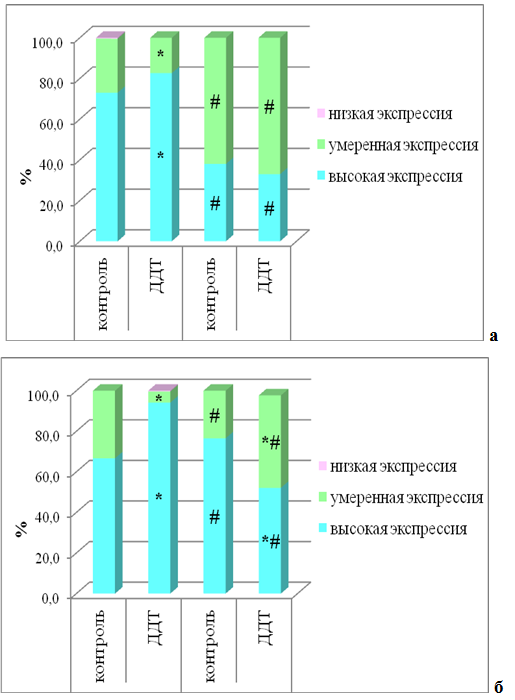
Рис. 2 – Выраженность экспрессии тиреопероксидазы в фолликулярных тироцитах периферической и центральной зон долей щитовидной железы у самцов крыс, подвергшихся воздействию низких доз ДДТ, и контрольной группы в постпубертатном периоде.
Примечания: * – статистически значимые отличия от значений контрольной группы, # – от предыдущего срока исследования
Анализ полученных данных показывает, у крыс, подвергавшихся воздействию низких доз ДДТ, в возрасте 6-ти недель выявлено снижение функциональной активности, обусловленное уменьшением экспрессии НЙС, осуществляющего транспорт йодидов в фолликулярные эпителиоциты. Определение экспрессии НЙС показало разную чувствительность этих клеток к дисрапторному действию. У крыс контрольной группы синтез НЙС наиболее активно протекал в эпителии периферической зоны долей и именно в этой зоне у опытных животных наблюдалось уменьшение экспрессии симпортера. Уменьшение числа ионных каналов в плазмолемме привело к реактивному повышению продукции ТПО, катализирующей включение йодидов в молекулу тироглобулина. Усиление экспрессии фермента происходило и в центральной и периферической зонах долей. У крыс контрольной группы синтез ТПО также протекал с одинаковой активностью в различных участках паренхимы долей ЩЖ. Однако эти реактивные изменения, обусловленные стимулирующим действием ТТГ на секреторные процессы, не позволяли достичь эутиреоза, в то время как у крыс, подвергавшихся в течение 6-ти недель, начиная с пубертатного периода, воздействию аналогичных доз ДДТ, развивался гипертиреоз на фоне значительно более выраженного подавления экспрессии НЙС и усиления синтеза ТПО [4].
У крыс контрольной группы после наступления половой зрелости региональные различия в экспрессии фолликулярными тироцитами НЙС стали более выраженными из-за уменьшения синтеза НЙС в центральной зоне долей. В целом это привело к снижению концентрации НЙС и реактивному повышению синтеза ТПО. Появились региональные различия в экспрессии ТПО вследствие ее снижения в периферических и выраженного повышения в центральных зонах долей.
У крыс, подвергавшихся воздействию низких доз ДДТ, в постпубертатном периоде произошло уменьшение конвертации Т4 в наиболее активную форму гормонов – Т3, что и обусловило повышение секреции ТТГ. Тем не менее, отмечено снижение экспрессии рецепторов ТТГ, что свидетельствует о высоком проценте связывания рецепторов с лигандом [5, 6]. Изменения экспрессии НЙС в периферических и центральных зонах долей ЩЖ имели аналогичный характер, но уменьшение синтеза НЙС в центральной зоне было более выраженным, что вместе с гибелью участков паренхимы обусловило более низкое его содержание в сыворотке крови. Синтез ТПО в центральных зонах был более высоким, чем в периферических, то есть региональные особенности экспрессии не были нарушены. В отличие от контрольной группы концентрация ТПО в крови не увеличивалась, а, наоборот, демонстрировала тенденцию к снижению. То есть причина гипотиреоза – подавление экспрессии НЙС, сохранялась, но реактивный потенциал тироцитов уменьшался.
Выводы
Воздействие низких доз ДДТ с первых дней жизни приводит к снижению секреторной активности фолликулярных эпителиоцитов и гипотиреозу, которые отличаются более медленными темпами развития, чем при воздействии на взрослый организм аналогичных доз дисраптора.
Основным механизмом дисрапторного действия является снижение экспрессии фолликулярными тироцитами натрий-йодного симпортера. В пубертатном периоде наиболее подверженными дисрапторному действию ДДТ являются тироцитов в периферических зонах долей щитовидной железы.
Реактивным изменением, направленным на восстановление эутиреоза, является повышение синтеза тироцитами тиреопероксидазы. Отсутствие региональных различий в экспрессии тиреопероксидазы свидетельствует об одинаковой чувствительности тироцитов периферических и центральной зон к стимулирующему воздействию ТТГ.
Список литературы / References
- Гигиенические требования безопасности и пищевой ценности пищевых продуктов. СанПин 2.3.2.1078-01. – 2008. https://gosstandart.info/data/documents/sanpin3.2.1078-01.doc
- Яглова Н.В. Нарушения секреторного цикла фолликулярных тироцитов и их коррекция тиреотропным гормоном при экспериментальном синдроме нетиреоидных заболеваний / Н.В. Яглова // Бюлл. экспер. биол. – 2011. – Т.152. – №8. – С. 215-219.
- Яглова Н.В. Изменения тиреоидного статуса крыс при длительном воздействии низких доз дихлордифенилтрихлорэтана (ДДТ) / Н.В. Яглова, В.В. Яглов // Бюлл. экспер. биол. – 2013. – Т.156. – №12. – С.720-722.
- Яглова Н.В. Механизмы дисрапторного действия дихлордифенилтрихлорэтана (ДДТ) на функционирование фолликулярных эпителиоцитов щитовидной железы / Н.В. Яглова, В.В. Яглов // Бюлл. эспер. биол. – 2015. – Т.160. –№8. – С.196-199.
- Akamizu T. Cloning, chromosomal assignment, and regulation of the rat thyrotropin receptor: expression of the gene is regulated by thyrotropin, agents that increase cAMP levels, and thyroid autoantibodies/ T. Akamizu, S. Ikuyama, M. Saji, S. Kosuqi, C. Kozak, O. McBride, L. Kohn // Natl. Acad. Sci. USA. – 1990. – Vol. 87. – P. 5677-5681.
- Huber G. The positive regulation of human thyrotropin (TSH) receptor messenger ribonucleic acid by recombinant human TSH is at the intranuclear level/ G. Huber, S. Weinstein, P. Graves, T. Davies. // – 1992. – Vol. 130. – P.2858–2864.
- Sharpe R. Pathways of endocrine disruption during male sexual differentiation and masculinisation/ R. Sharpe // Pract. Res. Clin. Endocrinol. Metab. – 2006. – Vol. 20. – P. 91-110.
- State of the science of endocrine disrupting chemicals 2012. United Nations Environment Programme and World Health Organization. – 2013. – 260p. http://www.unep.org/pdf/WHO_HSE_PHE_IHE_2013.1_eng.pdf
Список литературы на английском языке / References in English
- Gigienicheskie trebovanija bezopasnosti i pishhevoj cennosti pishhevyh produktov. SanPin 2.3.2.1078-01. – 2008. [Hygienic requirements for safety and nutritional value of foods. SanPin] https://gosstandart.info/data/documents/sanpin3.2.1078-01.doc .[In Russian]
- Yaglova N.V. Narushenija sekretornogo cikla follikuljarnyh tirocitov i ih korrekcija tireotropnym gormonom pri jeksperimental'nom sindrome netireoidnyh zabolevanij [Disorders in the Secretory Cycle of Follicular Thyrocytes and Their Сorrection with Thyrotropic Hormone in Experimental Non-Thyroidal Illness Syndrome] / N.V. Yaglova// Bjulleten' jeksperimental'noj biologii i mediciny [Bulletin of Experimental Biology and Medicine]. – 2011. – V. 152. №. 2. Р.253-257. [In Russian]
- Yaglova N.V. Izmenenija tireoidnogo statusa krys pri dlitel'nom vozdejstvii nizkih doz dihlordifeniltrihlorjetana (DDT) [Changes in Thyroid Status of Rats after Prolonged Exposure to Low Dose Dichlorodiphenyltrichloroethane]/ N.V.Yaglova, V.V. Yaglov // Bjulleten' jeksperimental'noj biologii i mediciny [Bulletin of Experimental Biology and Medicine]. – 2014. – V. 156. – №.6. – Р.760-762.[In Russian]
- Yaglova N.V. Mehanizmy disraptornogo dejstvija dihlordifeniltrihlorjetana (DDT) na funkcionirovanie follikuljarnyh jepiteliocitov shhitovidnoj zhelezy [Mechanisms of Disruptive Action of Dichlorodiphenyltrichloroethane (DDT) on the Function of Thyroid Follicular Epitheliocytes] // N.V.Yaglova, V.V. Yaglov // Bjulleten' jeksperimental'noj biologii i mediciny [Bulletin of Experimental Biology and Medicine]. – 2015. V. 160. №. 2. Р.231-233.[In Russian]
- Akamizu T. Cloning, chromosomal assignment, and regulation of the rat thyrotropin receptor: expression of the gene is regulated by thyrotropin, agents that increase cAMP levels, and thyroid autoantibodies/ T. Akamizu, S. Ikuyama, M. Saji, S. Kosuqi, C. Kozak, O. McBride, L. Kohn // Natl. Acad. Sci. USA. – 1990. V. 87. P. 5677-5681.
- Huber G. The positive regulation of human thyrotropin (TSH) receptor messenger ribonucleic acid by recombinant human TSH is at the intranuclear level/ G. Huber, S. Weinstein, P. Graves, T. Davies. // – 1992. – V. 130. – P.2858–2864.
- Sharpe R. Pathways of endocrine disruption during male sexual differentiation and masculinisation/ R. Sharpe // Pract. Res. Clin. Endocrinol. Metab. – 2006. – V. 20. – P. 91-110.
- State of the science of endocrine disrupting chemicals 2012. United Nations Environment Programme and World Health Organization. – 2013. – 260p. http://www.unep.org/pdf/WHO_HSE_PHE_IHE_2013.1_eng.pdf
