АКТИВНОСТЬ МАРКЕРОВ КЛЕТОК КРОВИ ПРИ ПИЕЛОНЕФРИТЕ И ВВЕДЕНИИ ЭРИТРОЦИТАРНОЙ ФОРМЫ ЦЕФТРИАКСОНА
Братчиков О.И.1, Сипливый Г.В.2, Ипатов В.Ю.3, Кукурека А.В.4, Яцюк В.Я.5, Сипливая Л.Е.6
1Профессор, доктор медицинских наук, Курский государственный медицинский университет, 2доцент, доктор медицинских наук, Курский государственный медицинский университет, 3аспирант, Курский государственный медицинский университет, 4кандидат фармацевтических наук, Курский государственный медицинский университет, 5профессор, доктор фармацевтических наук, Курский государственный медицинский университет, 6ORCID: 0000-0003-0195-8950, профессор, доктор биологических наук, Курский государственный медицинский университет
АКТИВНОСТЬ МАРКЕРОВ КЛЕТОК КРОВИ ПРИ ПИЕЛОНЕФРИТЕ И ВВЕДЕНИИ ЭРИТРОЦИТАРНОЙ ФОРМЫ ЦЕФТРИАКСОНА
Аннотация
При экспериментальном гематогенном ипелонефрите у крыс резко изменялась активность маркеров клеток: угнетение активности НАДФ-оксидазы нейтрофилов, Mg2+ - АТФазы эритроцитов, снижение концентрации ФДФ в лимфоцитах и повышение содержания МДА в тромбоцитах. Системное введение цефтриаксона животным с пиелонефритом достоверно снижало активность метаболических маркеров нейтрофилов, лимфоцитов, эритроцитов и повышало уровень МДА в тромбоцитах. Введение эритроцитарной формы цефтриаксона нормализовало нарушенную при пиелонефрите активность метаболических маркеров: повышалась активность Mg2+ - АТФазы эритроцитов, НАДФН- оксидазы лейкоцитов, ФДФ в лимфоцитах и снижался уровень МДА в тромбоцитах.
Ключевые слова: маркеры клеток, экспериментальный пиелонефрит, эритроцитарная форма цефтриаксона.
Bratchikov O.I.1, Sipliviyi G.V.2, Ipatov V.Yu.3, Kukureka A.V.4, Yatsuk V.Ya.5, Siplivaya L.E.6
1Professor, MD, Kursk State Medical University; 2Assosiate professor, MD, Kursk State Medical University; 3Postgraduate student, Kursk State Medical University; 4PhD in Pharmaceutics, Kursk State Medical University; 5Professor, PhD in Pharmaceutics, Kursk State Medical University; 6ORCID: 0000-0003-0195-8950, Professor, PhD in Biology, Kursk State Medical University
ACTIVITY OF MARKERS OF BLOOD CELLS IN PYELONEPHRITIS AND THE INTRODUCTION OF ERYTHROCYTE FORMS CEFTRIAXONE
Abstract
In experimental hematogenous ipelonefrite rats dramatically altered cell activity markers inhibition activity of NADPH oxidase of neutrophils, Mg2 + - ATPase activity of red blood cells, reducing the concentration of FDF in lymphocytes and increase MDA content in platelets. Systemic administration of ceftriaxone animals with pyelonephritis significantly reduced the activity of metabolic markers of neutrophils, lymphocytes, red blood cells and increases the level of MDA in platelets. Introduction cell form of ceftriaxone in pyelonephritis normalized impaired activity of metabolic markers: increased activity of Mg2 + - ATPase activity of red blood cells, white blood cells NADFN- oxidase, FDF in lymphocytes and decreased the level of MDA in platelets.
Keywords: markers of cells, experimental pyelonephritis, erythrocyte form of ceftriaxone.Пиелонефрит – одно из самых распространенных заболеваний у человека и занимает второе место после острых респираторных инфекций. Пиелонефрит является основой глубоких морфологических и энзимопатических нарушений в почках, что в свою очередь вызывает системные иммунометаболические изменения [1]. В регуляции механизмов иммунологической защиты организма при пиелонефрите принимают участие нейтрофилы, лимфоциты, эритроциты, тромбоциты. Метаболическим маркером нейтрофилов может служить активность НАДФН-оксидазы, лимфоцитов – концентрация фруктозы-2,6-дифосфата (ФДФ), эритроцитов – активность Mg+2-АТФ-азы, тромбоцитов – содержание МДА.
Цель работы. Выяснить влияние эритроцитарной формы цефтриаксона на активность маркеров клеток крови при экспериментальном пиелонефрите.
Материалы и методы. Исследования проведены на белых беспородных крысах массой 180 – 200 г. Все животные содержались в одинаковых условиях, на обычном пищевом рационе. Для получения статистически достоверных результатов группы формировались из 9 животных, примерно одного возраста. Разброс в группах по исходной массе не превышал 10%. Все исследования проводили в одно и то же время суток с 8.00 до 12.00 с соблюдением принципов, изложенных в Конвенции по защите позвоночных животных, используемых для экспериментальных и других целей (г. Страсбург, Франция, 1986). Экспериментальный пиелонефрит моделировали путем однократного внутрижелудочного введения ртути дихлорида 2 мг/кг и внутривенной инъекции предварительно оттитрованных доз суточной агаровой культуры Staphylococcus aureus, содержащих 1×108 микробных тел в 0,5 мл раствора.
Для подтверждения развития необструктивного пиелонефрита проведены определения клинических показателей (масса и температура тела), лабораторных и гематологических показателей (количество и соотношение форменных элементов крови, концентрации мочевины и креатинина в крови) [2], морфологических и энзиматических изменений в почках.
В работе в качестве антибактериального препарата использовали цефтриаксон (Индия). При системном введении цефтриаксон вводили в дозе 15 мг/кг внутривенно, однократно.
Для включения цефтриаксона в строму эритроцитов (ЭН) использовали метод гипоосмотического гемолиза, позволяющий ввести максимально возможное количество препаратов (эритроцитарная форма) [3, С. 19-20], [4, С. 54-56]. В части опытов в инкубационную среду добавляли АТФ в количестве 0,5 мл.
Определение цефтриаксона в биоматериале проводили по нормативной документации на субстанцию препарата (высокоэффективной жидкостной хроматографией).
Активность НАДФН-оксидазы определяли спектрофотометрической методикой на спектрофотометре СФ 2000. Использовали квадратные кюветы с толщиной слоя 10 мм. Объем пробы равнялся 3 мл. В состав пробы входили Na-K-фосфатный буфер, гомогенат клеток (1 млн/мл), субстрат НАДФН (0,5 нмоль/мл). Контрольная проба не содержала субстрата. Определение проводили при комнатной температуре. Активность фермента оценивали по скорости НАДФН-оксигеназной реакции, рассчитываемой по убыли поглощения НАДФН (за счет его окисления) при длине волны 340 нм [5, С. 14-18].
Тромбоциты из крови выделяли по методике, описанной Ермолаевой Т.А. с соавторами [6, С. 33-38]. Метаболический маркер тромбоцитов МДА определяли по методике Негреску Е.В. с соавторами [7, С. 36-39].
Лимфоциты периферической крови выделяли по Т.В. Федосеевой с соавторами и определяли в них содержание ФДФ [8, С. 232-237].
Показателем активности эритроцитов может служить Mg2+-ATФаза, которую определяли по методике Рыжковой Г.Ф. и Вишнякова С.И. [9].
Статистическую обработку результатов исследования проводили путем вычисления средних арифметических изучаемых показателей (M) и их стандартных ошибок (m). Существенность различий средних величин оценивали по критериям Стьюдента и Вилкоксона-Манна-Уитни [10].
Результаты исследования и их обсуждения.
Установлено, что введение ртути дихлорида совместно с микробным агентом вызывало развитие необструктивного гематогенного пиелонефрита, подтверждающееся клиническими показателями: гипертермия, снижение веса на 12-14%, нарушение выделительной функции почек (табл. 1).
Таблица 1 – Изменение функциональных показателей у животных с необструктивным пиелонефритом
| Группа | ||
| Показатель | Контроль (здоровые крысы) | Введение ртути дихлорида и стафилококка |
| Температура тела, oС | 41,5±0,5 | 43,8±0,4 |
| Масса тела, г | 153,4±11,8 | 125,2±10,3 |
| Мочевина, ммоль/л | 132,4±13,2 | 278±27,1* |
| Креатинин, ммоль/л | 11,8±1,4 | 37,5±3,6* |
Анализ выделительной функции почек показал резкое повышение уровня в крови мочевины в 1,75-2,2 раза и креатинина в 1,8-3,2 раза, появление лейкоцитов и белка в моче (табл. 1).
Установлены изменения лейкоцитарной формулы – увеличение количества лейкоцитов на 30-35%, уменьшение количества лимфоцитов на 20-24% и повышение количества нейтрофилов крови на 21-23%. В почках отмечено снижение активности СДГ, ГДГ, ЩФ в 1,9-2,3 раза, на фоне высокой активности ЛДГ, выявлены морфологические изменения (очаговые скопления лейкоцитов в виде микроабсцессов) (рис. 1). В ходе приготовления гистологических препаратов использовалась окраска гематоксилином и эозином. При окраске цитоплазма клеток окрашивается в розовый цвет, ядра в фиолетовый.
Анализ патологических изменений в мозговом слое почек показал многочисленные очаговые некрозы, местами разрушенные канальцы и на их месте очаговые скопления лейкоцитов – микроабсцессы.
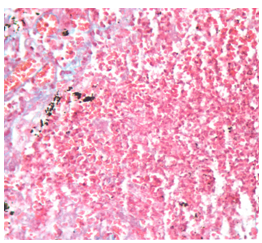
Рис. 1 - Морфологические изменения в препаратах почек при пиелонефрите. Окраска гематоксилином и эозином
Примечание: увеличение ×400У животных с пиелонефритом отмечено значительное подавление активности НАДФН-оксидазы нейтрофилов, Mg2+-АТФазы эритроцитов, снижение концентрации ФДФ в лимфоцитах и повышение содержания МДА в тромбоцитах.
Системное введение цефтриаксона животным с пиелонефритом достоверно снижало активности метаболических маркёров нейтрофилов, лимфоцитов, эритроцитов и повышало уровень МДА в тромбоцитах. В связи с полученными данными интересно было изучить влияние эритроцитарной формы цефтриаксона на функциональную активность клеток при пиелонефрите. Установлено, что введение ЭН с включенными антибактериальным препаратом повышало активности НАДФ-оксидазы нейтрофилов, Mg2+-АТФазы эритроцитов, концентрацию ФДФ в лимфоцитах и снижало содержание МДА в тромбоцитах (табл. 2).
Таблица 2 – Влияние эритроцитарной формы цефтриаксона на показатели функциональной активности клеток крови при пиелонефрите
| Условия опыта | НАДФН-оксидаза нейтрофилов | ФДФ лимфоцитов | Mg2+ АТФаза эритроцитов | МДА тромбоцитов |
| 1.Здоровые животные | 1,34±0,23 | 1,1±0,21 | 0,76±0,06 | 0,62±0,05 |
| 2. Животные с пиелонефритом | 0,61±0,07*1 | 0,71±0,06*1 | 0,52±0,04*1 | 0,82 ±0,07*1 |
| 3. Животные с пиелонефритом +ЭН с цефтриаксоном | 0,82±0,06*1,2 | 0,85±0,07*1,2 | 0,64±0,05*1,2 | 0,76±0,06*1,2 |
Обмен макроэргических соединений в эритроцитах в значительной степени определяется активностью мембранных АТФаз, осуществляющих энергозависимый перенос ионов через цитоплазматическую мембрану клеток. Особый интерес представляют Mg+2 – АТФаза, «накачивающая» в эритроциты ионы магния, активирующие большинство ферментов гликолиза [11] и в форме Mg-АТФаз, повышающие активность Na+ , K+ и Ca2+.
В связи с изложенным большой интерес представляло выяснение влияния ЭН с иммобилизованным в присутствии или без АТФ цефтриаксоном на активность Mg+2-АТФазы мембраны эритроцитов. Оказалось, что активность Mg+2-АТФазы повышалась только в случае введения ЭН с включенным в присутствии АТФ цефтриаксоном. Полученные результаты подтверждают, что необходимым условием активации Mg+2-АТФаз мембраны эритроцитов служит увеличение биологической доступности, вследствие возможного образования органических комплексов с АТФ (табл. 3).
Таблица 3 – Активность Mg+2-АТФазы в строме эритроцитов крыс, получавших инъекции ЭН с иммобилизованным в присутствии АТФ цефтриаксоном
|
Условия опыта |
Активность Mg+2-АТФазы (мкмоль фосфата на 1г белка в час) |
| 1. Контроль (строма эритроцитов интактных крыс) | 0,67 ± 0,08 |
| 2. Строма эритроцитов крыс с пиелонефритом, получавших ЭН с физиологическим раствором | 0,39 ± 0,04*1 |
| 3. Строма эритроцитов крыс с пиелонефритом, получавших ЭН с цефтриаксоном | 0,51 ± 0,05*1 |
| 4. Строма эритроцитов крыс с пиелонефритом, получавших ЭН с цефтриаксоном в присутствии АТФ | 0,73 ± 0,06*2 |
Заключение.
Таким образом, установлено, что введение клеточной формы (эритроцитарной) цефтриаксона нормализовало нарушенную при пиелонефрите активность метаболических маркеров: повышало активности Mg2+-АТФазы эритроцитов, НАДФН-оксидазы лейкоцитов, ФДФ в лимфоцитах и снижало уровень МДА в тромбоцитах.
Установленные изменения могут быть рекомендованы в качестве дополнительных критериев для прогнозирования иммунометаболической активности клеточных форм химиопрепаратов в условиях необструктивного пиелонефрита.
Список литературы / References
- Есилевский Ю.М. Патогенез пиелонефрита / Ю.М. Есилевский. -М.: МЕДпресс-информ, 2007. – 368 с.
- Меньшиков В.В. Лабораторные методы исследования в клинике: справочник /ред. В.В. Меньшиков. - М.: Медицина, 1987. - 365 с.
- Генинг Т.П. Фармакокинетика антибиотика, вводимого в организм в клеточных носителях / Т.П. Генинг, К.К. Мануйлов // Антибиотики и химиотерапия. - 1991. - № 9. - С. 19-20.
- Жумадилов Ж.Ш. Особенности включения некоторых антибиотиков в эритроцитарные тени - систему целенаправленной доставки химиотерапевтических препаратов / Ж.Ш. Жумадилов, Р.В. Макаренкова // Антибиотики и химиотерапия. - 1990. - Т. 35, № 11, - С. 54-56.
- Рыбников В.Н. Иммуномодулирующее действие эритроцитов и их стромы инкубированных с менадионом и гетерополисахаридами Poligonaceae при острой кровопотере / В.Н. Рыбников, И.Л. Бровкина, М.Г. Газазян // Антибиотики и химиотерапия. - 2003. - Т.48, №4. - С. 14-18.
- Ермолаева Т.А. Методы выделения из крови интактных тромбоцитов / Т.А. Ермолаева, О.Г. Головина, В.М. Пономаренко // Лабораторное дело. -1991. - № 10. - С. 33-38.
- Негреску Е.В. Антиоксиданты, перекисное окисление липидов и рецепторзависимое увеличение концентрации Са2+ в тромбоцитах человека / Е.В. Негреску, А.В. Лебедев, Г.Н. Балденков и др. // Вопросы медицинской химии. - 1992. - Т. 38, вып. 1.- С. 36-39.
- Коровкин Б.Ф. Изменение содержания фруктозо-2,6-бифосфата в лимфоцитах периферической крови больных сахарным диабетом // Б.Ф. Коровкин, Н.Ф. Беляева, С.А. Краевой и др. // Вопросы медицинской химии. -1999.- Т. 45, вып. 3. - С. 232-237.
- Рыжкова Г.Ф. Методическое пособие по выделению, очистке и определению активности транспортных АТФаз в органах и тканях животных / Г.Ф. Рыжкова, С.И. Вишняков. - Воронеж, 2005. - 31 с.
- Гублер Б.В. Вычислительные методы анализа и распознавания патологических процессов / Е.В. Гублер. - Л.: Медицина, 1978. - 294 с.
- Ленинджер А. Основы биохимии / А. Ленинджер // М.: Мир. - 1985, Т.1. - 365 с.
Список литературы на английском языке / References in English
- Esilevskij Ju.M. Patogenez pielonefrita [The pathogenesis of pyelonephritis] / Ju.M. Esilevskij. -M.: MEDpress-inform, 2007. - 368 p. [in Russian]
- Men'shikov V.V. Laboratornye metody issledovanija v klinike: spravochnik [Laboratory Methods in the clinic: a guide] / edited by V.V. Men'shikov. - M.: Medicina, 1987. - 365 p. [in Russian]
- Gening T.P. Farmakokinetika antibiotika, vvodimogo v organizm v kletochnyh nositeljah [Pharmacokinetics of antibiotic administered to an organism in cell media] / T.P. Gening, K.K. Manujlov // Antibiotiki i himioterapija [Antibiotics and Chemotherapy]. - 1991. - № 9. - P. 19-20. [in Russian]
- Zhumadilov Zh.Sh. Osobennosti vkljuchenija nekotoryh antibiotikov v jeritrocitarnye teni - sistemu celenapravlennoj dostavki himioterapevticheskih preparatov [Features include some antibiotics in erythrocyte shadows - a system of targeted delivery of chemotherapy drugs] / Zh.Sh. Zhumadilov, R.V. Makarenkova // Antibiotiki i himioterapija [Antibiotics and Chemotherapy]. - 1990. - V. 35, № 11, - P. 54-56. [in Russian]
- Rybnikov V.N. Immunomodulirujushhee dejstvie jeritrocitov i ih stromy inkubirovannyh s menadionom i geteropolisaharidami Poligonaceae pri ostroj krovopotere [Immunomodulatory effect of red blood cells and their stroma incubated with menadione and Poligonaceae heteropolysaccharide in acute blood loss] / V.N. Rybnikov, I.L. Brovkina, M.G. Gazazjan // Antibiotiki i himioterapija [Antibiotics and Chemotherapy]. - 2003. - V.48, №4. - P. 14-18. [in Russian]
- Ermolaeva T.A. Metody vydelenija iz krovi intaktnyh trombocitov [Methods of isolation of intact blood platelets] / T.A. Ermolaeva, O.G. Golovina, V.M. Ponomarenko // Laboratornoe delo [Laboratory case]. -1991. - № 10. - P. 33-38. [in Russian]
- Negresku E.V. Antioksidanty, perekisnoe okislenie lipidov i receptorzavisimoe uvelichenie koncentracii Ca2+ v trombocitah cheloveka [Antioxidants, lipid peroxidation and retseptorzavisimoe increase in Ca2+ concentration in human platelets] / E.V. Negresku, A.V. Lebedev, G.N. Baldenkov and others // Voprosy medicinskoj himii [Problems of Medical Chemistry]. - 1992. - V. 38, Issue 1.- P. 36-39. [in Russian]
- Korovkin B.F. Izmenenie soderzhanija fruktozo-2,6-bifosfata v limfocitah perifericheskoj krovi bol'nyh saharnym diabetom [Changing the content of fructose-2,6-biphosphate in peripheral blood lymphocytes of patients with diabetes mellitus] // B.F. Korovkin, N.F. Beljaeva, S.A. Kraevoj and others // Voprosy medicinskoj himii [Problems of Medical Chemistry]. -1999.- V. 45, Issue 3. - P. 232-237. [in Russian]
- Ryzhkova G.F. Metodicheskoe posobie po vydeleniju, ochistke i opredeleniju aktivnosti transportnyh ATFaz v organah i tkanjah zhivotnyh [Tool for isolation, purification and identification of transport ATPase activity in the organs and tissues of animals] / G.F. Ryzhkova, S.I. Vishnjakov. - Voronezh, 2005. - 31 p. [in Russian]
- Gubler B.V. Vychislitel'nye metody analiza i raspoznavanija patologicheskih processov [Computational methods of analysis and detection of pathological processes] / E.V. Gubler. - L.: Medicina, 1978. - 294 p. [in Russian]
- Lenindzher A. Osnovy biohimii [Fundamentals of Biochemistry] / A. Lenindzher // M.: Mir. - 1985, V.1. - 365 p. [in Russian]
