ИССЛЕДОВАНИЕ УСТОЙЧИВОСТИ ЛИТИЙПРОВОДЯЩИХ ПОЛИМЕРНЫХ ЭЛЕКТРОЛИТОВ К ВОДНЫМ РАСТВОРАМ КИСЛОТ И ЩЕЛОЧЕЙ
Дружинин К.В.
Кандидат химических наук, ФГБУН Институт высокотемпературной электрохимии Уральского отделения Российской академии наук, ФГБОУ Уральский федеральный университет имени первого Президента России Б.Н. Ельцина, Институт материаловедения и металлургии
ИССЛЕДОВАНИЕ УСТОЙЧИВОСТИ ЛИТИЙПРОВОДЯЩИХ ПОЛИМЕРНЫХ ЭЛЕКТРОЛИТОВ К ВОДНЫМ РАСТВОРАМ КИСЛОТ И ЩЕЛОЧЕЙ
Аннотация
В статье представлены данные об устойчивости литийпроводящих полимерных плёнок на основе фторопласта марки Ф-62 с солью-ионогеном перхлоратом лития к водным растворам кислот и щелочей на примере растворов соляной кислоты и гидроксида лития в диапазоне pH 1÷13. Исследовано как изменение химического состава образцов, так и изменение их электропроводности в результате выдерживания в водных растворах. Работа проведена для оценки применимости полимерных электролитов в качестве защиты литиевого анода от контакта с водной средой.
Ключевые слова: литийпроводящий полимерный электролит, химическая устойчивость.Druzhinin K.V.
PhD in Chemistry, Institute of High-Temperature Electrochemistry of Ural branch of RAS, Ural Federal University, Institute of Materials Science and Metallurgy of Urals Federal University named after B.N.Yeltsin
STABILITY OF LITHIUM-CONDUCTING POLYMER ELECTROLYTES VERSUS AQUEOUS SOLUTIONS OF ACIDS AND ALKALIS
Abstract
The article considers data of stability of lithium-conducting polymer films based on fluoropolymer F-62 and lithium perchlorate as ionogenic salt versus aqueous solutions of acids and alkalis – hydrochloric acid and lithium hydroxide in pH range 1÷13. Both chemical composition change and conductivity shifts of samples are investigated under exposure in water solutions. The research is aimed to estimate the applicability of polymer electrolytes as lithium metal protection from water in lithium-air power sources.
Keywords: lithium-conducting polymer electrolyte, chemical stability.Электрохимическая система, основанная на реакции взаимодействия лития с кислородом, является одним из рекордсменов по удельной энергоёмкости. В случае, если кислород не подаётся в чистом виде из баллонов, а вовлекается в реакцию из воздушной среды, теоретическая удельная энергоёмкость задаётся исключительно анодным материалом и составляет около 11760 Вт*ч/кг [1]. Главной проблемой при создании такого устройства является необходимость вывода образующегося продукта – оксида лития – из зоны реакции. Поисковые научные работы ведутся в двух направлениях. Одни исследователи применяют щелочной водный электролит, в котором основная электрохимическая реакция ведёт к образованию гидроксида лития, обладающего высокой растворимостью в воде. Этот вариант требует решения проблемы защиты анода – литий способен вступать в бурную реакцию с водой. Другие ведут поиск способа реализации устройства, работающего с органическим апротонным растворителем, образующим защитную проводящую плёнку (SEI) на поверхности металлического лития [2]. В последнем случае не решена проблема отвода продукта реакции, работа источника тока прекращается, когда оксид или пероксид лития полностью блокирует поверхность кислородного катода. К тому же, образующийся на поверхности раздела апротонный электролит/воздух продукт реакции также легко карбонизируется [3].
Катодным материалом в таких источниках тока обычно выступает платина. В настоящее время активно ведутся работы по замене её на более дешёвые углеродные материалы с высокоразвитой поверхностью [4]. Для таких катодных материалов добились значительных успехов, их циклируемость составляет более 100 циклов с сохранением значительных показателей ёмкости (единицы А*ч/г [5]). При этом указанные выше фундаментальные проблемы, возникающие при включении в схему литиевого анода, не позволяют на сегодняшний день создать высокоэнергоёмкий перезаряжаемый литий-воздушный источник тока.
Данная работа направлена на поиск решения задачи защиты литиевого анода от взаимодействия с водным электролитом путём ввода в систему твёрдополимерного электролита, обладающего проводимостью по ионам лития и не допускающего молекулы воды в контакт с поверхностью анода. Такая плёнка твёрдополимерного электролита являет собой аналог SEI, Введённый целенаправленно. Электрохимическую схему можно представить следующим образом:
Cu|Li(мет)|твёрдополим. Эл-т|водный эл-т|газодиффузионный катод, O2 (рис.1)
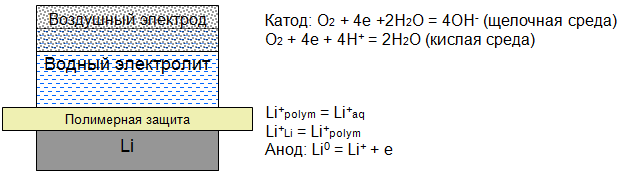
Рис. 1 – Предлагаемая схема литий-воздушного источника тока
Задачей твёрдополимерного электролита будет надёжное разделение анода и водного электролита в сочетании с высокими транспортными характеристиками по катионам лития. В качестве компонентов твёрдополимерного электролита были выбраны перхлорат лития и фторированный полимер Ф-62. Известны многие твёрдополимерные электролиты с перхлоратом лития, обладающие довольно высокими значениями электропроводности [6]. В то же время, фторопласты характеризуются достаточно высокой химической устойчивостью. Предварительные исследования показали, что система Ф-62 – LiClO4 обладает также неплохими транспортными характеристиками Опорными составами были выбраны плёнки с содержанием перхлората лития 0,01; 0,05; и 0,5 моль/кг.
Методики эксперимента.
Композиционные пленки готовили методом полива из совместного раствора полимера и перхлората лития. Методика является стандартной для изготовления полимерных плёнок и описана подробно в [7]. В качестве растворителя брали ацетонитрил H3C-CN марки «осч» сорт 0. Плёнки были изготовлены стандартной толщины 100 мкм. Все операции с исходными компонентами и полученными плёнками проводили в сухом аргоновом боксе.
Исследование устойчивости проводили в ячейке, дно которой было выполнено из исследуемой плёнки (рис.2), в ячейку заливали исследуемый раствор. Пустая камера под водным отсеком обеспечивала действие силы тяжести как движущей силы для молекул воды. Исходными жидкостями для исследования устойчивости были выбраны растворы соляной кислоты (pH = 1) и гидроксида лития (pH = 13). Выдержка при единичном эксперименте составляла 10 суток, после чего щелочной или кислотный раствор разбавляли дистиллированной водой до меньшего значения pH с шагом 1. До и после эксперимента химический состав плёнки контролировали с помощью метода ИК-спектроскопии, причём съёмку вели с двух сторон плёнки.
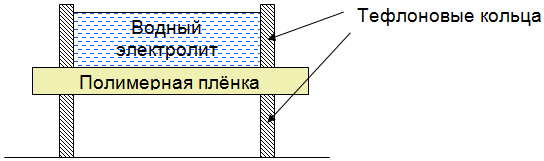
Рис. 2 – Схема ячейки для проведения исследования
Исследование устойчивости электролитов к водной среде проводилиИК-спектроскопическое исследование образцов полимерных плёнок проводили со съёмкой сигнала на отражение. Съемку спектров вели на спектрометре Tensor 27 Bruker с призмой KBr (область частот 400-4000 см-1). ИК-спектры исходные органические компоненты сравнивали с литературными спектрами из базы данных к программному обеспечению прибора (фирма Netzch). Характерные пики органических компонентов находили в области 600 – 4000 см-1.
Измерения электропроводности проводили методом импеданс-спектроскопии, измеритель иммитанса Е7-25 МНИПИ (г.Минск, Беларусь), диапазон частот 25 – 106 Гц, внешнее напряжение 0,04В. Электропроводность плёнок измеряли после последнего этапа выдержки в наиболее разбавленном растворе и сравнивали с данными, полученными для исходных плёнок. Перед измерениями плёнки высушивали от следов воды под вакуумом при 80 °С.
Результаты
На рисунках 3 и 4 представлены результаты ИК-спектроскопического исследования плёнок до и после выдержки, соответственно, в щелочном и кислом растворе.
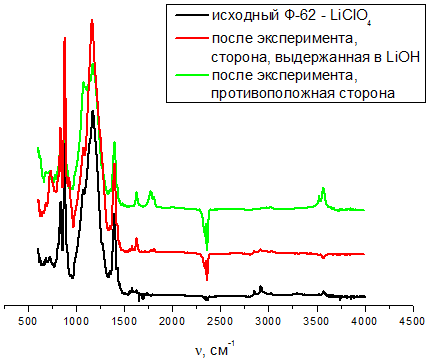
Рис. 3 – ИК-спектроскопическое исследование плёнки Ф-62 – LiClO4 до и после выдержки в щелочном растворе
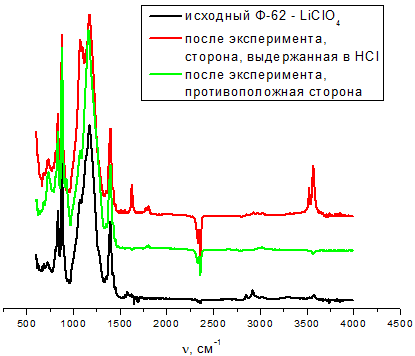
Рис. 4 – ИК-спектроскопическое исследование плёнки Ф-62 – LiClO4 до и после выдержки в HCl
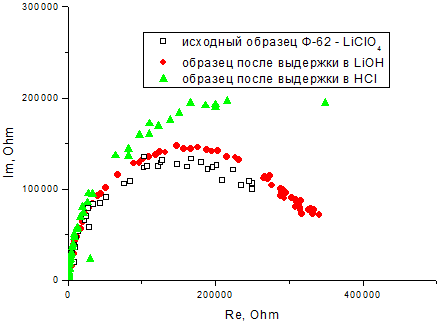
Рис. 5 – Образцы годографов импеданса образца Ф-62 – LiClO4 (C = 0,01 моль/кг) при комнатной температуре: свежеизготовленный образец и образцы после выдержки в водных растворах
На ИК-спектрах можны выделить появление новых рефлексов после выдержки в водных растворах, положение этих рефлексов указывает на то, что это рефлексы, относящиеся к воде (широкий в районе 3000-3300 см-1 и узкие пики в области 1750-1780 см-1). Их интенсивности говорят о том, что количество молекул воды можно принять следовым и это только вода, сорбированная на поверхности плёнки. Это подтверждается также тем, что интенсивность этих рефлесов на стороне, противоположной контктировавшей с водным раствором, минимальна – это могут быть молекулы воды, сорбированные за время эксперимента по снятию спектра.
Электропроводность образцов измеряли методом импеданса на блокирующих электрохимическую реакцию никелевых электродах. Ранее было установлено, что в данной системе сило переноса заряда по катинам лития близко к единице, поэтому в ходе данной работы числа переноса не определяли. Образцы годографов импеданса для исходной плёнки и после выдержки в водных растворах представлены на рисунке 5. Для всех составов после выдержки в щелочной среде электропроводность практически не изменилась, в то время как после выдержки в кислой среде сопротивление выросло в 2 – 4 раза. Это говорит о том, что кислотный раствор вымывает перхлорат лития с поверхности плёнки, в итоге концентрация катионов лития в образце снижается, что и ведёт к снижению электропроводности. Данные по величинам сопротивления сведены в таблицу 1.
Таблица 1 – Сопротивление образцов исследованных материалов до и после выдержки в водных растворах
| Сопротивление образцов при Т = 25°С, КОм | |||
| Концентрация LiClO4, моль/кг | Исходный образец | После выдержки в LiOH | После выдержки в HCl |
| 0,01 | 285 | 307 | 532 |
| 0,05 | 172 | 184 | 419 |
| 0,5 | 340 | 355 | 592 |
Следует отметить, что указанные материалы являются лишь модельными объектами, значимые величины электропроводности для них можно получить лишь в диапазоне температур 100 – 150 °С. Данная работа имеет целью показать устойчивость подобных объектов в указанных рабочих условиях. Осуществляя правильный подбор соли-ионогена для фторированной матрицы, можно создать материал, сочетающий повышенные значения литий-катионной проводимости и высокую химическую устойчивость в агрессивных для литиевых электролитов средах.
Выводы
- Комбинацией методов рентгенофазового анализа, инфракрасной спектроскопии и импедансспектроскопии на блокирующих электродах исследована устойчивость твёрдополимерных электролитов системы Ф-62 - LiClO4 к водным растворам в диапазоне pH = 1 ÷ 13.
- Определено, что выдерживание в щелочном растворе незначительно изменяет величину сопротивления исследованных материалов, в то время как выдерживание в кислом растворе повышает сопротивление в 2-4 раза, что обусловлено вымыванием перхлората лития с поверхности плёнки и понижением его содержания в материале.
- Несмотря на то, что электропроводность исследованных материалов недостаточно высока - 10-6 при 50 С, полученные данные позволяют предполагать нахождение требуемого электролита с более высокой электропроводностью среди композитов с фторопластом или иных полимеров с введением в их цепь функциональных фторидных группировок. Принципиально показана возможность применения материалов на основе фторопласта-62 для использования в качестве литиевой защиты от водной среды.
Литература
- Girishkumar et al. Lithium-air batteries: promise and challenges // J.phys.chem.lett., 2010, v.1, pp.2193-2203
- Lu et al. Aprotic and aqueous Li – O2 batteries // Chem. Rev., 2014, v.114, pp.5611-5640
- D. McCloskey et al. Twin problems of interfacial carbonate formation in non-aqueous Li – O2 batteries // J.phys.chem.lett, 2012, v.3, pp.997-1001
- Kang et.al. Hierarchical meso-macro structure porous carbon black as electrode materials in Li-air battery // J.pow.sources, 2014, v.261, pp.156-161
- S.Kim, Y.J.Park A simple method for surface modification of carbon by polydopamine coating for enhanced Li-air batteries // El.acta, 2014, v.132, pp.297-306
- C.Agrawal, R.K.Gupta Superionic solids: composite electrolyte phase – an overview // J. of mat.sci.,1999, v.34, p.1131-1162.
- Druzhinin K.V. Composite polymer electrolytes based on lithium salts: solubility and conductivity // Chemical bulletin of KazNU, 2014, №3, pp.3-11.
References
- Girishkumar et al. Lithium-air batteries: promise and challenges // J.phys.chem.lett., 2010, v.1, pp.2193-2203
- Lu et al. Aprotic and aqueous Li – O2 batteries // Chem. Rev., 2014, v.114, pp.5611-5640
- D. McCloskey et al. Twin problems of interfacial carbonate formation in non-aqueous Li – O2 batteries // J.phys.chem.lett, 2012, v.3, pp.997-1001
- Kang et.al. Hierarchical meso-macro structure porous carbon black as electrode materials in Li-air battery // J.pow.sources, 2014, v.261, pp.156-161
- S.Kim, Y.J.Park A simple method for surface modification of carbon by polydopamine coating for enhanced Li-air batteries // El.acta, 2014, v.132, pp.297-306
- C.Agrawal, R.K.Gupta Superionic solids: composite electrolyte phase – an overview // J. of mat.sci.,1999, v.34, p.1131-1162.
- Druzhinin K.V. Composite polymer electrolytes based on lithium salts: solubility and conductivity // Chemical bulletin of KazNU, 2014, №3, pp.3-11.
