УЧАСТИЕ АМИГДАЛО-ГИПОТАЛАМИЧЕСКИХ СВЯЗЕЙ В РЕГУЛЯЦИИ ГИППОКАМПАЛЬНОГО ТЕТА-РИТМА
Багирова Р. М.
Доктор биологических наук, профессор, Азербайджанская Государственная Академия Физической культуры и Спорта
УЧАСТИЕ АМИГДАЛО-ГИПОТАЛАМИЧЕСКИХ СВЯЗЕЙ В РЕГУЛЯЦИИ ГИППОКАМПАЛЬНОГО ТЕТА-РИТМА
Аннотация
В статье показано, что электролитическое повреждение дорсального амигдалофугального пути, в отличие от вентрального, приводит к полной и необратимой блокаде гиппокампального тета-ритма. Восстановление ЭЭГ в гиппокампе отмечалось только при внутригиппокампальном введении карбохолина и стрихнина. Предполагается, что одним из условий регуляции возбудимости нейронов гиппокампа является целостность дорсального амигдалофугального пути.
Ключевые слова: гиппокампальный тета-ритм, дорсальный и вентральный амигдалофугальные пути, электро- и хемостимуляция, разрушение.
Bagirova R.M.
Doctor of Biological Sciences, professor, Azerbaijan State Academy of Physical Culture and Sports
PARTICIPATION OF AMYGDALA-HYPOTHALAMIC RELATIONS IN REGULATION OF HIPPOCAMPAL THETA RHYTHM
Abstract
The article considers electrical destruction of dorsal amygdalofugal pathways leads to complete and persisted blockade of hippocampal theta rhythm in contrast to ventral one. Restoration of hippocampal EEG took place under intrahippocampal application of carbocholine and strychnine. It is proposed that one of the necessary conditions for the regulation of excitability of hippocampal neurons is the integrity of dorsal amygdalofugal pathways .
Key words: hippocampal theta rhythm, dorsal and ventral amygdalofugal pathway, electrical and chemostimulation, destruction.
На протяжении многих лет одной из дискуссионных проблем в электрофизиологии является исследование тета-ритма гиппокампа. Медиальное ядро септума, стоящее на входе в гиппокамп, свидетельствует о важном значении этого образования [1; 2]. Помимо данных, указывающих на пейсмекерную роль септума, имеются работы, в которых показана определенная роль стволово-диэнцефальных структур в механизмах формирования гиппокамального тета-ритма [1, 3, 6, 8, 9, 10] и т.д.
Нашими исследованиями ранее было показано, что разрушение дорсального амигдалофугального пути (ДАП), в отличие от вентрального (ВАП), приводит к полной и необратимой блокаде гиппокампального тета-ритма. Для выяснения причин столь глубоких изменений нами проводилась электро- и хемостимуляция лимбических структур мозга (амигдала, гипоталамус, ретикулярная формация, медиальное ядро септума, гиппокамп) до и после разрушения ДАП.
Методика
Эксперименты проводились на 20 кроликах породы шиншилла массой 2,5-3 кг, в условиях хронического эксперимента. Регистрацию электроэнцефалограммы (ЭЭГ) осуществляли из дорсального (поля СА1 и СА3) и вентрального гиппокампа, зубчатой фасции и медиального ядра септума до и после раздражения (электрического и химического) супраоптического (СОЯ), вентромедиального (ВМЯ) и медиально-мамиллярного (ММЯ) ядер гипоталамуса; базолатерального (АБ) и центрального (АЦ) ядер амигдалы; ретикулярной формации; медиального ядра септума и гиппокампа. Для электрического раздражения исследуемых структур мозга использовалась непрерывная стимуляция прямоугольными импульсами интенсивностью 60-300 мкА, частотой 5-100 Гц в течении 15-30 сек, длительностью 0,5 мсек. Инъекция нейрохимических препаратов производилась в объеме 0,005 мл физиологического раствора. Введение производилось в дозах: карбохолин (КХ) – 0,5-3 мкг; серотонин (5-ОТ) – 10-100 мкг; норадреналин (НА) – 10-50мкг. Временное выключение исследуемых областей центральной нервной системы (ЦНС) производилось 10% раствором новокаина. Для контроля в исследуемую область вводился физиологический раствор в объеме, равном вводимым растворам.
Результаты и их обсуждение
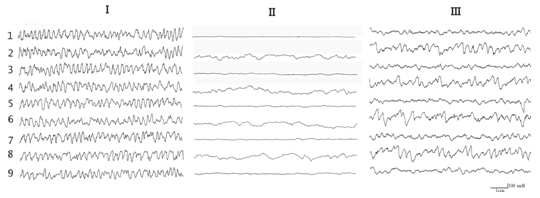
После регистрации фоновой активности производилась электрическая и химическая стимуляция лимбических структур мозга. Нанесение электрического стимула на ядерные образования амигдалы, гипоталамуса, ретикулярную формацию среднего мозга, медиальное ядро септума и гиппокамп, так же как и введение КХ (0,5-2мкг), приводит к возникновению во всех областях гиппокампа и медиальном ядре септума синхронизированных, высокоамплитудных тета-волн с частотой 6-7,5 кол/с (рис. 1-III). Введение малых доз 5-ОТ (10-40 мкг) и НА (10-20 мкг) также вызывает появление регулярной тета-волновой активности, однако колебания потенциалов находятся в пределах частот 5-6 кол/с в случае применения 5-ОТ и 4-5 кол/с при введении НА. Амплитуда ЭЭГ-активности гиппокампа при введении 5-ОТ была выше фоновой, но ниже по сравнению с таковой, зарегистрированной в условиях холинергической стимуляции (рис. 1-IV), а при введении НА была значительно ниже в сравнении с фоновой ЭЭГ (рис. 1-V). Повышение параметров стимуляции (350 мкА, 100 Гц, 0,5 мсек), так же как и увеличение дозы вводимых нейрохимических веществ (КХ–3мкг, 5-ОТ–50-100мкг, НА–30-50мкг), приводит к трансформации синхронизированной активности в эпилептиформную (рис. 1-II). Восстановление электрографических показателей до фонового уровня отмечалось по истечении 3-4 час. после введения КХ, 2,5-3 час. в случае инъекции 5-ОТ и НА.
Рис. 1. Влияние электро- и хемостимуляции поля СА3 дорсального гиппокампа на электрическую активность гиппокампа (I – фон; II – момент электростимулации; III – после введения карбохолина; IV – после введения серотонина; V – после введения норадреналина; VI –введение карбохолина на фоне разрушения ДАП). 1,2 – ЭГ ипси- и контрлатерального гиппокампа, поле СА1; 3,4 – ЭГ ипси- и контрлатерального гиппокампа, поле СА3; 5,6 – ЭГ ипси- и контрлатерального гиппокампа, вентральная часть; 7,8 – ЭГ зубчатой фасции ипси- и контрлатеральной стороны; 9 – ЭГ медиального ядра септума.
В первые минуты после одностороннего электролитического разрушения ДАП на протяжении 2-3 часов регистрируются эпиразряды, которые с течением времени полностью исчезают и сменяются уплощенной, низкоамплитудной активностью, хорошо выраженной на ипсилатеральной стороне (рис.2 II). На 2-5 сутки после произведенной коагуляции подавление активности охватывает как ипси-, так и контрлатеральную стороны. Описанный эффект был необратим: его восстановление не наблюдалось даже через 6 месяцев после произведенного повреждения.
Рис.2. Влияние электролитического разрушения ДАП и ВАП на ЭЭГ гиппокампа. I – фоновая активность; II – после разрушения ДАП; III – после разрушения ВАП. Остальные обозначения те же, что и на рис.1.
В отличие от ДАП, коагуляция ВАП приводит к регистрации в гиппокампе, зубчатой фасции и медиальном ядре септума нерегулярной, полиморфной, низкоамплитудной, деформированной активности, сочетающей в себе как быстрочастотные бета-колебания, так и отдельные тета-волны (рис. 2 III). Однако, в этом случае на 20-25 сутки отмечается полное восстановление электрографических показателей до фонового уровня.
Ни одно из вышеперечисленных воздействий на исследуемые лимбические структуры мозга, ранее приводящих к усилению тета-волновой активности в гиппокампе, не проявляли свойственного им характера после разрушения ДАП. Даже введение КХ на признанный пейсмекер гиппокампального тета-ритма – медиальное ядро септума, не приводило к восстановлению активности. Введение в гиппокамп моноаминов (5-ОТ, НА) на фоне разрушения ДАП не вызывало каких-либо изменений в ЭЭГ гиппокампа. Электрическая стимуляция самого гиппокампа вызывала эпиразряды только при максимальных значениях стимулирующего тока. Несколько иными оказались эффекты введения КХ и СХ. В этой ситуации наблюдалась тенденция к восстановлению суммарной активности гиппокампа и септума. Эффекты КХ и СХ были аналогичны и продолжались в течение 1,5-2 час. (рис. 1-VI).
Таким образом, анализ полученных нами данных позволяет заключить, что действия различных нейрохимических веществ на ЭЭГ активность гиппокампа обладают рядом общих и отличающихся свойств. К числу первых следует отнести: 1) возникновение синхронизированной тета-волновой активности; 2) отсутствие в различных областях гиппокампа дифференцированности биоэлектрических реакций; 3) нарушение регулярности тета-волновой активности и возникновение эпиразрядов при увеличении дозы вводимых в исследуемые структуры мозга моноаминов. К свойствам, отличающим действия примененных нейрохимических агентов, следует отнести: 1) возникновение доминирующей частоты 6-7,5 кол/с при холинергической, 5-6 кол/с – при серотонинергической и 4-5 кол/с при норадренергической стимуляции ядер амигдалы, гипоталамуса, ретикулярной формации среднего мозга, медиального ядра септума и гиппокампа; 2) изменение амплитуды синхронизированных колебаний потенциала по сравнению с фоновой ЭЭГ активностью, которая достигала своего максимума на фоне действия холиномиметика, среднего уровня – при введении 5-ОТ и была ниже фонового уровня после введения НА.
Учитывая имеющиеся в литературе данные о значении изученных образований мозга в регуляции функции системы гипофиз–кора надпочечников, можно полагать, что изменения возбудимости нейронов гиппокампа, вызванные различными электрическими и нейрохимическими воздействиями на исследуемые структуры лимбической системы, обусловлены, по-видимому, содержанием различных концентраций эндогенных кортикостероидов в крови и нацелены на компенсацию вызванных в организме сдвигов. В регуляции гипофизарно-адрено- кортикальной системы могут принимать участие самые различные передатчики нервных импульсов (ацетилхолин, НА, 5-ОТ, дофамин, ГАМК, простангландины и т.д.) [5]. По существующим в литературе данным, под влиянием больших количеств кортикостероидов в крови, в гиппокампе возникает ритмическая активность с частотой 4-6 кол/с, а при локальной аппликации кортизона или гидрокортизона в гиппокамп значительно возрастает уровень возбудимости пирамидных клеток гиппокампа и в них формируется судорожная активность [4; 7], что, по мнению авторов, служит доказательством непосредственного действия кортикостероидов на дендриты пирамид гиппокампа. В наших экспериментах в гиппокампальной ЭЭГ также регистрируется синхронизированная активность частотой 4-6 кол/с. Однако под воздействием различных нейрохимических веществ в гиппокампе регистрируются соответствующие частоты: волны в диапазоне 4-5 кол/с возникают при активации норадренергической системы; 5-6 кол/с – серотонинергической системы; 6-7,5 кол/с – холинергической системы мозга.
Учитывая имеющиеся в литературе данные о характере и механизме действия центральных нейротропных средств на адренокортикотропную функцию гипофиза, сопоставление с результатами наших исследований позволяет сделать заключение о возможном участии той или иной медиаторной биохимической системы в регуляции различных частот гиппокампального тета-ритма, что отражает различный уровень активации ГГНС. Полученные результаты свидетельствуют о том, что регуляция гиппокампального тета-ритма, так же как и функциональная активность ГГНС, носит полимедиаторный характер и не детерминирована строго каким-либо одним моноаминергическим механизмом мозга, обеспечивая надежность гипофизарно-адреналового ответа на различные воздействия, поскольку ответ этот весьма важен для поддержания гомеостаза. Именно в этом, очевидно, и заключаются огромные компенсаторные возможности ЦНС. Полная и необратимая блокада ЭЭГ гиппокампа, вызванная разрушением ДАП, очевидно, свидетельствует о том, что в данных условиях ГГНС работает на более низком уровне – с нарушением образования АКТГ и скорости секреции кортикостероидов. Результаты проведенных исследований свидетельствуют о модулирующем влиянии лимбических образований мозга на гиппокампальный тета-ритм и, очевидно, на ГГНС, а также об активирующей роли миндалины на деятельность гипоталамических нейронов. Все вышеизложенное свидетельствует о том, что необходимым условием регуляции возбудимости нейронов гиппокампа является целостность амигдало-гипоталамических связей, посредством которых осуществляется регуляторное влияние миндалины на деятельность гипоталамических нейросекреторных клеток.
Литература
- Кичигина В.Ф., Кудина Т.А. Сенсорные реакции нейронов гиппокампа кролика при функциональном выключении структур, управляющих тета-ритмом // Журн. Высш. Нервн. деят. – 2001. – Т. 51 (№ 2). – С. 228-235.
- Кичигина В.Ф. Фоновая активность нейронов гиппокампа кролика при функциональном выключении структур, регулирующих тета-ритм / В.Ф. Кичигина, Т.А. Кудина, К.Н. Зенченко и др. // Журн. Высш. Нервн. деят. – 1998. – Т. 48 (№ 3). – С. 505-515.
- Кичигина В.Ф., Кутырева Е.В. Модуляция тета-активности в септо-гиппо-кампальной системе агонистом альфа 2-адренорецепторов клонидином // Журн. Высш. Нервн. деят. – 2002. – Т. 52 (№ 2). – С. 195-204.
- Лишшак К., Эндреци Э. Нейроэндокринная регуляция адаптационной деятельности. – Будапешт: АН ВНР, 1967. – 145 с.
- Сапронов Н.С. Фармакология гипорфизарно-надпочечниковой системы. – СПб.: Специальная лит., 1998. – 336 с.
- Berridge C.W., Espana R.A. Synergistic sedative eff ects of nonadrenergic α1– and β–receptor blockade in forebrain electroencephalographic and behavior indices // J. Neuroscience. – 2000. – V. 99 (№ 3). – P. 495-505.
- Endroczi E. Role of glucococrticoids in controlling pituitary-adrenal function //Acta med. Acad. Scient. Hung. – 1972. – V. 29 (№1-2). – P. 49-59.
- Smythe J.W. Hippocompal theta field activity and theta-on/theta-off all discharges are controlled by an ascending hypothalamo-septal pathway / J.W. Smythe, B.R. Christie, L.V. Colom et al. // J. Neuroscience. – 1991. – V. 11. – P.2241-2248.
- Steriade M. Arousal: revisiting the reticular activating system // Sciense. – 1996. – V. 272. – P. 225-226.
- Vertes R.P PHA-L analysis of projections from in the supramammillary nucleus in the rat // J. Comp. Neurology. – 1992. – V. 326. – P. 595-620.
References
- Kichigina V.F., Kudina T.A. Sensornye reakcii nejronov gippokampa krolika prifunkcional'nom vykljuchenii struktur, upravljajushhih teta-ritmom // Zhurn.vysshej nervnoj dejatel'nosti. – 2001. – T. 51 (№ 2). – S. 228-235.
- Kichigina V.F. Fonovaja aktivnost' nejronov gippokampa krolika prifunkcionalnom vykljuchenii struktur, regulirujushhih teta-ritm / V.F. Kichigina, T.A. Kudina, K.N. Zenchenko i dr. // Zhurn. vysshej nervnoj dejatelnosti. – 1998. – T. 48 (№ 3). – S. 505-515.
- Kichigina V.F., Kutyreva E.V. Moduljacija teta-aktivnosti v septo-hippokampal sistem agonistom al'fa 2-adrenoreceptorov klonidinom // Zhurn. vysshej nervnoj dejatel'nosti. – 2002. – T. 52 (№ 2). – S. 195-204.
- Lishshak K., Jendreci Je. Nejroendokrinnaja reguljacija adaptacionnoj dejatelnosti. – Budapesht: AN VNR, 1967. – 145 s.
- Sapronov N.S. Farmakologija giporfizarno-nadpochechnikovoj sistemy. – SPb.: Special'naja lit., 1998. – 336 s.
- Berridge C.W., Espana R.A. Synergistic sedative eff ects of nonadrenergic α1– and β–receptor blockade in forebrain electroencephalographic and behavior indices // J. Neuroscience. – 2000. – V. 99 (№ 3). – P. 495-505.
- Endroczi E. Role of glucococrticoids in controlling pituitary-adrenal function //Acta med. Acad. Scient. Hung. – 1972. – V. 29 (№1-2). – P. 49-59.
- Smythe J.W. Hippocompal theta field activity and theta-on/theta-off all discharges are controlled by an ascending hypothalamo-septal pathway / J.W. Smythe, B.R. Christie, L.V. Colom et al. // J. Neuroscience. – 1991. – V. 11. – P.2241-2248.
- Steriade M. Arousal: revisiting the reticular activating system // Sciense. – 1996. – V. 272. – P. 225-226.
- Vertes R.P PHA-L analysis of projections from in the supramammillary nucleus in the rat // J. Comp. Neurology. – 1992. – V. 326. – P. 595-620.