ОПТИМИЗАЦИЯ ПИТАТЕЛЬНОЙ СРЕДЫ ДЛЯ STREPTOMYCES HYGROSCOPICUS – ПРОДУЦЕНТА ФАРМАЦЕВТИЧЕСКОЙ СУБСТАНЦИИ РАПАМИЦИНА
Савельева В.В.1, Джавахия В.В.2, Глаголева Е.В.3, Глаголев В.И.4, Савушкин В.А.5
1аспирант, младший научный сотрудник, 2кандидат биологических наук, заведующий лабораторией, 3инженер, 4инженер, 5инженер, Федеральное государственное учреждение Федеральный исследовательский центр «Фундаментальные основы биотехнологии» Российской академии наук
ОПТИМИЗАЦИЯ ПИТАТЕЛЬНОЙ СРЕДЫ ДЛЯ STREPTOMYCES HYGROSCOPICUS – ПРОДУЦЕНТА ФАРМАЦЕВТИЧЕСКОЙ СУБСТАНЦИИ РАПАМИЦИНА
Аннотация
Рапамицин является продуктом метаболизма актиномицета S. hygroscopicus и представляет собой азотсодержащий макролид. В настоящее время рапамицин и его производные имеют широкое клиническое применение в качестве противоопухолевых и иммуносупрессивных агентов.
В данном исследовании проводилась оптимизация питательной среды для штамма S. hygroscopicus R 33-41 при помощи метода математического планирования эксперимента. Оптимизация ферментационной среды совмещала в себе планирование полного факторного эксперимента (ПФЭ 23) с методами крутого восхождения и движения по градиенту концентрации. Параметр оптимизации – количество целевого вещества (рапамицина) по окончанию культивирования. Применение данного метода позволило повысить выход рапамицина на 24,7%.
Ключевые слова: Streptomyces hygroscopicus, рапамицин, питательная среда, оптимизация.Saveleva V.V.1, DzhavakhiyaV.V.2, Glagoleva E.V.3, Glagolev V.I.4, Savushkin V.A.5
1Postgraduate student, Junior Researcher, 2PhD in Biology, 3Engineer, 4Engineer, 5Engineer, Federal Research Centre «Fundamentals of Biotechnology», Russian Academy of Sciences
NUTRIENT MEDIUM OPTIMIZATION FOR STREPTOMYCES HYGROSCOPICUS, A PRODUCER OF RAPAMYCIN PHARMACEUTICAL SUBSTANCE
Abstract
Rapamycin is a nitrogen-containing macrolide produced by Streptomyces hygroscopicus. Today rapamycin and its derivatives are widely used as anti-tumor and immunosuppressive agents. In this study the nutrient medium for S. hygroscopicus R 33-41 strain was optimized using design-of-experiments methodology. The performed medium optimization combined the planning of a full factorial design (FFD 23) with the steepest ascent method and movement along concentration gradient. The amount of a target substance (rapamycin) to the end of fermentation was chosen as the optimization parameter. The application of this method provided a 24.7% increase in the rapamycin output.
Keywords: Streptomyces hygroscopicus, rapamycin, nutrient medium, optimization.Введение
Со времен открытия стрептомицина в 1943 году [1, C.103-105], было показано, что стрептомицеты (лат. Streptomyces) образуют тысячи соединений (антибиотики, иммуносуппрессанты, противоопухолевые вещества и др.), обладающих большим потенциалом использования в различных отраслях жизнедеятельности человека. Метаболиты, образующиеся в процессе жизнедеятельности актиномицетов, составляют около 2/3 от всех известных антибиотических веществ [2]. Одним из наиболее важных веществ, синтезируемых стрептомицетами, является рапамицин – ингибитор mTOR (от англ. mammalian target of rapamycin), и после циклоспорина, наиболее широко используемый иммуносуппресант микробиологического происхождения [3, C.102-108].
Несмотря на значимость использования и широкий спектр возможностей применения рапамицина в медицине, его получение ограничивается низкой продуцирующей способностью природных штаммов (например, S. hygroscopicus AY-BI1206 [4, C. 436-439], S. hygroscopicus NRRL 5491 [5, C. 727-732]), что увеличивает себестоимость субстанции и снижает возможные объемы его промышленного производства.
Оптимизация питательной среды является главным фактором в повышении выхода продукта, поскольку образование антибиотических веществ регулируется в основном условиями культивирования микроорганизмов [6, C. 56-102]. Традиционно состав питательной среды, оптимальной для выращивания продуцентов, определялся методом длительного эмпирического подбора, в ходе которого устанавливается качественный и количественный состав среды [7, C. 19-23], [8], [9]. В настоящее время при оптимизации питательных сред для микроорганизмов все шире используют математический метод планирования экспериментов, что позволяет обоснованно подходить к конструированию питательных сред, делать их более экономичными [10, C. 111-130]. Планирование эксперимента позволяет варьировать одновременно все факторы и получать количественные оценки, как основных факторов, так и эффектов взаимодействия между ними, причем получаемые результаты характеризуются меньшей ошибкой, чем традиционные методы однофакторного исследования [11], [12, C. 332-344],[13, C. 424-429].
В связи с этим, задачей данного исследования был подбор оптимального состава питательной среды для штамма S. hygroscopicus R 33-41 на основе полного факторного эксперимента с применением методов крутого восхождения и движения по градиенту концентраций для увеличения выхода рапамицина.
Материалы и методы
Штамм-продуцент
В работе использовали штамм Streptomyces hygroscopicus R 33-41, полученный ранее [14, C.122-124], [15, C. 18-19] при помощи мутагенного воздействия на типовой штамм Streptomyces hygroscopicus АТСС 29253. Продуктивность штамма R 33-41 составляла 937 мг/л рапамицина в культуральной жидкости.
Культивирование S. hygroscopicus
Для выращивания, поддержания, хранения культуры S. hygroscopicus использовали плотную агаризованную среду R1 следующего состава (г/л): агар-агар – 20.0, соевая мука – 1.0, растворимый крахмал – 10.0, сульфат магния – 1.0, калий фосфорнокислый двузамещенный – 0.5, дистиллированная вода - до 1 л. Значение активной кислотности среды (pH) до стерилизации составляло 6.8±0.1. Штаммы культивировали при температуре 29 0С в течение 10-12 суток. Для поддержания культуры проводили периодические пересевы на свежую агаризованную среду. Для длительного хранения культуру лиофилизировали и хранили в запаянных ампулах в холодильнике.
Глубинное культивирование осуществляли в колбах Эрленмейера объемом 50 мл, содержащих 10 мл питательной среды. Культуру выращивали в колбах на качалочной установке “Innova 44” при 250 об/мин (эксцентриситет 5 см) и температуре 290С в течение 9 суток. В качестве питательной среды использовали ранее модифицированную [14] среду F2 следующего состава (г/л): соевая мука (полножировая) – 30.0, лизин – 15.0, дрожжевой экстракт – 5.0, соевой пептон – 5.0, глюкоза – 100.0, хлорид натрия – 5.0, сульфат магния – 1.0, сульфат аммония – 1.0, натрий фосфорнокислый 2-замещенный – 5.0, вода дистиллированная до 1 л (рН 6.8-6.9). Глюкозу вносили в среду после стерилизации, в виде 50% раствора.
Метод высокоэффективной жидкостной хроматографии (ВЭЖХ)
Количественное определение рапамицина в культуральной жидкости проводили методом ВЭЖХ на жидкостном хроматографе Agilent 1200 Series (Agilent, США) с использованием колонки Agilent Zorbax SB-C18 250мм×4,6мм (сорбент – октадецилсиликагель, 5мкм; мобильная фаза – 75 объемов ацетонитрила и 25 объемов воды; температура колонки - 60ºC; скорость потока 1 мл/мин). В качестве контроля для сравнения использовали стандартный образец рапамицина (R0395 SIGMA, чистота более 95%), предварительно растворенный в метаноле. Объем пробы составлял 10 мкл. Спектрофотометрическую детекцию проводили при λ=278 нм. Время удерживания пика рапамицина составляет 9 минут.
Результаты
Осуществлен полный факторный эксперимент (ПФЭ 23) с использованием метода крутого восхождения, позволяющий реализовать все возможные комбинации основных уровней независимых переменных факторов, установить оптимальные концентрации компонентов питательной среды с учетом их совместного влияния на выход рапамицина, найти и обосновать оптимальный состав среды. Параметром оптимизации являлась концентрация рапамицина (Y) в культуральной жидкости по окончанию культивирования
Ранее [14, C. 122-124] был проведен ряд отсеивающих экспериментов, основанный на использовании однофакторного метода, по подбору регуляторных компонентов питательной среды, оказывающих максимальное влияние на синтез рапамицина. Основываясь на данные из литературных источников [16, C. 949-969], [17, C. 829-840], [18, C.523-531] и ряд проведенных однофакторных экспериментов была установлена группа сильнодействующих факторов и их активные уровни. На основании этого, в данной работе в качестве факторов варьирования Х1, Х2 и Х3 взяты соевая мука, лизин и глюкоза соответственно, как наиболее значимые компоненты. Кроме того, был использован дополнительный нулевой фактор Х0 (Х0=1). Интервалы варьирования факторов составили 5; 5 и 10 г/л соответственно (Таблица 1). Содержание остальных компонентов в питательной среде оставалось неизменным на определенном ранее уровне.
Таблица 1 - Значение факторов в натуральных переменных, шаг варьирования и концентрации основных компонентов питательной среды
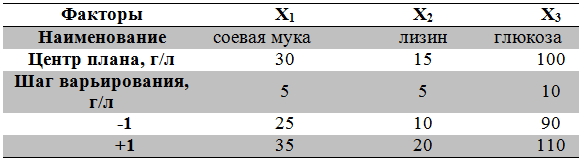
Таблица 2 - Матрица планирования эксперимента для ПФЭ типа 23
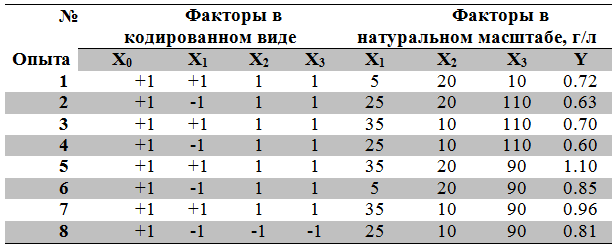
Коэффициенты уравнения регрессии, а также коэффициенты двойного и тройного взаимодействия факторов определялись по методу наименьших квадратов в соответствии с данными, полученными при глубинном культивировании штамма S. hygroscopicus R 33-41 в трех повторностях на всех вариантах питательных сред. Этот метод является одним из наиболее распространенных приемов статистической обработки экспериментальных данных, относящихся к различным функциональным зависимостям физических величин друг от друга [19, C. 23-35]. Любой коэффициент уравнения регрессии определяется скалярным произведением столбца Y на соответствующий столбец, отнесенным к числу опытов в матрице планирования N:
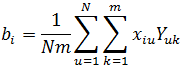
где bi – коэффициент регрессии; xiu – значение переменной в соответствующем столбце; m – количество повторностей; u = 1, 2…N, k = 1, 2…m; i – номер фактора.
Полученные линейные коэффициенты и коэффициенты парного взаимодействия соответственно равны: b0=0.80, b1= 0.08, b2= 0.03, b3=-0.13, b12=0.01, b13=-0.03, b23=-0.02, b123= -0.01.
Коэффициенты, вычисленные по результатам эксперимента, указывают на силу влияния факторов. Чем больше численное значение коэффициента, тем больше фактор влияет на параметр оптимизации [20, C. 80-92].
Значимость коэффициентов регрессии проверяли по критерию Стьюдента, согласно общепринятой методике [19, C. 30],[21, C.25-30].
Полученное уравнение регрессии имело следующий вид:
У = 0,8+0,08X1 + 0,03X2–0,13Х3+0.01X1X2-0.03X1X3-0.02X2X3-0.01X1X2X3
Проверка адекватности уравнения с использованием F-критерия Фишера [22, C.20-28] показала, что уравнение адекватно описывает процесс.
Построение кривых поверхности отклика показало, что каждый из выбранных нами факторов в той или иной степени влияет на биосинтез рапамицина и, следовательно, является значимым. Кривые поверхности отклика представлены на рисунке 1
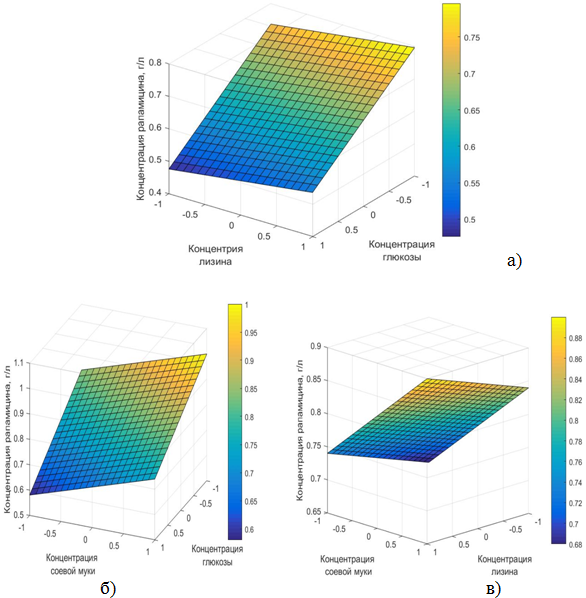
Рис.1 - Кривые поверхности отклика, показывающие влияние каждого фактора на биосинтез рапамицина (а)Х1=1; б)Х2=1; в)Х3=1)
На основании результатов проведенного ПФЭ можно предположить, что для дальнейшей оптимизации среды применение метода крутого восхождения будет эффективным, так как полученная линейная модель адекватна и не является резко асимметричной относительно коэффициентов. Для определения оптимального состава питательной среды использовали стандартную методику крутого восхождения Бокса-Уилсона [23]. Полученные данные представлены в таблице.
Таблица 3 - Расчет коэффициентов регрессии и шага варьирования для определения оптимального состава питательной среды по методу крутого восхождения
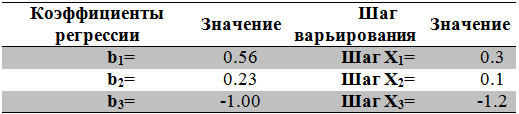
Таблица 4 - Матрица планирования эксперимента по методу крутого восхождения
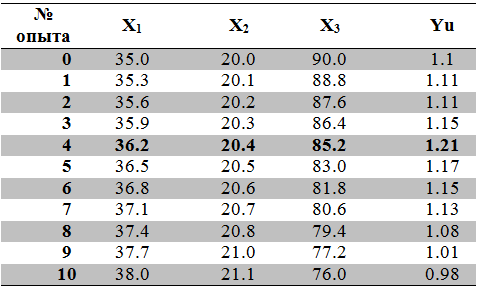
В результате осуществления экспериментов методом крутого восхождения в опыте № 4 был достигнут максимальный выход целевого вещества (1,21 г/л), дальнейшее проведение экспериментов методом движения по градиенту концентрации имело негативное влияние на биосинтез рапамицина.
Выводы
На основании проведенных исследований можно заключить, что оптимизация ферментационной среды для штамма S. hygroscopicus R 33-41, совмещающая планирование полного факторного эксперимента (ПФЭ 23) с методом крутого восхождения и методом движения по градиенту концентрации, в данном случае является эффективной, поскольку конечный выход рапамицина был увеличен относительно исходного значения на 24,7%. В результате эксперимента по методу крутого восхождения разработана ферментационная среда следующего состава (г/л): соевая мука (полножировая) – 36.2, лизин – 20.4, дрожжевой экстракт – 5.0, соевый пептон – 5.0, глюкоза – 85.2, хлорид натрия – 5.0, сульфат магния – 1.0, сульфат аммония – 1.0, натрий фосфорнокислый 2-замещенный – 5.0.
Список литературы / References
- Jones D. Control of Gramnegative bacteria in experimental animals by streptomycin /Jones D., Metzger H.J., Schatz A., Waksman S.A.// Science. - 1944. – Vol. 100. – P.103-105.
- Hopwood D.A. Streptomyces in nature and medicine: the antibiotic makers. Oxford University Press. – NY. – 2007.
- Trevillian P. Immunosuppressants: clinical applications. Aust Prescr. – Vol. 29. – P.102–108.
- Kojima I. Carbon source nutrition of rapamycin biosynthesis in Streptomyces hygroscopicus. /Kojima I., Cheng Y.R., Mohan V. and Demain A.L. //Journal of Industrial Microbiology. - 2006. – Vol.14. – P.436-439.
- Sehgal S.N. Rapamycin (AY-22, 989), a new antifungial antibiotic II. Fermentation, isolation and characterization. / Sehgal S.N., Baker H., Vezina C.// Journal of Antibiotics. - 1975. – Vol. 28. – P.727-732.
- Егорова Т.А. Основы биотехнологии: учеб. Пособие / Егорова Т.А., Клунова С.М., Живухина Е.М. // М: Академия. - 2006. – 207c.
- Осипов Д.С. Математическая модель биосинтеза L-лейцина./ Осипов Д.С., Гусельникова Т.В. //М: МГУИЭ - 2001. - Т№5. – C.19–23.
- Монтгомери Д. К. Планирование эксперимента и анализ данных./ Монтгомери Д. К., Л.: Судостроение. -1980. – 384c.
- Перт С.Д. Основы культивирования микроорганизмов и клеток. / Перт С.Д., М.: Мир. - 1978. – 331c.
- Арзамасцев А.А. Математические модели кинетики микробного синтеза: возможности использования и новые подходы к разработке /Арзамасцев А.А., Андреев А.А.// Вестник Тамбовского университета. - 2000. – №5 (1). - С.111–130.
- Бирюков В.В. Оптимизация периодических процессов микробиологического синтеза / Бирюков В.В. Кантере В.М. // М: Наука. - 1985. – 296c.
- Bajpai R.K. Mechanistic model for penicillin production. / Bajpai R.K., Reuss M. A J.// Chem. Technol. and Biotechnol. - 1980. – Vol. 30. – P.332–344.
- Ettler P. Determination of the optimal feeding regime during biosynthesis of erythromycin/ Ettler P. Votruba J. // Folia Microbiol. - 1980. Vol-25. – P.424-429.
- Савельева В.В. Разработка высокоактивного штамма Streptomyces hygroscopicus – продуцента фармацевтической субстанции рапамицина. / Воинова Т.М., Глаголева Е.В., Джавахия В.В.// Сборник тезисов XI Молодежной школы-конференции с международным участием «Актуальные аспекты современной микробиологии». - 2016. – С.122-124.
- Савельева В.В. Создание высокоактивного штамма S. hygroscopicus - продуцента фармацевтической субстанции рапамицина, методом индуцированного ненаправленного мутагенеза. Russian Agricultural Science Review. - 2015. -№6 (6-2). – С.18-19.
- Wang B.Comparative metabolic profiling reveals the key role of amino acids metabolism in the Rapamycin overproduction by Streptomyces hygroscopicus /Wang B., Liu J., Liu H., Huang D. and others// Systems Biotechnology. – 2015. - Vol. 24. – P.949-963.
- Sinha R. Studies on process optimization methods for rapamycin production using Streptomyces hygroscopicus ATCC 29253 /Sinha R., Singh S., Srivastava P.// Bioprocess Biosyst Eng. - 2014. - Vol.37. – P.829-840.
- Dutta S. Kinetics of rapamycin production by Streptomyces hygroscopicus MTCC 4003 / Dutta S., Basak B., Bhunia B., Chakraborty S. and others// Biotechnology. - 2014. – Vol.4. - 523-531.
- Яворский В.А. Планирование научного эксперимента и обработка экспериментальных данных. /Яворский В.А.. М: Издательство МФТИ. - 2006.
- Адлер Ю.П. Планирование экспериментов при поиске оптимальных условий. / Адлер Ю.П. М: Наука. - 1976. – С.80-92.
- Хамханов К.М. Основы планирования эксперимента. / Хамханов К.М. Методическое пособие. Издательство: ВСГУТУ. - 2001. – 94с.
- Жерносекова И.В. Методы планирования экспериментов при оптимизации питательной среды для стрептомицета. /Жерносекова И.В., Черногор Н.П., Тымчук А.А. Вестник Днепропетровского университета. - 2006. – №18 (1). – С.20-28.
- Бочкарев В.В., Троян А.А. Оптимизация химико-технологических процессов. Практикум. Издательство ТПУ. - 2016. -160с.
Список литературы на английском языке / References in English
- Jones D. Control of Gramnegative bacteria in experimental animals by streptomycin /Jones D., Metzger H.J., Schatz A., Waksman S.A.// Science. - 1944. – Vol. 100. – P.103-105.
- Hopwood D.A. Streptomyces in nature and medicine: the antibiotic makers. Oxford University Press. – NY. – 2007.
- Trevillian P. Immunosuppressants: clinical applications. Aust Prescr. – Vol. 29. – P.102–108.
- Kojima I. Carbon source nutrition of rapamycin biosynthesis in Streptomyces hygroscopicus. /Kojima I., Cheng Y.R., Mohan V. and Demain A.L. //Journal of Industrial Microbiology. - 2006. – Vol.14. – P.436-439.
- Sehgal S.N. Rapamycin (AY-22, 989), a new antifungial antibiotic II. Fermentation, isolation and characterization. / Sehgal S.N., Baker H., Vezina C.// Journal of Antibiotics. - 1975. – Vol. 28. – P.727-732.
- Egorova T.A. Osnovy biotehnologii: ucheb. Posobie [Fundamentals of Biotechnology: A Training Manual]. /Egorova T.A., Klunova S.M., Zhivuhina E.M. // M: Acadimija. - 2006. – 207p. [in Russian]
- Osipov D.S. Matematicheskaja model’ biosinteza L-leicina [Mathematical model of L-leucine biosynthesis]. / Osipov D.S., Gusel’nikova T.V.// M: MGUIE. - 2001. - № – P.19-23. [in Russian]
- Montgomerj D.K. Planirovanie eksperimenta i analiz dannych [Experimental Design and Analysis]. / Montgomerj D.K. //L: Sudostroenie. - 1980. - 384. [in Russian]
- Pert S.D. Osnovy cul’tivirovanija mikroorganizmov i kletok [Basics of microorganisms and cells cultivation]. / Pert S.D. //M: Mir. - 1938. – 331p. [in Russian]
- Arzamascev A.A. Matematicheskie modelj mikrobnogo sinteza: vozmozhnostj ispol’zovanija i novye podhody k razrabotke [Mathematical models of the kinetics of microbial synthesis: the possibility of using new approaches to development]. / Arzamascev A.A., Andreev A.A. // Vestnik Tambovskogo universiteta [Bulletin Tambovksogo University]. - 2000. -№18 (1). – P.111-130. [in Russian]
- Birjukov V.V. Optimizacija periodicheskich processov mikrobiologicheskogo sinteza [Optimization of batch processes of microbiological synthesis]. /Birjukov V.V., Kantere V.M. // M: Nauka. - 1985. – 296p. [in Russian]
- Bajpai R.K. Mechanistic model for penicillin production. / Bajpai R.K., Reuss M. A J.// Chem. Technol. and Biotechnol. - 1980. – Vol. 30. – P.332–344.
- Ettler P. Determination of the optimal feeding regime during biosynthesis of erythromycin/ Ettler P. Votruba J. // Folia Microbiol. - 1980. Vol. - 25. – P.424-429.
- Savel’eva V.V. Razrabotka vysokoaktivnogo shtamma Streptomyces hygroscopicus – producenta pharmacevticheskoi substancij rapamicina [The development of a highly active strain of Streptomyces hygroscopicus - producing pharmaceutical substance rapamycin]. /Savel’eva V.V., Voinova T.M., Glagoleva E.V., Dzhavahiya V.V// Sbornik tezisov Molodjozhnoi shkoly – konpherencij s mezhdunarodnym uchastiem “Actual’nye aspect sovremennoi mikrobiologij” [Abstracts of XI Youth school conference with international participation "Actual aspects of modern microbiology”]. - 2016. –P.122-124. [in Russian]
- Savel’eva V.V. Sozdanie vysokoaktivnogo shtamma hygroscopicus - producenta pharmacevticheskoi substancij rapamicina metodom inducirovannogo nenapravlennogo mutageneza [Creating a highly active strain of S. hygroscopicus - producing pharmaceutical substance rapamycin, induced by non-directed mutagenesis]. Russian Agricultural Science Review. - 2015. - №6 (6-2). – P.18-19. [in Russian]
- Wang B.Comparative metabolic profiling reveals the key role of amino acids metabolism in the Rapamycin overproduction by Streptomyces hygroscopicus /Wang B., Liu J., Liu H., Huang D. and others// Systems Biotechnology. – 2015. - Vol. 24. – P.949-963.
- Sinha R. Studies on process optimization methods for rapamycin production using Streptomyces hygroscopicus ATCC 29253 /Sinha R., Singh S., Srivastava P.// Bioprocess Biosyst Eng. - 2014. - Vol.37. – P.829-840.
- Dutta S. Kinetics of rapamycin production by Streptomyces hygroscopicus MTCC 4003 / Dutta S., Basak B., Bhunia B., Chakraborty S. and others// Biotechnology. - 2014. – Vol.4. - 523-531.
- Javorskij V.A. Planirovanie nauchnogo eksperimenta i obrabotka eksperimental’nych dannych [Planning for scientific experiments and experimental data processing]. / Javorskij V.A //M: Izdatel’stvo MFTI. - 2006.
- Adler Ju.P. Planirovanie eksperimenta prj poiske optimal’nych uslovij [Planning experiments in finding the optimal conditions]. / Adler Ju.P.// M: Nauka. - 1976. – P. 80-92. [in Russian]
- Hamhanov K.M. Osnovy planirovanija eksperimenta. Metodicheskoe posobie [Basics of experimental design. Toolkit]. /Hamhanov K.M.// Izdatel’stvo: VSGUTU. - 2001. – 94p. [in Russian]
- Zhernosekova I.V. Metody planirovanija eksperimentov pri optimizacij pitatel’noi sredy dlja streptomiceta. [Methods of experimental design in the optimization of the culture medium for Streptomyces] /Zhernosekova I.V., Chernogor N.P., Tymchuk A.A. and others// Vestnik Dnepropetrovskogo universiteta [Bulletin of Dnepropetrovsk University]. - 2006. – №18 (1). - P.20-28. [in Russian]
- Bochkarev V.V. Optimizacija chimiko-tehnologicheskih processov. [Optimization of chemical-engineering processes] /Bochkarev V.V., Trojan A.A//. Practikum. Izdatel’stvo TPU [Workshop publishing TPU]. - 2016. – 160p. [in Russian]
