A STUDY OF CHRONIC HEPATOTOXICITY OF NEW DERIVATIVES OF CONDENSED 3-AMINOTHIENO[2,3-B]PYRIDINES AND 1,4-DIHYDROPYRIDINES WITH ANALGESIC ACTIVITY
A STUDY OF CHRONIC HEPATOTOXICITY OF NEW DERIVATIVES OF CONDENSED 3-AMINOTHIENO[2,3-B]PYRIDINES AND 1,4-DIHYDROPYRIDINES WITH ANALGESIC ACTIVITY
Abstract
The aim of the present work was to evaluate morphological changes in rat liver after two-week administration of the most frequently used in the clinic NSAIDs and new derivatives of condensed 3-aminothieno[2,3-b]pyridines and 1,4-dihydropyridines with distinct analgesic activity. The experiment was carried out on 60 white rats (males), with an average weight of 250-280 g. The rats were divided into control, reference and 4 experimental groups. Animals of the reference group received indomethacin at a dose of 7 mg/kg once daily for 14 days. The remaining 4 groups included animals, which were administered through a gastric tube in the form of aqueous suspension original newly synthesized derivatives of condensed 3-aminothieno[2,3-b]pyridines and 1,4-dihydropyridines at a dose of 5 mg/kg with the most pronounced analgesic activity according to the results of previously conducted in vivo experiments with the codes AZ023, AZ331, AZ420 and AZ383. At detailed study of light-microscopic sections of the liver parenchyma of rats receiving the studied original derivatives of condensed 3-aminothieno[2,3-b]pyridines and 1,4-dihydropyridines with expressed analgesic properties we did not register any gross disturbances of morphological picture. Separate structural changes were reduced to insignificant dilation of blood vessels. According to the results of morphological studies of chronic hepatotoxicity of four new derivatives of condensed 3-aminothieno[2,3-b]pyridines and 1,4-dihydropyridines with pronounced analgesic properties, the absence of their adverse effect on the structure of hepatic parenchyma was established.
1. Введение
В настоящее время вопросы, касающиеся морфологических преобразований в органах пищеварительного тракта после воздействия лекарственными средствами, приобретают особую актуальность. Причины этого кроются в растущих объемах полипрагмазии, а также в увеличении распространенности заболеваний печени, желчевыводящих путей, желудка и кишечника , , , . После 2000 года количество лекарственных поражений печени значительно увеличилось. Печень особенно уязвима при пероральном пути приема лекарственных средств, которые характеризуются выраженным эффектом «первого пассажа» .
Данные статистики свидетельствуют о высокой распространенности лекарственно-индуцированных поражений печени, общая смертность от которых по сведениям из различных источников в мире находится в пределах от 5 до 12% , , , . Наиболее тяжелые токсические поражения печени возникают вследствие длительного приема высших терапевтических доз парацетамола, тетрациклина, фторотана, натрия вальпроата, амиодарона, изониазида, ниаламида, фурадонина и др. Около 10% всех побочных реакций, связанных с применением медикаментозных средств, составляют лекарственные поражения печени. Широкая распространенность комбинированной фармакотерапии при многокомпонентной терапии коморбидных состяний не могут не откладывать свой отпечаток на структурно-функциональное состояние печени, как важнейшего органа биотрансформации лекарственных средств. При этом летальность при тяжелой форме лекарственной печеночной недостаточности на сегодняшний день составляет 75% , .
В современном мире НПВС являются одной из самых назначаемых группой лекарственных средств с целью симптоматической и патогенетической терапии заболеваний различных систем и органов. Причиной этому является, в том числе и их безрецептурный отпуск. Занимая второе место в мире по объему продаж после химиотерапевтических средств, НПВС характеризуются тем, что занимают лидирующие позиции по числу и тяжести неблагоприятных действий . Безрецептурный отпуск и, соответственно, неконтролируемый приём НПВС является причиной развития многочисленных осложнений, наиболее опасными среди которых являются эрозивно-язвенные поражения пищеварительного тракта и НПВС-индуцированная гепатотоксичность. Опасность данных поражений заключается в их первоначальной клинической бессимптомности, обусловленной, по-видимому, анальгетическим действием НПВС. Необходимость длительного, часто пожизненного приема НПВС, несмотря на развитие у части больных таких серьезных осложнений определяет актуальность избранной темы .
Поэтому на сегодняшний день остро стоит вопрос поиска, разработки, исследования и введения в клиническую практику новых эффективных, безопасных лекарственных средств с анальгетической и противовоспалительной активностью обладающих высоким потенциальным значением коэффициента «польза/риск».
В последние десятилетия ряд экспериментальных работ посвящен вопросам химического синтеза и биологической активности N, S-содержащих гетероциклов, удобным реагентом для получения которых служит α-цианотиоацетамид (CAS Number: 7357-70-2). Из него могут быть получены разнообразные структурные аналоги естественных молекул , , . Именно среди них найдены биологически активные соединения с фармакологической активностью фунгицидного и бактерицидного плана, противотуберкулезные, антифибринолитические, антигипертензивные, антигельминтные, цитостатические и многие другие свойства на фоне низкого уровня их острой токсичности. Кроме того, немаловажна составляющая доступности их получения в процессе химического синтеза. Так, исходные компоненты для получения этих соединений являются продуктами массового производства и имеют низкую себестоимость. Для их синтеза не требуется высокотехнологичного либо эксклюзивного оборудования или аппаратов. Все исследуемые образцы получены в результате многокомпонентного синтеза. Это позволяет получать высокую прибавочную стоимость в случае запуска их промышленного изготовления в перспективе . Также, немаловажен факт прогнозируемых минимальных экологических последствий в процессе их синтеза , , , .
Синтезированные коллективом опытных химиков-синтетиков НИЛ «ХимЭкс» ЛГУ им. Владимира Даля под руководством д.хим.н., профессора С.Г Кривоколыско 350 оригинальных производных α-цианотиоацетамида были подвергнуты виртуальному биоскринингу. По итогу избраны десять образцов новых гетероциклических соединений, содержащих 3-аминотиено[2,3-b]пиридиновый и 1,4-дигидропиридиновый фрагменты, наиболее перспективных с учетом предполагаемых биомишеней для фармакокоррекции болевого синдрома. Это образцы с лабораторными шифрами AZ023, AZ169, AZ213, AZ257, AZ331, AZ420, AZ383, AZ729, AU04271 и AU04288. Биомишенями для них по результатам виртуального биоскрининга являются арахидонат-5-липоксигеназа, циклооксигеназа-2, фосфолипаза А2, фосфодиэстераза, простаноидные, соматостатиновые, аденозиновые и каннабиоидные рецепторы.
В процессе исследований болеутоляющей и антиэкссудативной активности этих новых гетероциклических соединений в ряде классических фармакологических тестов на белых лабораторных крысах выявлены образцы-лидеры, в разы эффективнее нимесулида, метамизола натрия, кислоты ацетилсалициловой и индометацина. Это четыре соединения с лабораторными шифрами: AZ023 (3-amino-4-(5-methyl-2-furyl)-5,6,7,8-tetrahydrothieno[2,3-b]quinolin-2-yl](phenyl) methanone); AZ331 (5-cyano-4-(2-furyl)-N-(2-methoxyphenyl)-6-{[2-(4-methoxyphenyl)-2-oxoethyl]thio}-2-methyl-1,4-dihydropyridine-3-carboxamide), AZ420 (5-cyano-4-(2-furyl)-N-(2-methoxyphenyl)-6-({2-[(3-methoxyphenyl) amino]-2-oxoethyl}thio)-2-methyl-1,4-dihydropyridine-3-carboxamide) и AZ383 (3-amino-4-(5-methyl-2-furyl)-5,6,7,8-tetrahydrothieno[2,3-b]quinolin-2-yl] (phenyl)methanone).
Результаты виртуального биоскрининга указывают на то, что конденсированный тиенопиридин с лабораторным шифром AZ-023 потенциально воздействует на простаноидные рецепторы типов ЕР1, ЕР2 и ЕР4, каннабиоидные рецепторы СВ1 типа, арахидонат-5-липоксигеназу, что может объяснять его болеутоляющую активность.
Производное 1,4-дигидропиридина с шифром AZ-213 способно связываться с циклооксигеназой-2, простаноидными рецепторами типов FP, ЕР2 и ЕР4, серотониновым и дофаминовым транспортером. Отобранный из обширной бибилиотеки лаборатории «ХимЭкс» новых органических соединений образец с лабораторным шифром AZ-331 может связываться с коллагеназой-3, фосфолипазой А2, арахидонат-5-липоксигеназой и эндотелиальными рецепторами типа ЕТ-А и ЕТ-В.
Новое производное дигидропиридинов с лабораторным шифром AZ-383 потенциально имеет возможность влиять на активность арахидонат-5-липоксигеназы, воздействовать на аденозиновые рецепторы А1 и А2b и ЦОГ-2.
В этой связи актуальным является оценка их возможного гепатотоксического действия в хроническом эксперименте при детальном изучении морфологических особенностей организации печеночной паренхимы.
Целью исследования является оценка морфологических изменений на гистологических срезах печени крыс после воздействия синтезированных новых гетероциклических соединений с анальгетической активностью.
2. Материалы и методы исследования
Эксперимент реализован на 60 белых крысах (самцах), средняя масса которых составляла 250-280 г. Крысы были распределены на контрольную, референтную и четыре опытных групп. Животные референтной группы получали индометацин в дозе 7 мг/кг однократно в сутки на протяжении 14 дней. Оставшиеся четыре группы включали животных, которым через желудочный зонд в виде водной взвеси вводили оригинальные вновь синтезированные производные производных конденсированных 3-аминотиено[2,3-b]пиридинов и 1,4-дигидропиридинов с наиболее выраженной анальгетической активностью по результатам проведенных ранее экспериментов in vivo. Их структурные формулы приведены на рис.1.
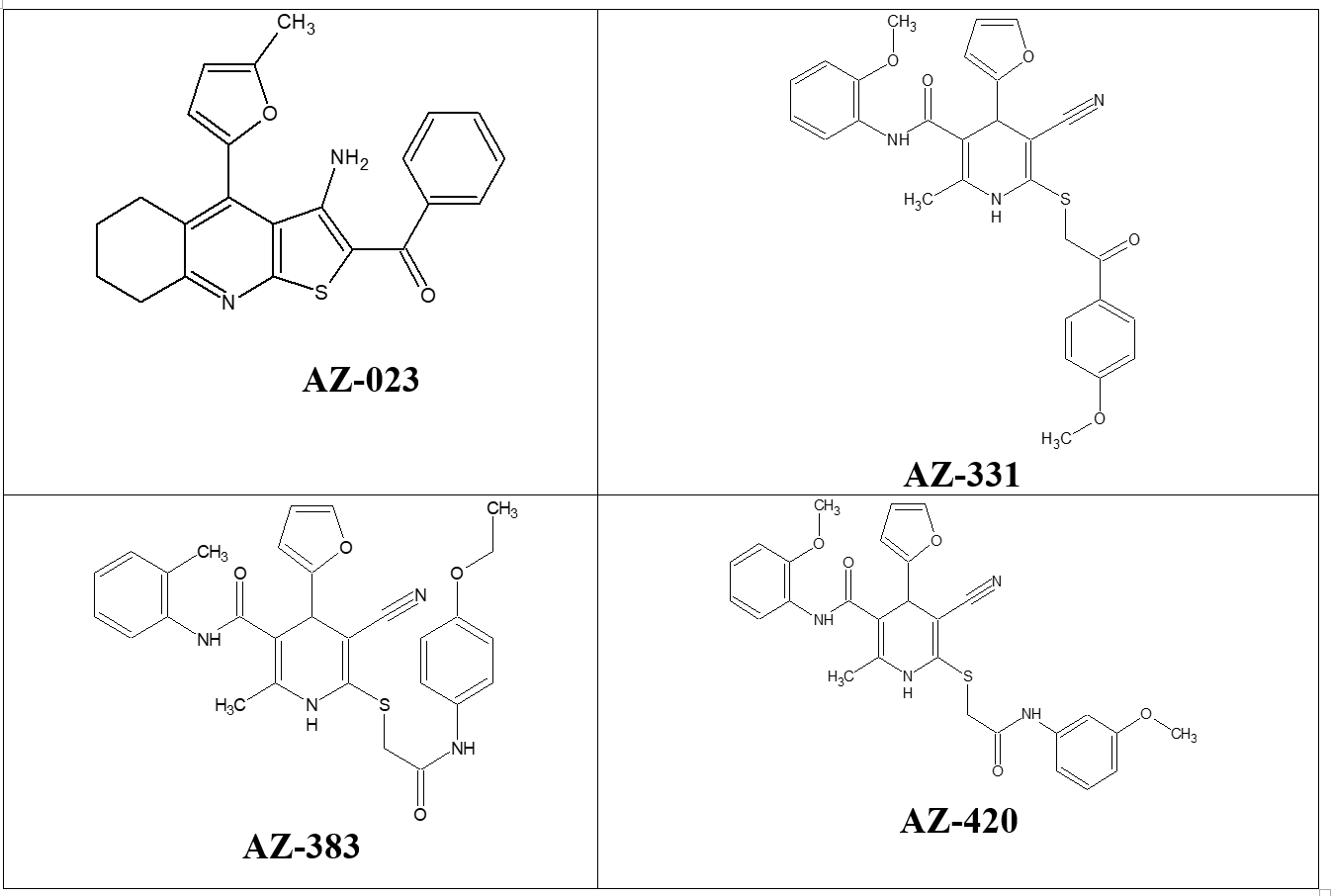
Рисунок 1 - Структурные формулы соединений конденсированных производных тиенопиридина и 1,4-дигидропиридина, отобранных для проведения опытов по исследованию хронической гепатотоксичности
Исследуемые новые гетероциклические соединения вводили в соответствующих группах также внутрижелудочно, в дозе 5 мг/кг однократно в день, в течение 14-х суток крысам, лишенным пищи за 16 часов до опыта. Забой осуществлялся на 15-й день.
После истечения этого периода и планового забоя животных из брюшной полости извлекали печень путем анатомического препарирования. Печень визуально внимательно осматривали. На этом этапе осуществляли взвешивание изучаемого паренхиматозного органа пищеварительной системы крыс всех групп, задействованных в эксперименте. Абсолютную массу органа определяли с помощью весов лабораторных технических ВЛТ. Относительную массу печени вычисляли как отношение абсолютной массы печени к массе крысы и умножали на 100%.
Материалом исследования послужила печень крыс всех вышеописанных групп. Незамедлительно после вывода животных из эксперимента орган тщательно промывали в проточной воде, извлекали кусочки объемом 1 см3. кусочки биоматериала печени были помещены для фиксации в баночки с 10% забуференным формалином при комнатной температуре. По истечении 48 часов биоматериал был подвергнут стандартной пробоподготовке – процессу обезвоживания, обезжиривания и пропиткой парафином, с последующей заливкой в парафиновые блоки.
Для гистологического исследования ткани печени использовались парафиновые срезы толщиной 4 мкм, окрашенные гематоксилином и эозином. Микропрепараты получали при помощи комплекса, включающего микроскоп «Primo Star (Carl Zeiss, Германия)», персональный компьютер, видеорегистратор и программы анализа изображений AxioVision (Rel.4.8.2). Микрофотографии получали в нескольких режимах увеличения: при объективах PlanC N 10x/0.25∞/-/FN22, PlanC N 40x/0.65∞/0.17/FN22, PlanC N 400x/0.25∞/-/FN22 использовали приближение объектива фотоаппарата (zoom) 18,5, оценивая не менее 20 полей зрения.
3. Результаты исследования
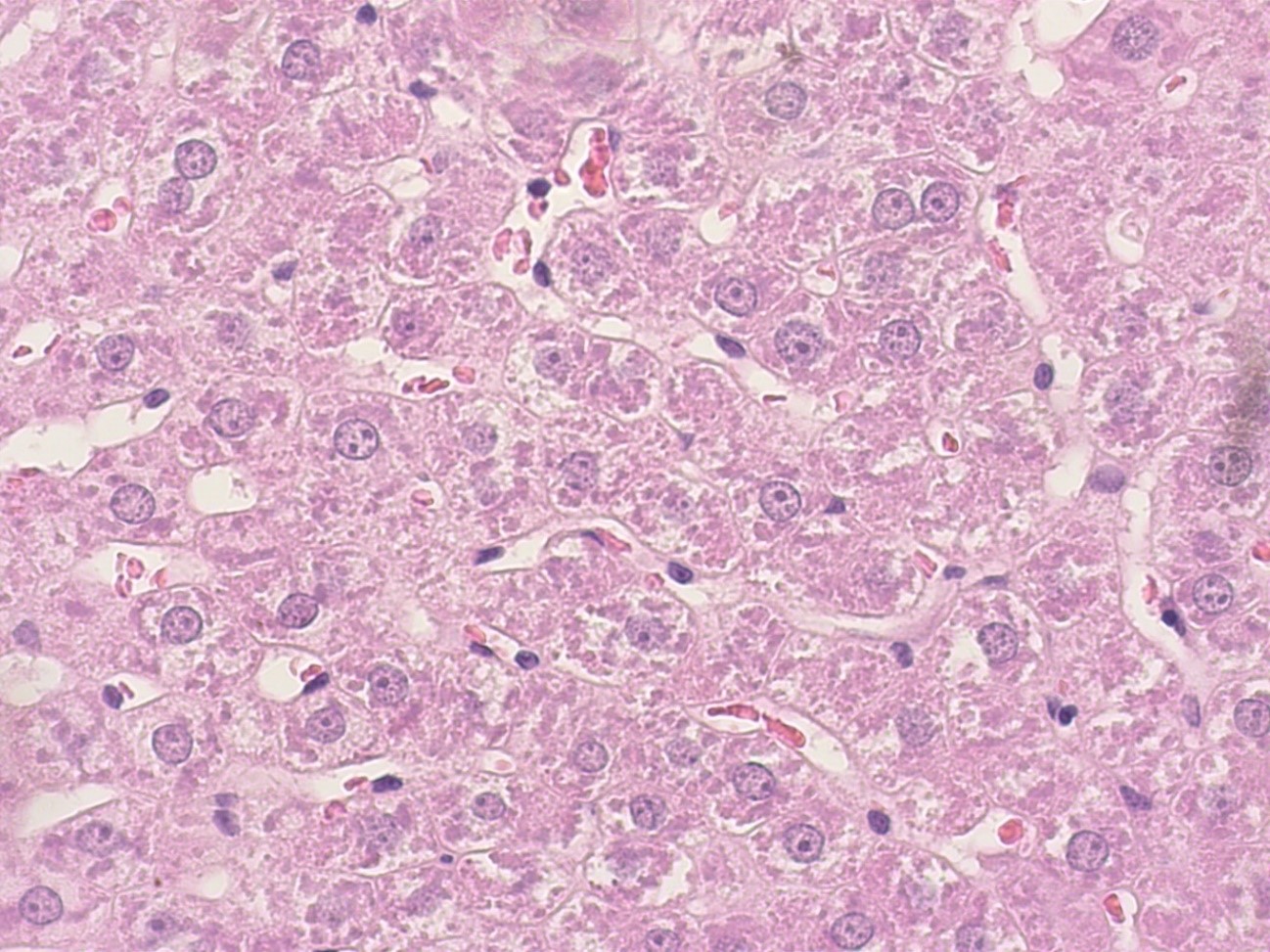
Рисунок 2 - Печень крысы интактной группы
Примечание: PlanC N 400x/0.25∞/-/FN22, окраска гематоксилином-эозином
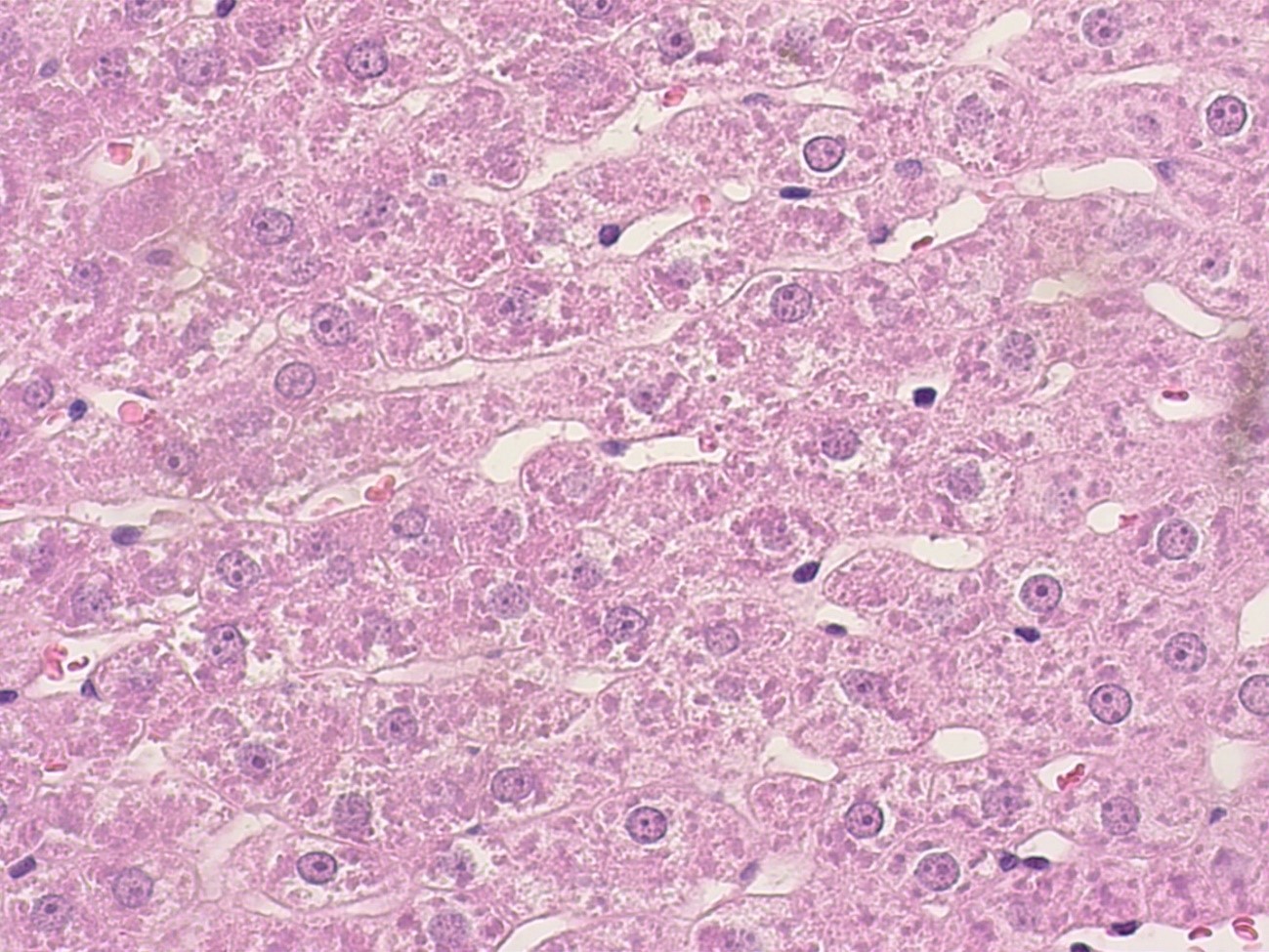
Рисунок 3 - Печень крысы интактной группы
Примечание: PlanC N 400x/0.25∞/-/FN22, окраска гематоксилином -эозином
Зарегистрированные нами при изучении срезов печени крыс, получавших классическое нестероидное противовоспалительное средство индометацин в ходе проведенного нами эксперимента, изменения на светомикроскопическом уровне имеют определенные морфологические особенности. Так, на гистологических срезах печени крыс этой группы отмечались признаки перивенулярного склероза, полнокровие центральных вен, сосудов триад на фоне увеличения диаметра и полнокровия синусоидов. В отдельных клетках печеночной паренхимы определялись морфологические признаки зернистой и вакуольной белковой дистрофии. В центролобулярной и перивенозной зонах выявляются гепатоциты с признаками некроза (рис. 4). По периферии зон некроза нередко определялись двухядерные гепатоциты.
Анализируя данных проведенных экспериментальных исследований, можно прийти к заключению об обнаружении на тканевом уровне признаков токсического поражения исследуемого органа детоксикации индометацином.
В полученных нами данных органометрического и светомикроскопического исследования печени животных опытных групп, получавших внутрижелудочно производные тиенопиридина и 1,4-дигидропиридина, существенных различий гистологической структуры печени в сравнении с животными интактной группы нами не было зафиксировано.
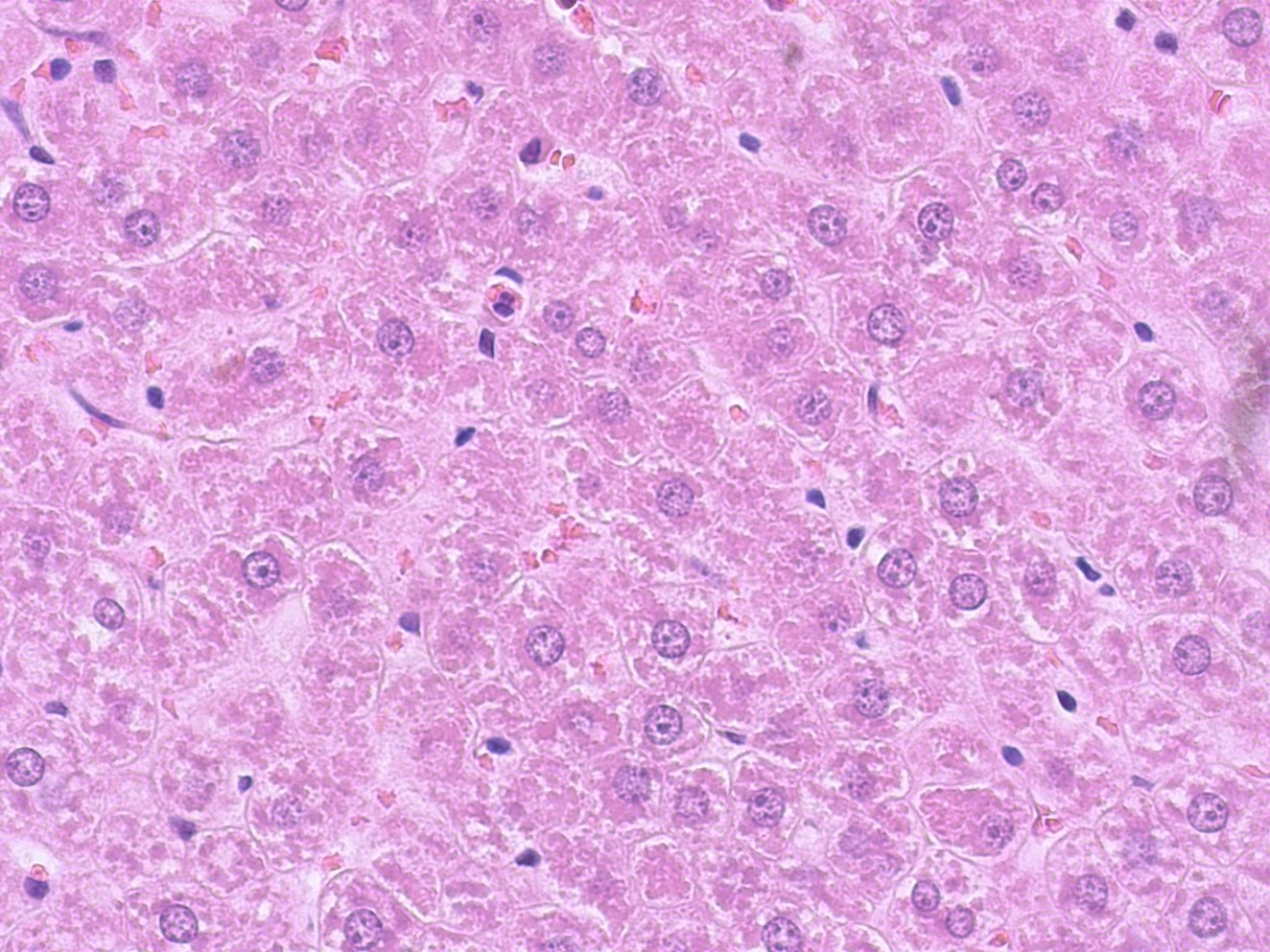
Рисунок 4 - Печень крысы, получавшей индометацин
Примечание: PlanC N 400x/0.25∞/-/FN22, окраска гематоксилином -эозином
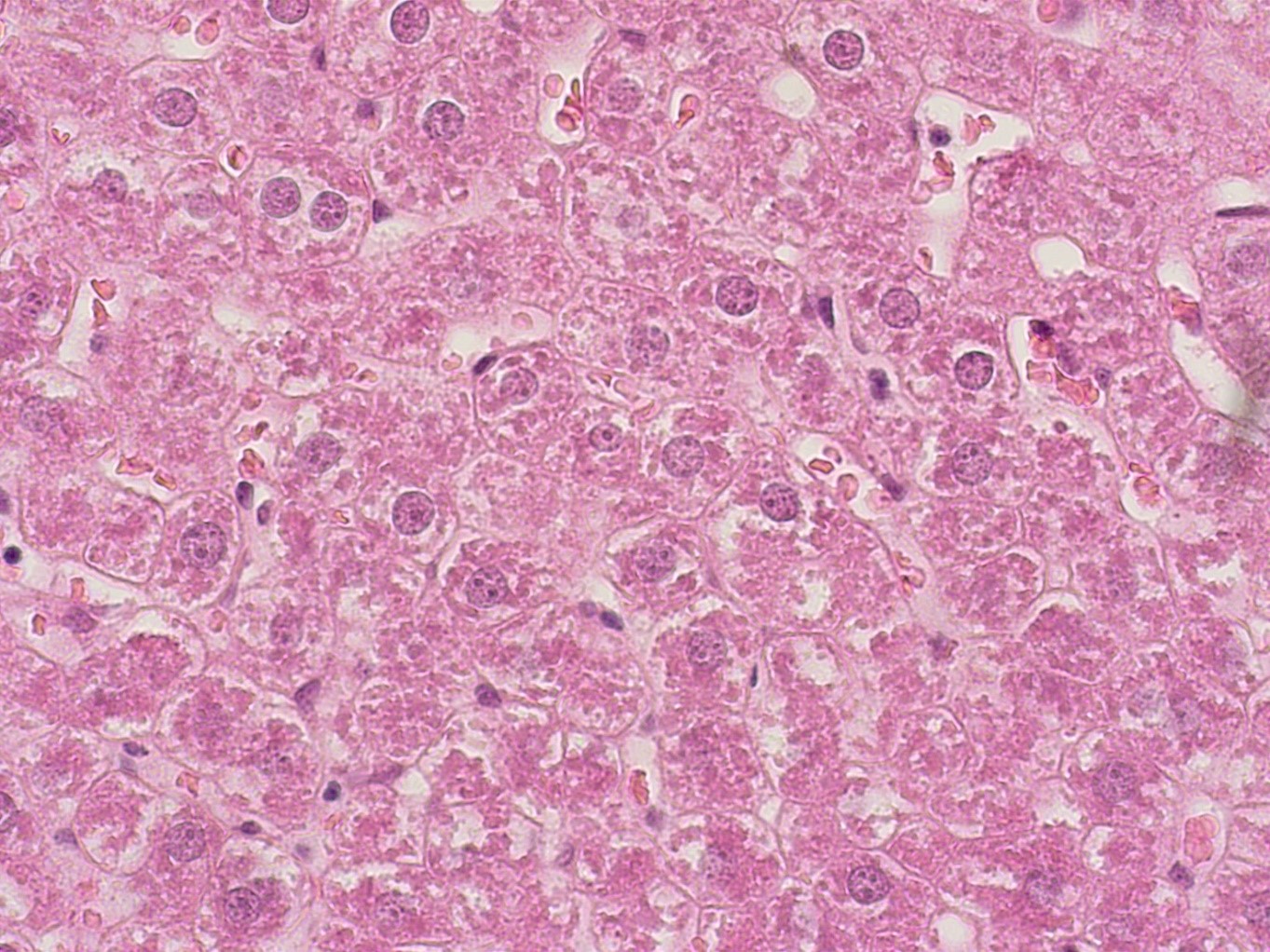
Рисунок 5 - Печень крысы опытной группы после длительного приема производного дигидропиридина с шифром AZ420
Примечание: PlanC N 400x/0.25∞/-/FN22, окраска гематоксилином -эозином
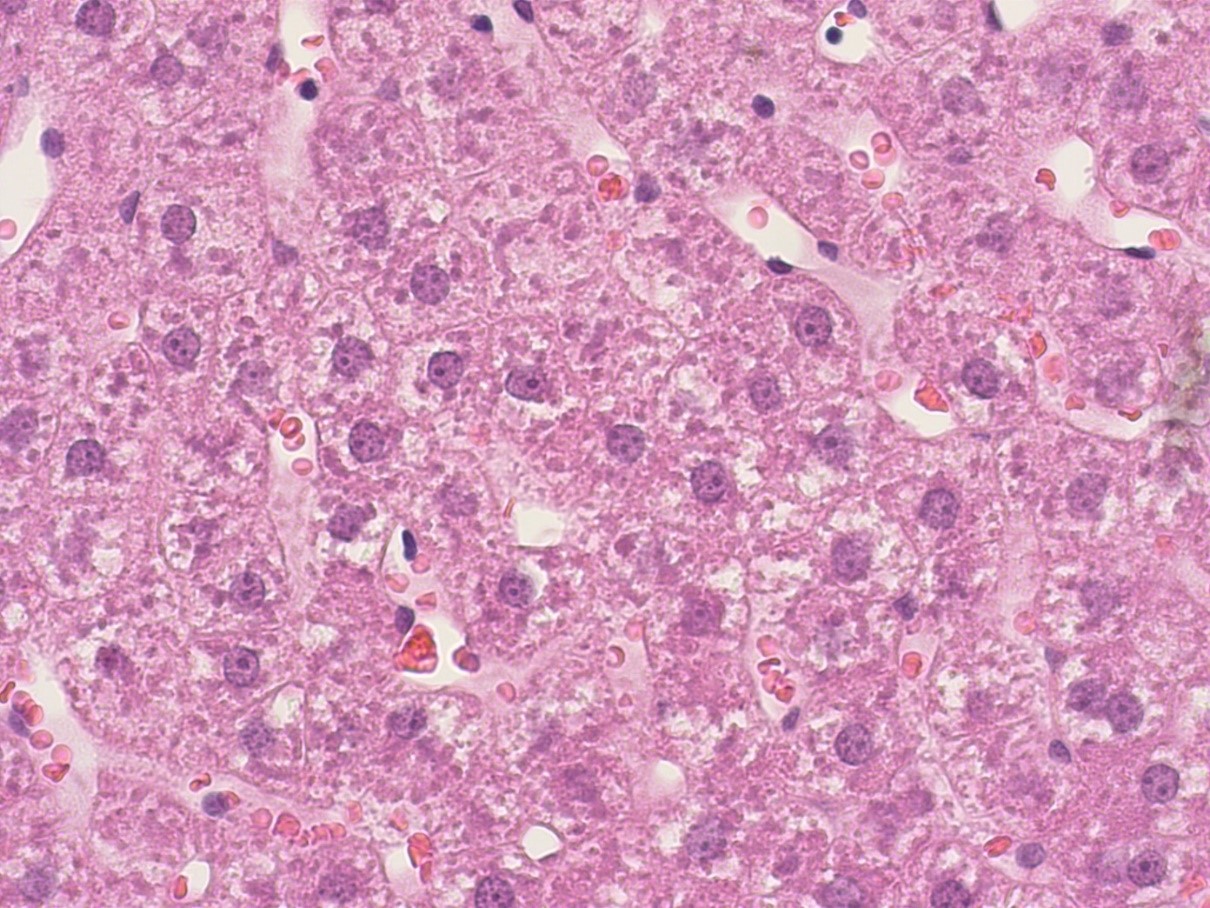
Рисунок 6 - Печень крысы опытной группы после длительного приема производного дигидропиридина с шифром AZ383
Примечание: PlanC N 400x/0.25∞/-/FN22, окраска гематоксилином -эозином
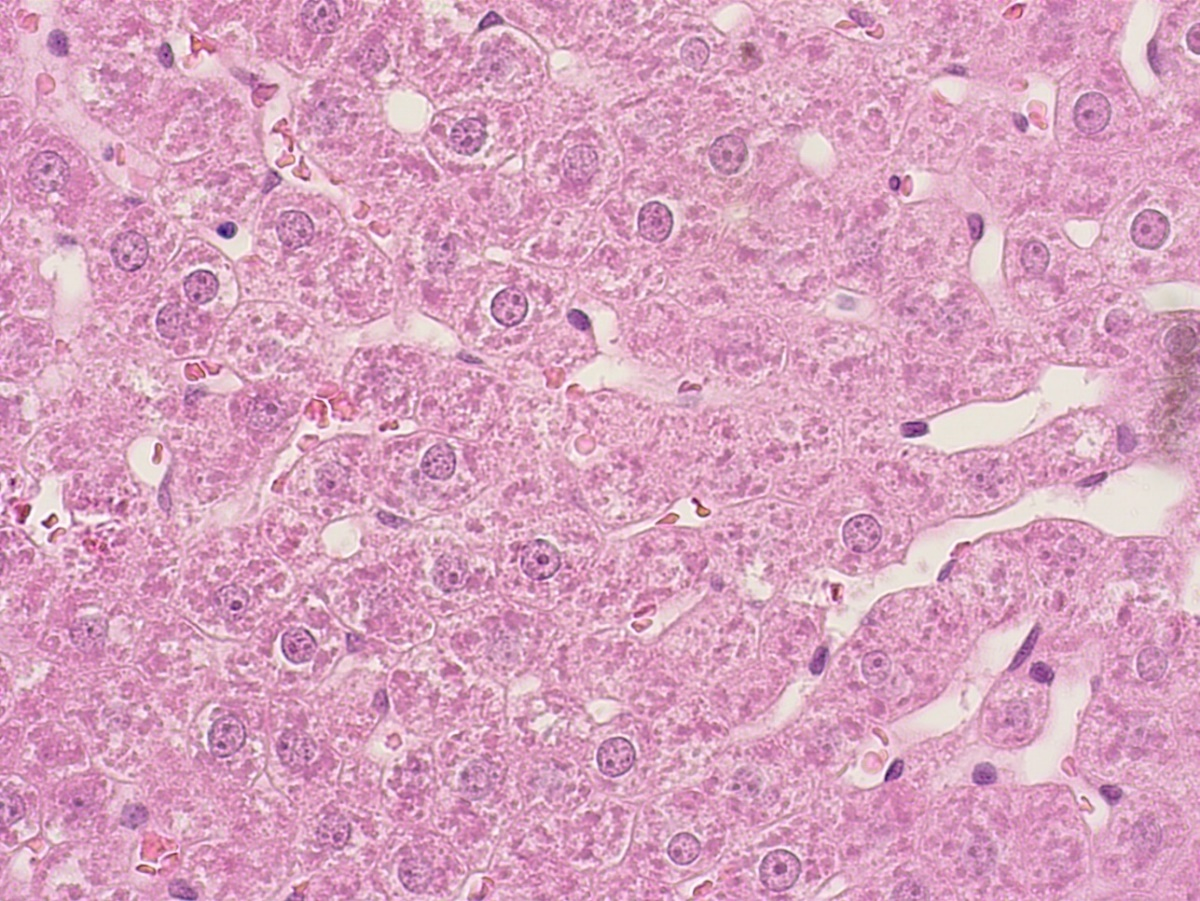
Рисунок 7 - Печень крысы опытной группы после двухнедельного применения производного тиенопиридина с шифром AZ023
Примечание: PlanC N 400x/0.25∞/-/FN22, окраска гематоксилином -эозином
4. Обсуждение результатов
Полученные нами результаты согласуются с данными Л.В. Лазаренко , согласно которым основной биологической мишенью противовоспалительных средств нестероидной структуры на внутриклеточном уровне являются митохондрии. В процессе биотрансформации препаратов этой группы цитохромом Р450 образуются производные НПВС, потенциально способные влиять на процессы переноса электронов в дыхательной цепи на кристах митохондрий. Это активирует нарушение окислительного фосфорилирования, и, соответственно, синтеза АТФ, в конечном итоге приводя к энергодефициту в гепатоцитах. Кроме того, при длительном использовании нимесулида имеет место готовность эпителиоцитов паренхимы основного органа детоксикации к апоптозу под воздействием фактора некроза опухоли TNFαR1. Генетически запрограммированный процесс - апоптоз, иницируется посредством специальных «рецепторов смерти» на поверхности клетки. Также возможен и нерецепторный путь апоптоза, ведущий к активации регуляторных белков, которые угнетают митотическую активность клетки (белок р53) и вызывают фрагментацию ДНК (эндонуклеазы). Кроме того, апоптоз вызывает деградацию жизненноважных белков - протеолитических ферментов, каспаз), нарушают связь клетки с внеклеточным матриксом и др. Морфологическими признаками апоптоза принято считать агрегацию хроматина вблизи кариолеммы, образование мембранных пузырей, конденсацию и фрагментацию клетки с образованием апоптотических телец с последующим их фагоцитозом. Выраженной воспалительной реакции при апоптозе не возникает, в отличие от некроза.
В настоящее время большое внимание уделяется вопросу гепатотоксичности нимесулида, ибупрофена, диклофенака натрия (вольтарена), сулиндака и индометацина , .
Кроме того, нарушение процессов окислительного фосфорилирования в митохондриях и микросомальное окисление некоторых НПВП (например, напроксена) приводят к активации свободно-радикального окисления, результатом чего в конечном счете является дезорганизация мембран, гибель гепатоцита и синтопичных клеточных структур (клетки желчных протоков). Возможно, что в процессе дезорганизации цитолемма приобретает антигенные свойства, что приводит к индукции аутоиммунного ответа и морфологически проявляется как перипортальный отек и мононуклеарная инфильтрация.
В настоящее время большое внимание уделяется вопросу гепатотоксичности нимесулида, ибупрофена, диклофенака натрия (вольтарена), сулиндака и индометацина , . В патогенезе НПВП-ассоциированного поражения печени также, по данным отдельных авторов, обсуждается роль блокады ферментных систем цикла Кребса и разобщения окислительного фосфорилирования (по типу синдрома Рейе) в митохондриях гепатоцитов . Есть информация о блокаде препаратами этой фармакологической группы фосфодиэстеразы IV. Также немаловажным являются нарушения экскреции желчи как результат образования объемных комплексов метаболитов противовоспалительных средств с желчными кислотами в контексте изучаемой проблематики.
5. Заключение
По результатам морфологических исследований по изучению хронической гепатотоксичности четырех новых производных конденсированных 3-аминотиено[2,3-b]пиридинов и 1,4-дигидропиридинов с выраженными анальгетическими свойствами установлено отсутствие неблагоприятного их влияния на структуру печеночной паренхимы.
