AN EVALUATION OF THE COMBINATION OF ANALGESIA/ANAESTHESIA WITH MODERATE HYPOTHERMIA IN A RAT CRANIOCEREBRAL TRAUMA MODEL IN AN EXPERIMENT
AN EVALUATION OF THE COMBINATION OF ANALGESIA/ANAESTHESIA WITH MODERATE HYPOTHERMIA IN A RAT CRANIOCEREBRAL TRAUMA MODEL IN AN EXPERIMENT
Abstract
It is well known that hypothermia is one of the effective therapeutic measures after experimental brain injury. The aim of the study was to evaluate the combination of narcotic analgesia/anaesthesia with moderate hypothermia in an experimental rat model of traumatic brain injury. Contrary to our hypothesis, the lesion volume assessed 72 hours after PMT was markedly greater in rats in the hypothermia group (p < 0.05). Representative frontal brain slices confirmed that the contusion volume was almost twice as large in animals with hypothermia compared to normothermia. In animals in group 2, there were more pronounced structural changes in the brain substance, manifested by the presence of areas of local oedema and predominantly cortical haemorrhages and areas of perivascular swelling.
1. Введение
Достоверно известно, что гипотермия одна из действенных мер лечебного воздействия после экспериментальной черепно-мозговой травмы (ЧМТ), однако, несмотря на огромный потенциал применения гипотермии после ЧМТ в эксперименте, в клинической практике встречаются противоречивые результаты. Это очевидное несоответствие может быть связано с рядом факторов, обусловленных экстраполяцией результатов экспериментальных моделей в клиническую практику.
Одной из потенциальных причин являются различия в режимах анестезии/анальгетиков в экспериментальных и клинических условиях. Выбор анестетика/анальгетика после ЧМТ может существенно повлиять на исход. В большинстве экспериментальных моделей ЧМТ гипотермия применялась к грызунам, подвергнутым анестезии ингаляционными анестетиками, такими, как изофлюран, галотан, эфир анестетический. В то же время в литературе встречается информация о том, что комбинация Ксилазин гидрохлорид + «Золетил 100» обладают определенной нейропротекцией
, , . Поскольку гипотермия продемонстрировала такое достоверное преимущество в экспериментальных моделях, казалось логичным, что гипотермия будет терапевтическим вмешательством, исследованным на крысах, получающих наркотическую анестезию/анальгезию после ЧМТ.Цель исследования – оценить сочетание наркотической анальгезии/анестезии с умеренной гипотермией на модели ЧМТ у крыс в эксперименте.
2. Методы и принципы исследования
Все манипуляции с животными проводились в соответствии с Руководством по содержанию и использованию лабораторных животных
. Эксперимент проводился на 20 животных (нелинейные белые крысы обоего пола массой 220-335 г.). Животным выполнено анестезиологическое пособие (наркоз), включающее интраперитонеальное введение (и/п) препаратов: «Ксилазина гидрохлорида» (из расчета 0,5 мл/кг массы тела) и «Золетил 100» (из расчета 8мг/кг массы тела) . Выполнялась респираторная поддержка. Моделирование черепно-мозговой травмы наркотизированным животным проводилось по стандартной методике . После чего трепанационное окно закрывалось цементом для пломбирования, кожа подшивалась. Животные были разделены на группы: Группа 1 (n=10) – ЧМТ + нормотермия (температура головного мозга поддерживалась на уровне 37 ± 0,5°С).Группа 2 (n=10) – ЧМТ+ гипотермия (крыс обкладывали гипотермическими пакетами-контейнерами, до достижения температуры мозга 32°С.). Гипотермию поддерживали в течение 1 часа, затем крыс отогревали постепенно в течение 1 часа со скоростью +1°C каждые 10-12 минут с помощью электрической грелки.
На аппаратном комплексе «BIOPAC» в соответствии со стандартными методиками производился мониторинг температуры тела, парциального давления кислорода (Р02), парциального давления углекислого газа (РС02), среднего артериального давления (САД), частоты сердечных сокращений (ЧСС), рН
. На 3 сутки часть животных выводилась из эксперимента путем эвтаназии, под наркозом, с соблюдением всех принципов гуманного отношения к животным. Полученный биоматериал (головной мозг) фиксировали в 10% растворе формалина, осуществлялось иссечение биоматериала, заливка в парафин, приготовление срезов, с последующим окрашиванием гематоксилином и эозином по стандартной методике.Статистическую обработку полученных данных проводили при помощи пакета программ «Statistica 10.0». Был применен параметрический t-критерий Стьюдента и критерий Манна-Уитни. Результаты представлены следующим образом, М ± m (М – среднее, m – ошибка среднего). Различия принимались за статистически значимые при p < 0,05.
3. Основные результаты
Температура головного мозга (Тгм), и ректальная температура (Тр) были значительно ниже во время гипотермического периода у крыс, с гипотермией, в сравнении с группой нормотермии (Тгм (группа 2) = 32,1 ± 0,1 Сº в сравнении с Тгм (группа 1) = 37,3 ± 0,04 °C, p < 0,05; Тр (группа 2)= 32,0 ± 0,1Сº в сравнении с Тр (группа 1)= 37,3 ± 0,1Сº, р < 0,05). Мозговая и ректальная температуры не отличались между группами до ЧМТ и в конце обогрева. Статистически значимых различий между остальными исследуемыми параметрами в рамках данного эксперимента не было выявлено (см. таб. 1).
Таблица 1 - Показатели САД, ЧСС, PO2, PCO2, pH, температуры головного мозга, и ректальной температуры через 1 час с момента начала эксперимента
Показатель | Группа 1 (n=10) – ЧМТ + нормотермия | Группа 2 (n=10) - ЧМТ+ гипотермия |
САД, мм.рт ст. | 123,45 ± 17,04 | 121,37 ± 13,21 |
Частота сердечных сокращений (ЧСС), (уд. в мин) | 332,4 ±6,9 | 332,8 ±7,1 |
PО2, мм.рт ст. | 55,8±3,1 | 54,7±3,2 |
PCО2, мм.рт ст. | 48,8±8,1 | 46,5 ± 7,2 |
pH | 7,42±0,01 | 7,42±0,01 |
Температура головного мозга (Тгм), Сº | 37,3 ± 0,04 | 32,1 ± 0,1* |
Температура ректальная (Тр),Сº | 37,3 ± 0,1С | 32,0 ± 0,1* |
Примечание: * – различия статистически значимы по отношению к группе 1 (р < 0,05)
Вопреки нашей гипотезе, объем поражения, оцененный через 72 часа после ЧМТ, был заметно больше у крыс, в группе с гипотермией (p < 0,05). Репрезентативные фронтальные срезы головного мозга подтвердили, что объем контузии был почти в двое больше у животных с гипотермией в сравнении с нормотермией. Умеренная гипотермия оказалась скорее вредной, чем полезной после экспериментальной ЧМТ у наркотизированных крыс (рис. 1).
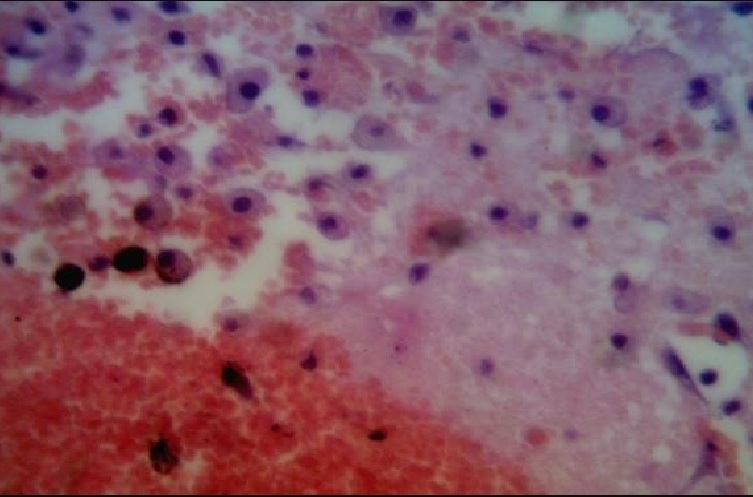
Рисунок 1 - Пример микрофотография коры полушарий головного мозга через 72 часа от начала эксперимента у крыс в группе №2, х100, окр. гематоксилин + эозин
Применение умеренной гипотермией в одиночку недостаточно, чтобы ослабить посттравматическую эксайтотоксичность . Еще одной причиной, почему после ЧМТ гипотермия и анестезиологическое обеспечение, включающее Ксилазин гидрохлорид + «Золетил 100» и/п неспособны обеспечить нейропротекцию, связано с СМК. На фоне ЧМТ стремительно развивается гипоперфузия, а системная гипотермия может еще больше снизить CМК, что можно наблюдать на экспериментальных моделях ЧМТ, вызванных жидкостно-перфузионным повреждением
, . По результатам нашего эксперимента, можно предположить, что комбинация ксилазин-золетилового наркоза и гипотермия после ЧМТ, возможно усиливает несоответствие перфузии и метаболизма головного мозга и дополнительно инициирует повреждение нейронов, но требуется проведение дальнейших исследований в этой области.Измененный метаболизм препарата с последующей прямой нейротоксичностью также может снижать эффективность гипотермии после ЧМТ с ксилазин-золетиловым наркозом. Другие механизмы также могут способствовать неблагоприятным последствиям гипотермии после ЧМТ на фоне применения ксилазин-золетилового наркоза. Гипотермия влияет на множество других каскадов повреждений, которые мы не обсуждали в данной статье, включая посттравматический окислительный стресс и экспрессию генов. Эффективность посттравматической гипотермии может варьироваться в зависимости от степени тяжести травмы, оказывая более высокие результаты при легкой ЧМТ. Хотя долгосрочные гистопатологические и функциональные результаты еще предстоит определить.4. Заключение
Удивительно, но объем контузии увеличился за счет применения умеренной гипотермии сразу после ЧМТ у крыс под ксилазин-золетиловым наркозом. Поскольку лечение с помощью гипотермии обеспечило достоверное преимущество при экспериментальной ЧМТ с анестезией ингаляционными анестетиками, это позволяет предположить, что режим анестезии/анальгетика после ЧМТ может резко влиять на ответ на другие терапевтические вмешательства, такие как гипотермия, но для установления корреляционных параллелей требуется проведение дальнейших исследований.
